Potřebujeme nová antibiotika?
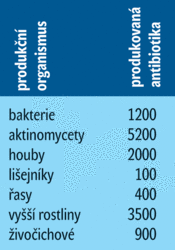
Infekční nemoci nepochybně představují jednu z nejvýznamnějších příčin úmrtí v lidské populaci a pravděpodobně hlavní příčinu úmrtnosti u dětí. Některé mikroorganismy působí lidem závažné zdravotní problémy (viz tab. I). Dlouho se zdálo, že jsou antibiotika všemocnou zbraní, která infekční choroby „vymýtí“. Bakterie ale poměrně rychle začaly být proti antibiotikům rezistentní (viz tab. II).
Známá a využívaná antibiotika
 Odhaduje se, že dosud bylo popsáno řádově 104 přirozených antibiotik. Existuje však také velké množství (řádově 105) antibiotik chemicky nebo jinak modifikovaných, z nichž se pouze 102 využívá klinicky. Proč tak málo? Některá antibiotika jsou toxická či špatně rozpustná ve vodě, popřípadě mají podobné účinky jako antibiotika již používaná. Navíc k většině klinicky používaných antibiotik již existují rezistentní kmeny bakterií.
Odhaduje se, že dosud bylo popsáno řádově 104 přirozených antibiotik. Existuje však také velké množství (řádově 105) antibiotik chemicky nebo jinak modifikovaných, z nichž se pouze 102 využívá klinicky. Proč tak málo? Některá antibiotika jsou toxická či špatně rozpustná ve vodě, popřípadě mají podobné účinky jako antibiotika již používaná. Navíc k většině klinicky používaných antibiotik již existují rezistentní kmeny bakterií.
 Rezistence na antibiotika trvale narůstá (viz Vesmír 86, 455, 2007/7). Lidská populace stárne, mnozí pacienti prodělali chirurgické zákroky, mají implantované náhrady nebo podstupují imunosupresivní terapii. Mikrobní patogeny tak představují vážné ohrožení. Zvláště nebezpečné jsou patogenní mikroorganismy ve formě mikrobiálních biofilmů (viz Vesmír 80, 203, 2001/4). Bakteriální sepse je už teď jednou z hlavních příčin úmrtí starších pacientů. Nadměrné užívání antibiotik selektovalo kmeny rezistentní na antibiotika, některé z nich jsou rezistentní na více antibiotik zároveň. Původně se nacházely pouze v nemocnicích, nyní však je již jejich výskyt mnohem rozšířenější.
Rezistence na antibiotika trvale narůstá (viz Vesmír 86, 455, 2007/7). Lidská populace stárne, mnozí pacienti prodělali chirurgické zákroky, mají implantované náhrady nebo podstupují imunosupresivní terapii. Mikrobní patogeny tak představují vážné ohrožení. Zvláště nebezpečné jsou patogenní mikroorganismy ve formě mikrobiálních biofilmů (viz Vesmír 80, 203, 2001/4). Bakteriální sepse je už teď jednou z hlavních příčin úmrtí starších pacientů. Nadměrné užívání antibiotik selektovalo kmeny rezistentní na antibiotika, některé z nich jsou rezistentní na více antibiotik zároveň. Původně se nacházely pouze v nemocnicích, nyní však je již jejich výskyt mnohem rozšířenější.
 V nemocnicích mohou rezistentní bakterie přežívat dlouhodobě a způsobovat epidemie například na jednotkách intenzivní péče. Riziko infekce vzrůstá s dobou strávenou v nemocnici. Vankomycin byl dlouho pokládán za „antibiotikum poslední volby“ proti kmenům Staphylococcus aureus rezistentním na methicilin, objevují se však již kmeny rezistentní i proti vankomycinu. Některé patogenní bakterie na jednotkách intenzivní péče, například Acinetobacter baumanii, bývají popisovány jako „panrezistentní“. Vývoj rostoucí rezistence těchto bakterií vzbuzuje obavy ze selhání antibiotické léčby.
V nemocnicích mohou rezistentní bakterie přežívat dlouhodobě a způsobovat epidemie například na jednotkách intenzivní péče. Riziko infekce vzrůstá s dobou strávenou v nemocnici. Vankomycin byl dlouho pokládán za „antibiotikum poslední volby“ proti kmenům Staphylococcus aureus rezistentním na methicilin, objevují se však již kmeny rezistentní i proti vankomycinu. Některé patogenní bakterie na jednotkách intenzivní péče, například Acinetobacter baumanii, bývají popisovány jako „panrezistentní“. Vývoj rostoucí rezistence těchto bakterií vzbuzuje obavy ze selhání antibiotické léčby.
Jak se můžeme bránit?
 Možností obrany je několik, například příprava vakcín proti rezistentním kmenům bakterií, využití specifických bakteriofágů či hledání nových antibiotik. Každá z možností má své výhody i nevýhody. Existují nebo se připravují vakcíny proti sexuálně přenosným nemocem, proti respiračním chorobám, proti střevním onemocněním, proti infekčním agens přenášeným různými přenašeči (vektory) a proti některým nemocničním infekcím.1)
Možností obrany je několik, například příprava vakcín proti rezistentním kmenům bakterií, využití specifických bakteriofágů či hledání nových antibiotik. Každá z možností má své výhody i nevýhody. Existují nebo se připravují vakcíny proti sexuálně přenosným nemocem, proti respiračním chorobám, proti střevním onemocněním, proti infekčním agens přenášeným různými přenašeči (vektory) a proti některým nemocničním infekcím.1)
Bakteriofágy se zatím dají k terapeutickým postupům používat jen obtížně. Jsou pro svého hostitele specifické, a je proto nutné nalézt pro daného pacienta vhodného bakteriofága ještě před začátkem léčby. Navíc u některých bakterií (například Clostridium a Mycobacterium) dosud nebyly žádné terapeutické fágy nalezeny. Protože jsou bakteriofágy vlastně viry, mohou mít také některé nepříznivé účinky, o nichž dosud nevíme.
 Zdá se tedy, že antibiotika mají pořád ještě velký terapeutický význam a je třeba hledat látky, které by byly účinné proti bakteriím rezistentním na běžná antibiotika. Nejvíce antibiotik bylo nalezeno a popsáno v letech 1955 až 1977, pak zájem farmaceutických firem o nová antibiotika významně opadl, i když se tehdy pořád ještě na hledání nových antibiotik vynakládaly nemalé prostředky. Ne že by již nebylo možno objevit nové látky, ale spíše některá nová antibiotika vykazovala stejný nebo podobný mechanismus účinku jako látky známé. Navíc se náklady na výzkum a vývoj nových antibiotik trvale zvyšují, tudíž se to farmaceutickým firmám nevyplácí. Čistá současná hodnota,2) která je mírou pravděpodobné výnosnosti léčiva, je pro antibiotika nevýhodná.3) Předpokládá se však, že se toto číslo může – kvůli podstatně přísnějším požadavkům schvalujících institucí4) a stoupajícímu počtu lidí v klinických studiích – ještě snížit.
Zdá se tedy, že antibiotika mají pořád ještě velký terapeutický význam a je třeba hledat látky, které by byly účinné proti bakteriím rezistentním na běžná antibiotika. Nejvíce antibiotik bylo nalezeno a popsáno v letech 1955 až 1977, pak zájem farmaceutických firem o nová antibiotika významně opadl, i když se tehdy pořád ještě na hledání nových antibiotik vynakládaly nemalé prostředky. Ne že by již nebylo možno objevit nové látky, ale spíše některá nová antibiotika vykazovala stejný nebo podobný mechanismus účinku jako látky známé. Navíc se náklady na výzkum a vývoj nových antibiotik trvale zvyšují, tudíž se to farmaceutickým firmám nevyplácí. Čistá současná hodnota,2) která je mírou pravděpodobné výnosnosti léčiva, je pro antibiotika nevýhodná.3) Předpokládá se však, že se toto číslo může – kvůli podstatně přísnějším požadavkům schvalujících institucí4) a stoupajícímu počtu lidí v klinických studiích – ještě snížit.
V uplynulém desetiletí mnohé farmaceutické firmy přestaly podporovat hledání nových antiinfekčních látek a přesměrovaly své výzkumné a vývojové záměry do jiných oblastí, které se zdají být ziskovější. Nebylo to však pouze z ekonomických důvodů, hlavním důvodem byla malá úspěšnost cíleného hledání nových antibiotik. I když jsou důvody hlavně ekonomické, neměli bychom farmaceutický průmysl pokládat pouze za ziskuchtivého bezohledného dravce. Většinou se choval odpovědně a určitě významně přispěl k trvale se zlepšující kvalitě lidského zdraví.
V devadesátých letech mnohé velké farmaceutické firmy investovaly značné prostředky do bakteriální genomiky s cílem nalézt antibiotika, která mají nová zásahová místa. Používaly se vyhledávací programy,5) směrované však hlavně na sbírky nízkomolekulárních látek.
 Pouze několik výsledných sloučenin se nakonec dostalo na trh a do klinické praxe hlavně proto, že vyhledávací programy využívaly knihovny malých lipofilních sloučenin, které splňují Lipinského „pravidla pěti“: molekulová hmotnost musí být menší než 500 g/mol, log P (rozdělovací koeficient oktanol – voda) menší než pět, počet donorů vodíkových vazeb (skupiny OH a NH) menší než pět a počet akceptorů vodíkových vazeb (zejména N a O) také menší než pět. Většina klinicky významných antibiotik však tato pravidla nesplňuje.
Pouze několik výsledných sloučenin se nakonec dostalo na trh a do klinické praxe hlavně proto, že vyhledávací programy využívaly knihovny malých lipofilních sloučenin, které splňují Lipinského „pravidla pěti“: molekulová hmotnost musí být menší než 500 g/mol, log P (rozdělovací koeficient oktanol – voda) menší než pět, počet donorů vodíkových vazeb (skupiny OH a NH) menší než pět a počet akceptorů vodíkových vazeb (zejména N a O) také menší než pět. Většina klinicky významných antibiotik však tato pravidla nesplňuje.
Přístupy při hledání nových antibiotik jsou především tyto: 1. hledání nových antibiotik z netradičních zdrojů, 2. hledání genů specifikujících biosyntézu antibiotik v přirozeném prostředí (zejména ve vodě a půdě), jejich klonování a využití, 3. hledání nových zásahových míst pro antibiotika v patogenních bakteriích a 4. příprava hybridních antibiotik pomocí kombinace specifických genů z různých antibiotických klastrů na základě kombinatoriální biosyntézy.
Netradiční zdroje
Probíhá rozsáhlý výzkum producentů antibiotických látek (viz tab. III) na extrémních lokalitách, jako jsou horké prameny, hluboké podmořské gejzíry nebo vodní rezervoáry s vysokou koncentrací solí. Zdaleka nejvýznamnějšími producenty antibiotik jsou streptomycety, vláknité grampozitivní bakterie, které se nacházejí především v půdě. Poměrně nedávno však byly popsány nové biologicky aktivní látky produkované mořskými
streptomycetami (viz tab. IV).
Mikrobní genomové sekvence
 Mikrobní genomové sekvence je možno využívat pro hledání nových sloučenin – potenciálních antibiotik. Cena sekvenování se snižuje a jeho rychlost zvyšuje, a tak hledání mikrobních taxonů s vysokým potenciálem pro biosyntézu biologicky aktivních látek představuje pro získání nových antibiotik velkou naději. Poznanou genetickou informaci je také možno využívat v postupech kombinatoriální biosyntézy. Mnoho genů kódujících biosyntézu antibiotik se neexprimuje (jsou to „tiché geny“). Proto se studují molekulové signály zapínající tvorbu látek, které původně nebylo možno identifikovat.
Mikrobní genomové sekvence je možno využívat pro hledání nových sloučenin – potenciálních antibiotik. Cena sekvenování se snižuje a jeho rychlost zvyšuje, a tak hledání mikrobních taxonů s vysokým potenciálem pro biosyntézu biologicky aktivních látek představuje pro získání nových antibiotik velkou naději. Poznanou genetickou informaci je také možno využívat v postupech kombinatoriální biosyntézy. Mnoho genů kódujících biosyntézu antibiotik se neexprimuje (jsou to „tiché geny“). Proto se studují molekulové signály zapínající tvorbu látek, které původně nebylo možno identifikovat.
Než byla dokončena sekvence chromozomu Streptomyces coelicolor, byla u této streptomycety známa pouze tři antibiotika a jeden sporový pigment. Po sekvenování bylo nalezeno 25 těsně svázaných genových skupin (klastrů), kódujících biosyntézu pigmentů, složitých lipidů a signálních molekul.
U Streptomyces avermitilis byla před sekvenováním známa pouze veterinární antibiotika avermektiny, zatímco po sekvenování bylo identifikováno 30 genových klastrů kódujících biosyntézu biologicky účinných sekundárních metabolitů (viz tab. V).
Matematický model, který vypracoval M. G. Watve s kolegy, naznačuje, že u streptomycet bude ještě možno najít mnoho nových antibiotik, podle modelu 294 300 dosud nepopsaných sloučenin, ale i podle konzervativnějších odhadů asi 150 000. Zatím byla popsána pouze asi 3 % antibiotik produkovaných streptomycetami (viz obr. 1).
Odhaduje se, že jen 1–2 % mikroorganismů lze kultivovat, o většině buď vůbec nevíme, nebo je neumíme kultivovat v laboratorních podmínkách. Předpokládá se také, že z mořské vody se zatím kultivovalo 0,001–1 % přítomných mikroorganismů, ze sladké vody 0,25 %, z půdy 0,3 % a zřejmě nejvíce (1–15 %) z aktivovaného kalu. Dosud známé antimikrobní a jiné biologicky aktivní látky tedy byly získány pouze z omezeného rezervoáru biodiverzity. Mnoho dalších skupin producentů pořád ještě na svou identifikaci a využití čeká. Nové skupiny chemických látek mohou být objeveny pomocí přístupů ekologických, taxonomických a metagenomických.
Metagenomika – analýza DNA přímo z prostředí
Metagenomika se objevila poměrně nedávno, a to jako nástroj pro analýzu mikrobníchspolečenstev bez ohledu na schopnosti kultivovat členské mikroorganismy v laboratorních podmínkách. Genomika se tu uplatňuje na dosud nekultivované mikroorganismy. Jde o genomovou analýzu mikroorganismů ve vzorcích DNA získaných přímo z prostředí, přičemž se DNA vhodně opracuje a klonuje v kultivovatelném mikrobním producentovi a nalezené geny kódující biosyntézu antibiotik a dalších biologicky aktivních sekundárních metabolitů se dále využívají.
Vývoj metagenomiky podpořily doklady o tom, že dosud nekultivované mikroorganismy představují převládající organismy ve většině prostředí na Zemi. Důkazem jsou analýzy genových sekvencí ribozomální RNA přímo v prostředí. Jde o přístup, který není závislý na kultivaci a který vedl k objevu ohromujících nových vazeb mikrobního světa.
Geny kódující biosyntézu sekundárních metabolitů
Zatím nejvíce se studovala manipulace genů kódujících modulární polyketidsyntázy. Polyketidy jsou skupina různorodých mikrobních sekundárních metabolitů, které mají složitou chemickou strukturu a široké rozpětí biologických aktivit. Patří sem sloučeniny antibakteriální (erytromycin, klaritromycin, azitromycin, tetracyklin), látky snižující koncentraci cholesterolu v krvi (mevakor, zokor), protinádorové (adriamycin), antiparazitární (avermektin) či potlačující imunitní reakci (FK506, rapamycin). Navíc mají všechny společný biosyntetický mechanismus (viz obr. 2). Pomocí genetické manipulace polyketidsyntáz je tedy možno připravit nové odvozeniny známých polyketidů.
Zapomenuté přírodní látky a jejich transformace
Moderní chemické metody a podobně také metody genomiky a kombinatoriální biosyntézy je možno využít pro modifikaci známých látek s určitou biologickou aktivitou. Během „zlatého období“ antibiotik byly objeveny tisíce biologicky aktivních sloučenin. Mnoho z nich se však dále nevyvíjelo buď proto, že byly k dispozici lepší látky s podobnými účinky, nebo že bylo obtížné udělat z nich léky, protože měly nevyhovující farmakologické vlastnosti. Možnosti modifikovat přírodní sloučeniny chemickými a genetickými metodami se podstatně zlepšily a nové postupy se mohou nyní spojit při revitalizaci cenných biologicky aktivních látek, které mohou být užitečné zejména v případech, kdy je patogenní mikroorganismus již na běžná antibiotika rezistentní.
Nová zásahová místa
Ještě v r. 1985 mnozí z významných vědců pochybovali, že je vůbec možné lidský genom sekvenovat. Další očekávali, že to bude trvat několik desítek let, někteří to odhadovali na sto let. Nakonec byl lidský genom sekvenován ještě dříve, než jak věřili hlavní aktéři tohoto projektu. Dnes se neuvěřitelně rychle, a navíc čím dál tím levněji sekvenují nejen druhy, ale i kmeny bakterií. Zdá se, že znalosti o genomové sekvenci mikrobních druhů i jejich kmenů rezistentních na antibiotika umožní hledat nová zásahová místa pro antibiotika v patogenních mikroorganismech.
Není pochyb o tom, že antibiotika byla používána nadměrně a někdy i zbytečně, což byla jedna (nikoli jediná) příčina vývoje rezistence patogenních mikroorganismů vůči antibiotikům. Spotřebu antibiotik můžeme snížit pomocí moderních kontrolních systémů a s využitím veřejné zdravotnické politiky omezující šíření infekcí. Také můžeme prodloužit životnost dostupných antimikrobiálních látek tím, že si vynutíme jejich rozumné používání a najdeme inteligentní postupy jak zvládat rezistenci. Přesto ale pro boj s rezistentními patogenními mikroorganismy potřebujeme nové látky. I nadále je třeba věnovat výzkumu a vývoji nových antiinfekčních látek mimořádnou pozornost.
Literatura
Watve M. G., Tickoo R., Jog M. M., Bhole B. D.: How many antibiotics are produced by the genus Streptomyces? Arch. Microbiol. 176, 386–390, 2001.
Spížek J.: Rezistence na antibiotika trochu jinak, Vesmír 86, 455, 2007/7.
Poznámky
1) Zatím jsou k dispozici vakcíny proti lidskému papilomaviru, proti Mycobacterium tuberculosis, Haemophilus influenzae typu B, proti Streptococcus pneumoniae, proti meningokokům A, C, Y a W-135, proti Salmonella typhi a Vibrio cholerae, proti viru horečky dengue, proti japonskému viru encefalitidy (JE) a proti viru žluté zimnice (YF), ale proti nemocničním infekcím žádné.
2) Čistá současná hodnota (ČSH, popř. NPV z angl. Net Present Value) je veličina vyjadřující hodnotu budoucích peněžních toků a (případného) současného výdaje. Používá se pro hodnocení pravděpodobné výnosnosti projektu či výrobku; výhodou tohoto kritéria je zohlednění faktoru času. Jednotlivé diskontované peněžní toky vypočítáme podle vzorce CF/(1+i)n, kde CF je peněžní tok, i úroková míra a n počet let.
3) Zatímco u léků proti revmatoidní artritidě se čisté současné hodnoty odhadují na 1150 a u antidepresiv na 720, injekční antibiotikum má hodnotu pouze 100.
4) Např. Food and Drug Administration, Státní úřad pro kontrolu léčiv.
5) HTP (High Throughput Screening).
Ke stažení
 článek ve formátu pdf [686,32 kB]
článek ve formátu pdf [686,32 kB]















