Zvláštnosti genových modifikací u kvasinek
| 12. 11. 2004Mohou mít kvasinky virózu?
 S viry se setkáváme téměř všude, dokonce i u jednobuněčných mikroorganizmů, jako jsou bakterie a sinice. Většinu virů spojuje společná vlastnost – infekčnost. Infekční jsou jak viry živočichů a rostlin, tak bakteriofágy a sinofágy. Znamená to, že virus, který se v hostiteli s jeho pomocí pomnožil, jednou líheň opustí, někdy ji dokonce zničí a hledá dalšího hostitele, do kterého vstoupí, a historie se opakuje. Genomy virů, ukryté v obalech zvaných kapsidy, mohou být představovány molekulami buď DNA, nebo RNA.
S viry se setkáváme téměř všude, dokonce i u jednobuněčných mikroorganizmů, jako jsou bakterie a sinice. Většinu virů spojuje společná vlastnost – infekčnost. Infekční jsou jak viry živočichů a rostlin, tak bakteriofágy a sinofágy. Znamená to, že virus, který se v hostiteli s jeho pomocí pomnožil, jednou líheň opustí, někdy ji dokonce zničí a hledá dalšího hostitele, do kterého vstoupí, a historie se opakuje. Genomy virů, ukryté v obalech zvaných kapsidy, mohou být představovány molekulami buď DNA, nebo RNA.
Dlouho se mluvilo o tom, že se v buňkách některých kvasinek objevují částice podobné virům, ale zjevné projevy virové infekce nikdo nepozoroval. Běžné viry, které ničí buňky a napadají buňky sousední, obvykle vytvářejí ve spojitém nárůstu citlivých buněk malé, projasněné dvorce. Proto se nejprve hledaly tyto útvary. Teprve v druhé polovině minulého století zaznamenal E. A. Bevan se spolupracovníky projasněné dvorce na „trávníku“ citlivých kvasinek druhu Saccharomyces cerevisiae, mezi něž byly zamíchány kvasinky jiných kmenů. To, že přimíchané buňky kolem sebe šířily smrt, se ovšem dalo vysvětlit několika způsoby. Z přidaných buněk se mohly uvolňovat viry nebo nějaké smrtící molekuly, například antibiotika. Při podrobném ohledání čirých dvorců s pobitými kvasinkami se ukázalo, že uprostřed sedí živá kolonie, jako by sám producent byl proti neznámému faktoru odolný. Pro viry svědčily partikule v přimíchaném kmenu, které se virům podobaly. Že by se viry uvolňovaly do okolí, aniž by hubily své původní hostitele? Anebo to byla jen náhodná souhra dvou nezávislých jevů?
Pravda byla někde uprostřed. Nešlo o produkci nízkomolekulárního antibiotika ani o virovou infekci, nýbrž o zymocin – malý protein, který zabíjel sousední buňky citlivého kmene. Produkující kmen byl vůči zymocinům odolný (Vesmír 82, 555, 2003/10; Vesmír 64, 488, 1985/9). Naděje na objev virů u kvasinek přesto nezanikla.
Brzy se podařilo prokázat, že zymocin je kódován dvouřetězcovou RNA (dsRNA), která je součástí oněch „virových“ partikulí v buňce. Přes veškeré snahy se však dodnes nepodařilo nalézt podmínky, při nichž by nějaký „kvasinkový virus“ byl infekční. Z buňky do buňky se přirozeně přenášel při dělení a při křížení. Uměle to šlo například pomocí indukované fúze protoplastů nebo vpravením vyčištěných „virových“ partikulí do protoplastů, jejichž membrána byla perforována elektrickým pulzem. Replikaci dvouřetězcové RNA v cytoplazmě zajišťovala virová RNA-polymeráza bez zprostředkující DNA, takže nešlo o retroviry, protože ty nejdříve přepíší svou RNA do DNA. Překvapením však nebyl ještě konec. „Viriony“, jejichž RNA kódovala zymocin, se v novém hostiteli neudržely. Ukázalo se, že se mohou množit jen za pomoci „blížence“, který je vždy provází. Virus-průvodce kóduje RNA-polymerázu a kapsidový protein, je samostatnější, reprodukuje se bez dalšího pomocníka, ale neprodukuje zymocin.
Následovala záplava objevů „virů“ u řady dalších kvasinek a hub. Kromě dvou zvláštních případů byla ve „virových“ partikulích vždy dvouřetězcová RNA a jejich společnou vlastností byla neinfekčnost. Dohodou byl nakonec „houbovým virům“ udělen titul virů s potupnou poznámkou – „neinfekční“. Hledá se dál, ale naděje není velká. Prostě kvasinky a houby vůbec jsou v tomto ohledu odlišné od většiny ostatních organizmů.
Sázka na plazmidy
Genoví inženýři, kteří vyvíjeli metody genových modifikací kvasinek, museli při konstrukci vektorů vsadit na plazmidy – malé kružnicovité molekuly DNA, jež se v buňkách kvasinek běžně vyskytují. Bylo možno sledovat jen jednu z cest, která byla již dříve prošlapána pro Escherichia coli. Ta virová se uzavřela, protože neinfekční viry nejsou pro vývoj vektorů zajímavé. Vznikla však ještě jedna komplikace. Žádný z plazmidů, který byl k dispozici u kvasinek, nebyl schopen dosáhnout tak velkého počtu kopií v buňce jako vybrané plazmidové vektory u E. coli, které lze díky jejich speciální regulaci počtu kopií rozmnožit – např. v přítomnosti chloramfenikolu – až na 3000 kopií v jediné buňce. Přitom se ještě brzy zastaví replikace chromozomální DNA, která je v této souvislosti nežádoucí příměsí. Aby začal nový replikační cyklus kružnicovitého chromozomu, musí se totiž nahromadit několik iniciačních proteinů, jejichž syntézu chloramfenikol brzdí. Vše potřebné k replikaci plazmidů třídy ColE1 poskytne buňka bakterie, žádný protein se nemusí pro pokračování replikace plazmidu hromadit, a navíc počet kopií plazmidu v buňce negativně reguluje protein, který se nemůže syntetizovat. Takže plazmid se replikačně doslova utrhne z řetězu a přemnoží se. Co by za jiných okolností vadilo, je v této souvislosti úžasnou pomocí genovým inženýrům. Výtěžky vektorů, odvozených od těchto plazmidů jsou obrovské a stejným způsobem lze přemnožit i rekombinantní DNA, která je od nich odvozena.Komplikace však plynou z toho, že výtěžky transformace buněk izolovanou plazmidovou DNA jsou u kvasinek o několik řádů nižší než u vybraných kmenů E. coli. Bylo co řešit.
Strategie kyvadlových vektorů
Zasnoubení výhod, které plynou z použití plazmidů bakterie Escherichia coli, s metodami genových modifikací kvasinky Saccharomyces cerevisie představuje strategie kyvadlových vektorů. Tato cesta později usnadnila úpravy i dalších, mnohem komplikovanějších eukaryotických organizmů. Je založena na jednoduchém principu.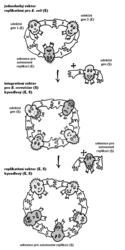 Když se může vektor jako kyvadlo přemísťovat mezi dvěma stavy, pomnožením v E. coli a S. cerevisiae, lze akce, pro které je E. coli výhodnější (např. pomnožení vektorů či rekombinantní DNA naveliko, anebo klonování), uskutečňovat v bakteriálním hostiteli, a teprve zbytek dokončovat v kvasince. Tento princip naplňují vektory plazmidového typu, které jsou vybaveny sekvencemi potřebnými pro replikaci v prvním i druhém hostiteli. Když jako kvasinkového hostitele použijeme auxotrofní kmen 1) a na vektor umístíme odpovídající gen kvasinkový, který však není poškozen, po vstupu vektoru do buňky se poškozená funkce opraví. Opravená buňka poroste a dá vznik kolonii i na médiu, kde bude chybět sloučenina nezbytná pro růst, již si auxotrofní mutant nebyl schopen syntetizovat. 2) Podobnou roli pro bakteriálního hostitele obvykle hrají geny pro rezistenci na nějaké antibiotikum. Po vstupu takového genu do bakterie může pokračovat buněčné dělení a tvorba kolonie i v přítomnosti antibiotika. Ostatní buňky zůstávají vůči antibiotiku citlivé.
Když se může vektor jako kyvadlo přemísťovat mezi dvěma stavy, pomnožením v E. coli a S. cerevisiae, lze akce, pro které je E. coli výhodnější (např. pomnožení vektorů či rekombinantní DNA naveliko, anebo klonování), uskutečňovat v bakteriálním hostiteli, a teprve zbytek dokončovat v kvasince. Tento princip naplňují vektory plazmidového typu, které jsou vybaveny sekvencemi potřebnými pro replikaci v prvním i druhém hostiteli. Když jako kvasinkového hostitele použijeme auxotrofní kmen 1) a na vektor umístíme odpovídající gen kvasinkový, který však není poškozen, po vstupu vektoru do buňky se poškozená funkce opraví. Opravená buňka poroste a dá vznik kolonii i na médiu, kde bude chybět sloučenina nezbytná pro růst, již si auxotrofní mutant nebyl schopen syntetizovat. 2) Podobnou roli pro bakteriálního hostitele obvykle hrají geny pro rezistenci na nějaké antibiotikum. Po vstupu takového genu do bakterie může pokračovat buněčné dělení a tvorba kolonie i v přítomnosti antibiotika. Ostatní buňky zůstávají vůči antibiotiku citlivé.
Co zavinila přebujelá homologní rekombinace?
Zvláštností řady kvasinkových druhů je jejich schopnost rekombinovat s vysokou frekvencí dvě molekuly DNA, které obsahují alespoň relativně krátké úseky se stejnou sekvencí nukleotidů. Protože se takové úseky označují také jako homologní, mluvíme o homologní rekombinaci. Navíc u mnoha kvasinek platí, že homologní rekombinace výrazně převažuje nad rekombinacemi nehomologními. Díky přebujelé homologní rekombinaci mohou kvasinkoví genoví inženýři používat k svým kouzlům zcela speciální druhy kyvadlových vektorů, které neobsahují žádnou sekvenci zajišťující v kvasince replikaci. Udržení těchto integrativních vektorů zajišťuje obvykle sekvence homologní s nějakým úsekem kvasinkového chromozomu. Vektor plazmidového typu, např. vektor pro E. coli, do kterého jsme vložili libovolný kvasinkový gen, se může integrovat s chromozomem, v němž je příslušný gen – homologní úsek – přítomen. Integrativní vektor se vloží do homologního místa, a potom se replikuje společně s chromozomem, jako by tam patřil odpradávna. Cokoliv vložíme do vektoru, ocitne se po rekombinaci v chromozomu společně s vektorem. Integrace s chromozomem je spontánní proces, který si kvasinková buňka zařídí téměř bez naší pomoci – na nás ovšem je, abychom do ní vpravili to, co má být (a může být) integrováno.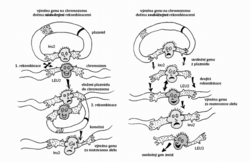 Když vektor před vpravením do buňky otevřeme v homologní oblasti, frekvence rekombinací se zvýší o několik řádů, protože tak vytvoříme rekombinogenní konce. Dokonce se ukázalo, že úsek chromozomální DNA pomnožený například pomocí polymerázové řetězové reakce (PCR) může zaměnit v chromozomu úsek homologní. Na těchto pozorováních jsou založeny unikátní metody úpravy kvasinkových genů in vivo. A nejen to. In vivo lze bez problému také libovolný gen vyřadit nebo přemístit jinam. Dokonce je možné přestavovat celé chromozomy nebo nové chromozomy přidávat. Tato nabídka vedla k tomu, že u S. cerevisiae existuje téměř kompletní soubor nulových mutantů (s úplnou delecí jednotlivých genů), který může být využit pro systematické studium nejen funkce kvasinkových genů, ale i funkce genů pocházejících z jiných organizmů včetně člověka, a to na základě jejich schopnosti opravit poškození, které zavinila delece. Techniky cílené mutageneze in vivo usnadňují navíc i studium regulačních oblastí, nekódujících oblastí a problémů spojených s polohovými efekty, které nelze analyzovat bez možnosti přemísťovat geny do jiného sousedství, anebo dokonce bez možnosti rozsáhlejší přestavby chromozomů.
Když vektor před vpravením do buňky otevřeme v homologní oblasti, frekvence rekombinací se zvýší o několik řádů, protože tak vytvoříme rekombinogenní konce. Dokonce se ukázalo, že úsek chromozomální DNA pomnožený například pomocí polymerázové řetězové reakce (PCR) může zaměnit v chromozomu úsek homologní. Na těchto pozorováních jsou založeny unikátní metody úpravy kvasinkových genů in vivo. A nejen to. In vivo lze bez problému také libovolný gen vyřadit nebo přemístit jinam. Dokonce je možné přestavovat celé chromozomy nebo nové chromozomy přidávat. Tato nabídka vedla k tomu, že u S. cerevisiae existuje téměř kompletní soubor nulových mutantů (s úplnou delecí jednotlivých genů), který může být využit pro systematické studium nejen funkce kvasinkových genů, ale i funkce genů pocházejících z jiných organizmů včetně člověka, a to na základě jejich schopnosti opravit poškození, které zavinila delece. Techniky cílené mutageneze in vivo usnadňují navíc i studium regulačních oblastí, nekódujících oblastí a problémů spojených s polohovými efekty, které nelze analyzovat bez možnosti přemísťovat geny do jiného sousedství, anebo dokonce bez možnosti rozsáhlejší přestavby chromozomů.
Na základě znalosti kompletní sekvence nukleotidů lze připravit mikromatrice reprezentativních sekvencí jednotlivých genů a na jejich základě analyzovat vliv jednotlivých cílených mutací na expresi ostatních genů zcela systematicky. Tak dostáváme alespoň u vybraných kvasinkových druhů do rukou ojedinělé nástroje, které umožňují opravdu celostní pohled na souhru mezi buněčnými pochody a úlohou jednotlivých genů a sekvencí při jejich řízení.
 Lze scénář homologní rekombinace použít i jinde? Vzpomeňme si na předpoklad přebujelé homologní rekombinace a potlačené rekombinace ostatních typů. Ten bohužel u jiných organizmů splněn nebývá. Kromě několika výjimek opravdu organizmy neumějí napodobit kvasinky v plné míře, v této oblasti mají kvasinky jedinečné „chování“. Když ale obdobné postupy použijeme u jiného organizmu, určitá naděje, že dosáhneme cíle, zůstává. Jenom frekvence výskytu očekávaného výsledku bude nesrovnatelně menší a množství nespecifických průvodních změn nesrovnatelně větší. Cesta k cíli je tudíž velmi obtížná. V poslední době však byl nalezen způsob, který umožňuje eliminovat funkce genů jinak.
Lze scénář homologní rekombinace použít i jinde? Vzpomeňme si na předpoklad přebujelé homologní rekombinace a potlačené rekombinace ostatních typů. Ten bohužel u jiných organizmů splněn nebývá. Kromě několika výjimek opravdu organizmy neumějí napodobit kvasinky v plné míře, v této oblasti mají kvasinky jedinečné „chování“. Když ale obdobné postupy použijeme u jiného organizmu, určitá naděje, že dosáhneme cíle, zůstává. Jenom frekvence výskytu očekávaného výsledku bude nesrovnatelně menší a množství nespecifických průvodních změn nesrovnatelně větší. Cesta k cíli je tudíž velmi obtížná. V poslední době však byl nalezen způsob, který umožňuje eliminovat funkce genů jinak.
Když nelze gen zlikvidovat, lze jej alespoň umlčet
Nový princip, který se využívá k umlčování genů, se nazývá RNA-interference. Ukázalo se totiž, že vnesení určité dvouřetězcové RNA do buňky má za následek degradaci mRNA, 3) která je s ní homologní. Když zničíme mRNA, nekoná se ani výroba odpovídajícího proteinového produktu. Gen je umlčen. Navenek se buňka chová stejně, jako by byl příslušný gen poškozen. Tímto objevem se otočil nejen nový list v knize genových modifikací, ale začaly se objevovat ještě další, dosud neznámé jevy. Protože při odhalování nových souvislostí opět nechyběly a nechybějí kvasinky a zmíněná problematika si zaslouží hlubší pozornost, odložíme pokračování na příště.Poznámky
O GENETICKY MODIFIKOVANÝCH ORGANIZMECH PSAL VESMÍR:
Fatima Cvrčková: O podvlékačkách a předběžné opatrnosti, Vesmír 80, 8, 2001/1
Ivan Hrdý: Geneticky modifikované organizmy – 1. Hmyzuvzdorné transgenní odrůdy – pohled entomologa, Vesmír 81, 636, 2002/11
Ivan Hrdý: Geneticky modifikované organizmy – 2. Integrovaná regulace škůdců (IPM), Vesmír 82, 23, 2003/1
Ivan Hrdý: Geneticky modifikované organizmy – 3. Vesmír 82, 146, 2003/3
Ivan Boháček: V přirozenosti člověka je hledat, zkoušet a pokoušet osud, Vesmír 79, 487, 2000/9
Ivan Hrdý: Geneticky modifikované rostliny v rukách entomologů, Vesmír 79, 487, 2000/9
Jaroslav Drobník, Miloš Ondřej: Poznámky biotechnologů ke geneticky modifikovaným organizmům, Vesmír 79, 488, 2000/9
Jaroslav Petr: Transgenová hospodářská zvířata, Vesmír 79, 514, 2000/9
Zdeněk Opatrný: Bramborové a jiné katastrofy aneb Evropou obchází strašidlo GMO, Vesmír 79, 503, 2000/9
Kvíz – Prověřte své znalosti GMO, Vesmír 79, 503, 517, 2000/9
Jaroslav Drobník, Helena Štěpánková: Kam směřují genetické modifikace? Vesmír 77, 696, 1998/12
Jaroslav Drobník, Helena Štěpánková: Evropská unie a regulace biotechnologií, Vesmír 77, 545, 1998/10
Jaroslav Drobník: Koza místo fermentoru, Vesmír 75, 276, 1996/5
Jaroslav Drobník: Orgánová farma, Vesmír 76, 256, 1997/5
Ke stažení
 článek ve formátu pdf [434,44 kB]
článek ve formátu pdf [434,44 kB]
O autorovi
Vladimír Vondrejs
















