Struktura biopolymerů
Po šanci otevřít žlutou obálku s razítkem Nobelova výboru a pozváním do Stockholmu zatoužil asi každý, kdo se vážně věnuje vědecké práci. Vyvolených, jimž se tento sen uskuteční, je ale jen málo. V roce 2002 k nim přibyl Kurt Wüthrich z Techniky v Curychu, který „za vývoj spektroskopických metod nukleární magnetické rezonance pro určení trojzměrné struktury biomakromolekul v roztoku“ obdržel loni polovinu Nobelovy cenu za chemii. (O druhou polovinu se dělí John B. Fenn a Koiči Tanaka, viz článek: Vesmír 82, 312, 2003/6.)
Nukleární magnetická rezonance
Nukleární magnetická rezonance (NMR) je spektroskopická metoda, která využívá skutečnost, že atomová jádra některých izotopů absorbují ve velmi silném magnetickém poli (až 21,2 tesla) radiofrekvenční záření o kmitočtech desítek až stovek megahertzů. Absorpce radiofrekvenční energie – jev vysoce specifický – závisí na řadě parametrů molekulárního systému. Díky tomu našla NMR spektroskopie uplatnění v mnoha oborech přírodních věd. Tato fyzikální metoda, určená původně ke studiu magnetických vlastností atomových jader, je dnes základní technikou molekulové spektroskopie pro studium struktury látek v kapalinách i v pevné fázi. Široké možnosti uplatnění nachází jak ve fyzice a chemii, tak v biologii či v materiálovém inženýrství a samozřejmě v medicíně (viz např. magnetickou rezonanční tomografii). Podstatou úspěchu nukleární magnetické rezonance jako analytické metody je skutečnost, že pozorované spektrum nezávisí jen na fyzikálních konstantách atomového jádra, ale odráží rovněž vlastnosti chemického okolí atomů v molekulách. Pro získání informací o struktuře využívá tato metoda komplikované sekvence radiofrekvenčních pulzů, řízených změn homogenity magnetického pole a složitých matematických operací pro zpracování signálů, které na nezasvěcené působí přinejmenším ezotericky, pokud je rovnou nepovažují za kouzla z dílny Davida Copperfielda.
Díky tomu našla NMR spektroskopie uplatnění v mnoha oborech přírodních věd. Tato fyzikální metoda, určená původně ke studiu magnetických vlastností atomových jader, je dnes základní technikou molekulové spektroskopie pro studium struktury látek v kapalinách i v pevné fázi. Široké možnosti uplatnění nachází jak ve fyzice a chemii, tak v biologii či v materiálovém inženýrství a samozřejmě v medicíně (viz např. magnetickou rezonanční tomografii). Podstatou úspěchu nukleární magnetické rezonance jako analytické metody je skutečnost, že pozorované spektrum nezávisí jen na fyzikálních konstantách atomového jádra, ale odráží rovněž vlastnosti chemického okolí atomů v molekulách. Pro získání informací o struktuře využívá tato metoda komplikované sekvence radiofrekvenčních pulzů, řízených změn homogenity magnetického pole a složitých matematických operací pro zpracování signálů, které na nezasvěcené působí přinejmenším ezotericky, pokud je rovnou nepovažují za kouzla z dílny Davida Copperfielda.
Velké objevy mnoho slov nepotřebují
Historie nukleární magnetické rezonance začala na konci 2. světové války. Po řadě neúspěšných pokusů se na podzim roku 1945 podařilo detegovat jev nukleární magnetické rezonance nezávisle na sobě dvěma americkým badatelům – Felixi Blochovi a Edwardu Purcellovi. O sedm let později už oba zažívali onen vzrušující pocit doprovázející otevírání zmíněné obálky. Z cesty do Stockholmu se vrátili s Nobelovou cenou za fyziku pro rok 1952. Stojí za zmínku, že sdělení z ledna 1946 v The Physical Review, kde svůj objev publikovali nezávisle na sobě, mělo v Purcellově případě rozsah asi jednu strany formátu A4, v Blochově případě jen třetinu strany téhož rozsahu. Jak ukazuje tento ne zcela výjimečný případ, velké objevy pro svůj popis mnoho slov nepotřebují.Klíčový rozvoj NMR spektroskopie nastal koncem šedesátých a počátkem sedmdesátých let minulého století v souvislosti s vývojem počítačových technologií a supravodivých materiálů. Výkonné počítače umožnily rozvoj NMR spektroskopie s Fourierovou transformací 1) a supravodivé magnety byly schopny vytvořit podstatně silnější magnetické pole než klasické, málo efektivní elektromagnety. Zvýšila se tak citlivost měření spekter nukleární magnetické rezonance, zvýšilo se i dosažitelné rozlišení. Díky metodám využívajícím dvě a více frekvenčních dimenzí 2) se podařilo odstranit překryv signálů v komplikovaných jednorozměrných spektrech.
Tyto nové metody vícerozměrné spektroskopie s Fourierovou transformací se začaly výrazně prosazovat v druhé polovině sedmdesátých let. Za příspěvek k jejich rozvoji obdržel r. 1991 Nobelovu cenu za chemii Richard R. Ernst z Techniky v Curychu.
Studium biologicky zajímavých makromolekul
Skutečnost, že Nobelova cena za chemii v roce 2002 putovala opět do Curychu, není proto ani příliš překvapující. Koncem sedmdesátých let se Richard Ernst a Kurt Wűthrich společně zasloužili o rozvoj metod dvourozměrné NMR spektroskopie a jejich první aplikace pro studium struktury proteinů. Dnes je nukleární magnetická rezonance nepostradatelným nástrojem studia stavby biologicky zajímavých makromolekul. Vedle rentgenové difrakce je druhou základní experimentální metodou strukturní biologie. Na rozdíl od krystalografie přináší NMR spektroskopie informace o struktuře proteinů, nukleových kyselin a jejich komplexů v jejich přirozeném prostředí, tedy v roztoku. Umožňuje tak studovat systémy, které buď nejsou schopny tvořit uspořádané krystaly, nebo je vytvářejí velmi neochotně. Navíc se prostorová struktura některých biomakromolekul při krystalizaci v důsledku změněných hydratačních podmínek mění. Například vlásenky nukleových kyselin, které v roztoku vykazují jednořetězcovou strukturu, dávají v krystalu přednost dvouřetězcovému uspořádání.Kromě strukturních dat poskytuje nukleární magnetická rezonance unikátní informace o vnitřní dynamice biopolymerů a umožňuje studovat pohyblivost jednotlivých strukturních domén, interakce s ligandy a další procesy na atomární i molekulární úrovni.
Základní principy využití metod nukleární magnetické rezonance pro studium struktury bílkovin formuloval Kurt Wüthrich se spolupracovníky již v letech 1981–1983, kdy popsali způsob, jak se dají signály pozorované v protonovém 3) spektru nukleární magnetické rezonance přiřadit individuálním vodíkovým atomům v jednotlivých aminokyselinách podél peptidického řetězce. Metoda, kterou navrhli, kombinuje výsledky měření dvourozměrných spekter. Ze znalosti přiřazení jednotlivých signálů, z měření vzdáleností mezi atomy novými spektroskopickými metodami (viz rámeček) a z vyhodnocení torzních úhlů je možné rekonstruovat trojrozměrný obraz studovaného proteinu. V současnosti se pro výpočet prostorové struktury biomakromolekul z dat nukleární magnetické rezonance využívají především metody molekulové dynamiky. Dosažitelné rozlišení je srovnatelné s rozlišením získaným pomocí rentgenové difrakce a pohybuje se v rozmezí 0,03–0,15 nm. Kurt Wüthrich a jeho spolupracovníci publikovali nejen první NMR strukturu proteinu s vysokým rozlišením, ale v polovině osmdesátých let si připsali i řadu dalších prvenství.
Struktura hovězích a liských prionů
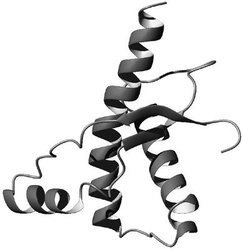 Počátkem devadesátých let se možnosti NMR spektroskopie výrazně rozšířily díky metodám izotopického značení. 4) Přiřazení signálů a strukturní studie systémů s molekulovou hmotností řádu 104–105 umožnily nové techniky NMR spektroskopie, které Kurt Wüthrich zavedl v druhé polovině devadesátých let. Příkladem praktického využití těchto metod jsou výsledky, které Kurt Wüthrich získal při studiu komplexu molekulárního chaperonu (mol. hmotnost 900 000), proteinu, jímž je v buňce doprovázeno sbalování polypeptidového řetězce a sestavování monomerů do oligomerů. Vedle vývoje nových technik a metodických postupů se K. Wüthrich věnoval i aplikacím spektroskopie, které by mohly poskytnout odpověď na zásadní otázky moderní molekulární biologie. Od roku 1994 studuje priony (obr. 1), proteiny odpovědné za vznik spongiformní encefalopatie, všeobecně známé jako nemoc šílených krav (viz Vesmír 75, 503, 1996/9). Strukturní analýzou s využitím NMR spektroskopie ukázal, že nezhoubná buněčná forma této bílkoviny je tvořena z poloviny uspořádanou strukturou několika alfa-šroubovic, zatímco druhá část tvoří velmi pružné a neuspořádané klubko. Výsledky jeho studií potvrdily, že struktura hovězího i lidského prionového proteinu jsou si velmi podobné. Takových příkladů je možné ve Wüthrichově bibliografii najít řadu.
Počátkem devadesátých let se možnosti NMR spektroskopie výrazně rozšířily díky metodám izotopického značení. 4) Přiřazení signálů a strukturní studie systémů s molekulovou hmotností řádu 104–105 umožnily nové techniky NMR spektroskopie, které Kurt Wüthrich zavedl v druhé polovině devadesátých let. Příkladem praktického využití těchto metod jsou výsledky, které Kurt Wüthrich získal při studiu komplexu molekulárního chaperonu (mol. hmotnost 900 000), proteinu, jímž je v buňce doprovázeno sbalování polypeptidového řetězce a sestavování monomerů do oligomerů. Vedle vývoje nových technik a metodických postupů se K. Wüthrich věnoval i aplikacím spektroskopie, které by mohly poskytnout odpověď na zásadní otázky moderní molekulární biologie. Od roku 1994 studuje priony (obr. 1), proteiny odpovědné za vznik spongiformní encefalopatie, všeobecně známé jako nemoc šílených krav (viz Vesmír 75, 503, 1996/9). Strukturní analýzou s využitím NMR spektroskopie ukázal, že nezhoubná buněčná forma této bílkoviny je tvořena z poloviny uspořádanou strukturou několika alfa-šroubovic, zatímco druhá část tvoří velmi pružné a neuspořádané klubko. Výsledky jeho studií potvrdily, že struktura hovězího i lidského prionového proteinu jsou si velmi podobné. Takových příkladů je možné ve Wüthrichově bibliografii najít řadu.
Dvacet procent struktur objasnila NMR spektroskopie
Životopis K. Wüthricha uvádí, že do listopadu 2002 byl autorem nebo spoluautorem 621 publikací. Pro srovnání s nedávno uveřejněnou analýzou citační úspěšnosti českých vědců (viz Vesmír 81, 508, 2002) je možné konstatovat, že 471 prací publikovaných od r. 1978 bylo do listopadu 2002 citováno celkem 38 218krát, přičemž nejcitovanější metodická práce z roku 1983 nasbírala 2890 citací. Z mnoha osobních setkání mohu dosvědčit, že Kurt Wüthrich není jen vynikající vědec. Po řadu let se věnoval sportu. Působil jako lyžařský instruktor, byl fotbalovým brankářem, hrál dobře a vášnivě tenis. Ve společnosti dokáže být zábavným a příjemným společníkem s širokým kulturním a politickým rozhledem, o čemž se mohli přesvědčit i čeští vědci při jeho návštěvě Prahy loni v červnu, kdy se zúčastnil 16. Evropské experimentální NMR konference.Udělení Nobelovy ceny za chemii Kurtu Wüthrichovi není jen oceněním osobním. Je rovněž zadostiučiněním pro celou vědeckou komunitu, která se podílela na rozvoji nukleární magnetické rezonance a na jejím uplatnění ve strukturní biologii během posledních dvaceti let. Databáze uložených struktur (Protein Data Bank) obsahuje více než 19 000 souborů (údaj z listopadu 2002) s prostorovými souřadnicemi atomů jednotlivých proteinů, nukleových kyselin, jejich komplexů a dalších biopolymerů. Více než 20 % těchto údajů bylo získáno pomocí NMR spektroskopie. Exponenciální nárůst počtu vyřešených struktur dokumentuje, jak důležité je pochopit vztah mezi strukturou biopolymerů a jejich funkcí pro naše porozumění základním procesům, které probíhají v živé hmotě. Nukleární magnetická rezonance je dnes jedním ze dvou základních nástrojů studia struktury a dynamiky proteinů a nukleových kyselin – a na této skutečnosti má Kurt Wüthrich rozhodující podíl.
Poznámky
JAK SE ZÍSKÁVAJÍ INFORMACE O STRUKTUŘE BÍLKOVIN
- Kombinace měření ve dvou typech spekter. První typ dvourozměrných spekter nukleární magnetické rezonance (COSY) poskytuje informace o vodíkových atomech, které jsou v primární struktuře proteinu velmi blízko u sebe a jsou odděleny zpravidla jen dvěma nebo třemi meziatomovými vazbami. Druhý typ spekter (NOESY), který je založen na existenci nukleárního Overhauserova efektu (tj. na zesílení signálu), naproti tomu umožňuje identifikovat interakce mezi vodíkovými jádry do vzdálenosti 0,5 nm bez ohledu na počet chemických vazeb, jež je dělí. Tyto interakce poskytují rovněž základní informace o sekundárních strukturách biopolymerů, jako jsou alfa-šroubovice nebo skládaný list u bílkovin, popř. typ helikálního uspořádání či druh vodíkových vazeb u nukleových kyselin. Data nukleárního Overhauserova efektu dovolují kvantitativně vyhodnotit informace o vzdálenosti jednotlivých vodíkových atomů.
- Hodnoty spin-spinových interakčních konstant. Dalším důležitým parametrem pro určování struktury z dat nukleární magnetické rezonance jsou hodnoty spin-spinových interakčních konstant, které popisují vzájemné působení mezi jednotlivými atomy. Tyto interakce způsobují jemné štěpení signálů nukleární magnetické rezonance ve spektrech vysokého rozlišení. Z hodnot, které charakterizují skalární interakce mezi atomy separované třemi vazbami, je možné získat údaje o velikosti torzních úhlů (tj. úhlů popisujících rotaci kolem chemické vazby).
Ke stažení
 Článek ve formátu PDF [201,77 kB]
Článek ve formátu PDF [201,77 kB]

























