Dendritická buňka v protinádorové terapii
Terapie používané v onkologii (chirurgický zásah, chemoterapie a radioterapie) sice většinu nádorových buněk zlikvidují, ale přesto jich občas nepatrné množství zbude. Právě z těch zbylých buněk se může za nějaký čas vyvinout nová nádorová populace, kterou už lze současnými léčebnými přístupy těžko ovlivnit. S čím si neporadí léčba, s tím si výjimečně poradí imunitní systém (takové případy byly popsány např. u maligního melanomu nebo u karcinomu ledvin). Nádorové buňky totiž tvoří specifické antigeny, které se na jiných typech buněk nevyskytují. Jestliže zralé dendritické buňky předloží nádorově specifické antigeny naivním T-lymfocytům, vyvolají specifickou imunitní reakci. Ta probíhá v několika fázích: Buňky prezentující antigen rozpoznají, že jde o nádorové buňky, pohltí je, zpracují a vystaví na svém povrchu nádorové antigeny. Tím je zpřístupní nádorově specifickým T-lymfocytům, které se aktivují a začnou se množit. Do místa nádorového bujení se vydají efektorové T-lymfocyty, a ty s nádorovými buňkami „zatočí“.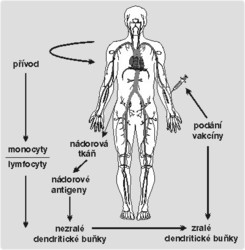
V každé fázi popsané imunitní reakce však může nádor „imunitnímu dohledu“ uniknout. Často se stává, že nádorové buňky nevyvolají dost velkou imunitu, protože nejsou schopny plnit funkci buňky prezentující antigen. Nádorová buňka na svém povrchu nenese molekuly zesilující signály, takže specifický T-lymfocyt nemusí být aktivován, ale naopak může být utlumen a uveden do stavu, v němž už není schopen nádorovou buňku zdolat.
Historie buněčné protinádorové imunoterapie
Termín protinádorová imunoterapie se zprvu používal pro přenos efektorových buněk imunitního systému (ty obnovují nebo zesilují protinádorovou imunitní odpověď). Pacientovy buňky se kultivovaly in vitro za přítomnosti vysokých dávek interleukinu 2 (ten zvyšuje cytotoxicitu). Takto připravené buňky (říkejme jim „zabíječi“) vykazovaly značnou schopnost zabíjet nádorové linie. Účinné byly na myších modelech. Když byly infuze „zabíječů“ a interleukinu 2 podávány pacientům s některými typy pokročilých nádorů (např. zhoubného nádoru ledviny a maligního melanomu), mělo to povzbudivé výsledky. Vesměs jde však o studie s malým počtem nemocných. Velké klinické studie rozdíl mezi pacienty léčenými infuzemi „zabíječů“ a ostatními pacienty neprokázaly. Cytotoxický účinek „zabíječů“ navíc není závislý na přítomnosti molekul hlavního histokompatibilního systému, a nejde tedy o populaci buněk specifickou pro nádorovou tkáň.Další úsilí se zaměřilo na možnost aktivovat a namnožit pouze ty lymfocytární populace, které pronikají přímo do nádoru, a lze tedy předpokládat, že se mezi nimi vyskytují i specifické protinádorové lymfocyty. Studie in vitro ukázaly značný nárůst aktivity zaměřené proti původní nádorové tkáni. Opět však chybějí velké studie (není snadné izolovat protinádorové lymfocyty z nádorové tkáně a pomnožit je in vitro). Výsledky nebyly přesvědčivé, náklady byly vysoké, a tak se koncem osmdesátých let od tohoto způsobu léčby nádorových onemocnění upustilo.
Co je potřeba k tomu, aby se T-lymfocyty probudily
Dosud jsme mluvili o imunoterapii, která se zaměřovala na lymfocyty jako na efektorovou složku imunitního systému, tedy na obnovování či zesilování odpovědi. Pro indukci účinné imunitní reakce je ale nutná další složka: buňky prezentující antigen. Jejich nejúčinnějším představitelem jsou zralé dendritické buňky. B-lymfocyty (prekurzory buněk produkujících protilátky) jsou schopny rozpoznat antigen v jeho původní formě receptorem, který mají na svém povrchu. Naproti tomu T-lymfocyty vyžadují, aby byl antigen buňkou prezentující antigen pohlcen, rozštěpen, vystaven na jejím povrchu a navázán na molekuly hlavního histokompatibilního komplexu (MHC).Molekuly MHC jsou dvojí: jedny stimulují cytotoxické T-lymfocyty vystavující na svém povrchu molekuly CD8, druhé nabízejí antigen pomocným Thlymfocytům, pro něž je typická přítomnost molekuly CD4. Zatímco molekuly CD8 jsou na všech buňkách, přítomnost CD4 je omezena pouze na buňky prezentující antigen. Kontakt molekuly MHC prezentující antigen s receptorem pro antigen na povrchu T-lymfocytů ovšem k vyvolání imunitní odpovědi nestačí, je to jen první signál. K tomu, aby byly naivní T-lymfocyty aktivovány, jsou na povrchu buňky potřeba ještě molekuly kostimulační a adhezivní.
Jejich hlavními zástupci jsou molekuly CD80 a CD86, které se vážou na molekuly CD28 přítomné na povrchu T-lymfocytu. Propojení těchto molekul s jejich vazebnými partnery na povrchu naivních T-lymfocytů dodá druhý signál, který umožní vývoj efektorových T-lymfocytů. Ty už jsou schopny rozpoznávat a specificky ničit struktury obsahující původní antigen (tedy nádorové nebo virem infikované buňky).
Jsou to právě zralé dendritické buňky, které mohou zajistit, že ve většině případů bude antigen účinně předložen specifickým naivním T-lymfocytům – a ty se mohou namnožit, zúčastnit se obranné reakce a vytvořit paměťové buňky. (Na rozdíl od efektorových buněk paměťové buňky nezahynou, ale zůstanou v těle pro případ, že by se infekce opakovala.) Proto se uvažuje o tom, že se dendritické buňky – jako nejúčinnější představitelé buněk předkládajících antigen – budou využívat v imunoterapii nádorových onemocnění.
Dendritické buňky a nádorové antigeny
Dnes lze velké množství dendritických buněk produkovat z monocytů. Několik dní se kultivují. Tak se získá množství typických nezralých dendritických buněk, s nimiž je možno dále pracovat. Jestliže byly myší dendritické buňky, které in vitro pohltily nádorové antigeny, vpraveny zpět do organizmu, vyvolaly ústup nádoru. Myši, které obdržely tuto infuzi, byly chráněny proti původní nádorové linii. Brzy po objevu byly zahájeny klinické studie. Ve většině případů byly z krve pacientů izolovány monocyty, z nichž potom byly in vitro připraveny dendritické buňky. Těm byly nabídnuty nádorové antigeny. Dendritické buňky pochopitelně antigen zpracovaly, a pak ho vystavily na svém povrchu spolu s molekulami MHC a kostimulačními molekulami. Když byly nádorové antigeny zpracovány, mohly být dendritické buňky vráceny do těla pacientů. Byly již publikovány předběžné výsledky několika studií provedených především u pacientů s maligním melanomem, karcinomem ledvin, prostaty a s některými typy lymfomů, většinou v pokročilém stadiu onemocnění. Téměř ve všech případech bylo prokázáno, že se specifické T-lymfocyty proti nádorovým antigenům aktivují in vitro (zaznamenány byly i případy naprostého vymizení nádorových ložisek). Zatím ale klinických dat není dost na to, aby bylo možno s určitostí říci, zda jsou naděje vkládané do dendritických buněk oprávněné. Problém je, že existuje množství proměnných, které by mohly vznik protinádorové odpovědi ovlivnit. Navíc studie byly zahájeny v době, kdy ještě nebyla známa všechna fakta o funkci jednotlivých stadií dendritických buněk v organizmu.Kontrola dalšího růstu nádoru
Desítky laboratoří se nyní zabývají výzkumem, jehož cílem je zjistit, jaká forma nádorových buněk je pro zpracování a vystavení antigenu dendritických buněk nejvhodnější a jakým způsobem by se měly nádorové tkáně zpracovat, aby byla připravená směs nádorových antigenů co nejúčinnější. Do praxe je třeba zavést obecně použitelný terapeutický protokol (obr. 1). Je nutno zaměřit se na pacienty, jimž byla značná část nádorové masy odstraněna chirurgicky nebo chemoterapií (do studií byli dosud zahrnováni pacienti s rozvinutým onemocněním). Naděje pramení z úspěšných pokusů in vitro a z úspěšných studií na myších modelech. Neznamená to, že tato terapie musí být stejně účinná v léčbě lidských onemocnění. 1)Poznámky
Citát
Ernest Gellner: Rozum a kultura
(Historická úloha racionality a racionalismu) CDK, Brno 1999, s. 130
Sociolog, který je víc než kterýkoli jiný spojován s pokusem zmapovat a pochopit tu plíživou a všepronikající racionalitu, je Max Weber. […] Weber plně pochopil jedinečnost a odlišnost civilizace proniknuté racionalitou, i způsob, jakým se oddělila od zásad, které normálně ovládají agrární společnosti. Viděl její vznik jako tajemství, které si žádá vysvětlení. Na rozdíl od providencialistických hegelo-marxistů, kteří vznik našeho specifického světa se všemi jeho kvalitami viděli jako očividný osud všeho lidstva, jako inherentní pokračování a vyvrcholení dlouhého a celosvětového vývoje, který dříve nebo později musel nastat, ať by se stalo cokoliv, Weber ho viděl jako nahodilou, náhodně šťastnou událost v životě jedné určité náboženské tradice, která byla její nutnou (i když ne postačující) podmínkou. Durkheim viděl komunalistický rituál jako původce všelidské racionality pojmového myšlení; Weber viděl puritánské, monoteistické, nomokratické náboženství jako původce spořádané, souměrné racionality, která jedině umožňuje moderní ekonomiku a vědu.
OTÁZKY, NA KTERÉ SE TEPRVE HLEDÁ ODPOVĚĎ
- Jaké množství dendritických buněk, v jakých časových intervalech a po jak dlouhý čas by mělo být pacientům injikováno? Jaká množství dendritických buněk bude nutno opatřit? Ze 100 ml periferní krve je možno připravit maximálně 10 milionů nezralých dendritických buněk. Pro přípravu většího množství dendritických buněk bude asi nejvhodnější odebrat velké množství monocytů přístrojem, který umožňuje koncentraci monocytů a lymfocytů z krve, potom připravit dendritické buňky a zmrazit je, aby se mohly využít později.
- Jakou formu by měly mít nádorové antigeny, které budou dendritickým buňkám nabídnuty k zpracování?
- U nádorů, kde jsou známy nádorové antigeny, je možno použít přímo tyto bílkoviny ve formě více či méně rozsáhlých fragmentů, popř. sekvenci ribonukleové kyseliny, která je kóduje. Také je možné vložit tuto sekvenci do různých virů, a těmi pak dendritické buňky infikovat.
- Ve většině případů je nádorový antigen neznámý. U těchto nádorů připadá v úvahu stimulace dendritických buněk nekrotickými či apoptotickými nádorovými buňkami.
- Jaká forma dendritických buněk má být injikována pacientům? Ve většině klinických studií, které dosud proběhly, byly použity dendritické buňky nezralé. Z pokusů in vitro i in vivo je ale zřejmé, že schopnost aktivovat naivní T-lymfocyty mají pouze dendritické buňky zralé. Bude tedy nezbytné přimět dendritické buňky k dozrání in vitro (pomocí některého z prokázaných maturačních agens).
- Jakou cestou by stimulované dendritické buňky měly být vpraveny zpět do organizmu, aby byla zaručena jejich migrace do lymfatických uzlin a účinná stimulace Tlymfocytů? Injekce přímo do lymfatické uzliny se jeví jako technicky obtížnější řešení. Pokusy, při kterých se studovalo, jaký vliv má způsob podání, jasně dávají přednost podkožní injekci před injekcí do krevního oběhu.
Ke stažení
 Článek ve formátu PDF [101,16 kB]
Článek ve formátu PDF [101,16 kB]

























