Kolik mutací je potřeba k evoluci?
V každé buňce každého organizmu existuje soubor genů, který musí být před rozdělením buňky opsán. Ze vzniklých dvou kopií obdrží každá buňka jednu. Když se chce buňka znovu rozdělit, vytvoří znovu kopii tohoto souboru. Každá nově vzniklá buňka dostane jednu. A když se chce buňka znovu rozdělit… a tak dále, bratru 3,8 miliardy let. Všechny organizmy na světě, všechny buňky, všechny viry. Dnes a denně stamiliardy opisů.
Fyzicky je soubor genů tvořen molekulami kyseliny deoxyribonukleové – DNA – a onu kopírovací práci vytváří DNA-polymeráza (obrázek). Tato bílkovina je schopna, v kooperaci s řadou dalších faktorů, vytvořit na základě vzoru jedné molekuly DNA-molekulu novou. Vytváří ji z deoxynukleotidů, které jsou cihlami DNA. Kopie by měla být co nejvěrnější, pokud možno nerozeznatelná od originálu, pokud možno bez chyb (mutací). DNA-polymeráza vytváří novou kopii téměř bez chyb. Buďme vděčni za ono téměř – díky chybám během kopírování mohou vznikat různé verze téhož genu, které vedou k různým verzím téže bílkoviny. Tyto různé verze můžou být různě vhodné. Některé vedou ke vzniku proteinů horších či vysloveně špatných, jiné ke vzniku proteinů lepších a ještě jiné ke vzniku proteinů (téměř) nových. Přirozeným výběrem je v průběhu evoluce vybírána nejvhodnější verze. Kombinací nových vhodných verzí mohou vznikat nové druhy. Díky občasným chybám polymerázy není svět obydlen početnou populací absolutně identických prabakterií.
Chyb ale nesmí být moc. Kdyby v tomto článku mělo každé druhé slovo chybu, jistě byste jej už dávno odložili. Chyby totiž obvykle vedou k negativnímu výsledku – překlepem většinou vznikne absolutní nesmysl, málokdy slovo s jiným významem či slovo vhodnější. Kdyby nově vzniklé buňky měly každý druhý gen pozměněný, nejspíš by se už dalšího kola kopírování nedočkaly. Chyb by prostě mělo být tak akorát – aby evoluce probíhala, ale pomalu, opatrně a bez častých fatálních slepých uliček.
Polymerázy vytvářejí chyby s neochvějnou přesností a zarážející logikou (tabulka). Virové polymerázy chybují velmi často – skoro každý stý nukleotid je zařazen chybně. Nevadí, virů je produkováno obrovské množství. To, že některé z nich nefungují, je bohatě vyváženo mnohonásobně vyšší úspěšností jiných. V důsledku chybující virové polymerázy máme každý rok novou verzi chřipky. Tento virus, který v každém kole kopírování udělá nejméně jednu chybu, je jedním z nejrozšířenějších na světě a vyhynutí mu rozhodně nehrozí.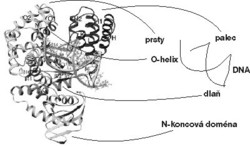
Bakteriální DNA-polymerázy chybují méně, navíc se v jejich buňkách objevují nové opravné systémy snižující frekvenci chyb. Bakterie jsou už pořádně složité, takže je lepší nic moc neměnit, ale na druhou stranu žijí ve velmi proměnlivém prostředí, a tak je dobré být na všechno připraven. Frekvenci jedna chyba na 105–106 nukleotidů si mohou dovolit, když zahyne jedna bakterie, populaci se nic nestane.
Jednobuněčné eukaryotické organizmy jsou na tom podobně jako bakterie, jenom jsou ještě o trošku složitější. Běžná frekvence chyb je asi 10–6–10–7. Jak je tomu u mnohobuněčných eukaryot, to žádný pořádně neví. Jednak se to špatně měří (situaci značně komplikuje sex), jednak se zdá, že to je v různých oblastech genomu různé. Podle těchto výsledků to vypadá, jako by DNA-polymerázy nějak „věděly“, kolik chyb mají dělat, jako by množství chyb, které dělají, bylo optimální a adaptivní.
Nejčastější a nejdůležitější kopírovací polymerázy jsou polymerázy z rodiny I. Tato rodina je mimořádně konzervativní. Trojrozměrná struktura jejích členů je téměř shodná u organizmů, které jsou odděleny miliony let evoluce, a také aminokyselinové složení je nápadně podobné. Zejména dvě oblasti jsou již miliony let nezměněny – část bílkoviny označovaná jako doména A, která se nachází v oblasti „dlaně“, a oblast označovaná jako O-helix (obrázek). Tyto oblasti jsou velmi pravděpodobně odpovědné za hlavní část kopírovacích prací, a zejména za kontakt nových nukleotidů s původní předlohou. Proč jsou tyto části polymerázy I shodné u všech organizmů? Je to proto, že jsou pro kopírovací funkci absolutně nezbytné? Nebo proto, že rozhodujícím způsobem určují frekvenci chyb polymerázy?
Lawrence Loeb a jeho spolupracovníci se rozhodli tuto otázku zodpovědět (viz text v rámečku vpravo). Vybrali si dva nejkonzervovanější úseky DNA-polymerázy I a pozměnili je in vitro. Ziskem bylo více než 8000 nových funkčních verzí polymeráz. Zhruba 300 polymeráz vybraných pro analýzu fungovalo natolik dobře, že s nimi bakterie jako s jediným kopírovacím enzymem mohly žít bez potíží 50 generací (dál už se to neměřilo). Nové verze se samozřejmě značně lišily. Některé byly rychlejší, jiné přesnější, další měly odlišná optima pro syntézu nové DNA. Jedno je však naprosto jisté – tyto dva absolutně konzervované úseky nejsou konzervovány proto, že by bez nich polymeráza nefungovala. Jsou tedy skutečně zapotřebí k tomu, aby udržovaly vhodnou frekvenci mutací? Pokud ano, pak je rozlišení mezi „vhodnými“ polymerázami neuvěřitelně jemné. Současnými biochemickými metodami in vitro bylo 70 % nových polymeráz neodlišitelných od té původní. Přesto v přírodě najdete pouze tu originální verzi.
Opravné systémy a mutátoři
Pokud všechny bakterie a všechny buňky eukaryotických organizmů sdílejí shodné O-helixy a A-domény, jak to, že se vůbec frekvence mutací u jednotlivých organizmů liší? Hlavní slovo mají v tomto případě již výše zmíněné opravné systémy. V evoluci se objevily později a čím složitější je organizmus, tím složitější jsou opravné systémy, které jsou v jeho buňkách využívány. Bakteriální populace sebraná v přírodě („přírodou“ jsou v tomto případě většinou myšleni pacienti v nemocnicích) je zpravidla velmi variabilní. Jednotlivé buňky se liší samozřejmě i frekvencí mutací. Změna ve frekvenci mutací však nikdy není způsobena změnou v DNA-polymeráze. Vždy je příčinou mutace v některém z opravných systémů.Bakterie, které mají některý z opravných systémů poškozený, se nazývají mutátoři a tvoří až 1 % přírodní populace. Pomocí počítačové simulace i experimentů in vitro bylo prokázáno, že určitý podíl těchto mutátorů dokáže výrazně zrychlit schopnost celé populace přizpůsobit se vnějším podmínkám. V laboratoři se dá za konstatních podmínek pěstovat i 20 000 generací bakterií. Pokud jsou kultivovány při konstatním stresu způsobeném například nedostatkem nějaké živiny, může se podíl mutátorů v celé populaci zvýšit až na 10 %. Nikdy však mutátoři nezískají většinu, natož aby tvořili celou populaci. Pokud se provádějí odběry v průběhu celého dlouhodobého experimentu a měří se podíl mutátorů, zjistí se, že neustále osciluje v rámci až tří řádů s maximem kolem 1–10 % (obvykle od 0,001 do 1 %). Vysvětlením tohoto jevu je fakt, že mutátoři mohou získat jak výhodné, tak nevýhodné mutace. Pokud získají výhodnou mutaci, jejich počet stoupá, pokud nevýhodnou, nemají šanci. Ani mutátoři s výhodnou mutací nemají vyhráno – může se jim stát, že k oné výhodné mutaci získají kvůli své vysoké frekvenci mutací ještě další mutaci, tentokrát nevýhodnou – a všechny úspěchy jsou pryč. Může se ale stát, že si k oné výhodné mutaci pořídí další mutaci, která z nich udělá opět nemutátora (protože i schopnost tvořit mutátory je způsobena jenom mutací v nějakém genu opravných systémů). To je ta nejvýhodnější kombinace – situace se trochu uklidní, frekvence mutací se sníží, a tím se zmenší pravděpodobnost získání nevýhodné mutace, ale buňka má od svých předků-mutátorů onu výhodnou vlastnost, která jí zajišťuje vysokou úspěšnost (obrázek). Proto ty vlny mutátorů a nemutátorů, a proto to nakonec nemutátoři vyhrají. V zásadě je to jako s lidmi – Johanka z Arku byla dobrá, ale v určitém období bylo nutno ji upálit.
Tohle všechno zřejmě platí jenom pro populace jednobuněčných organizmů. U mnohobuněčných je to jinak. Tam se musí pracovat pro celek, který často pokládá za výhodné něco jiného než jednotlivá buňka. A tak je hlavním projevem existence mutátorů u lidí rakovina. Aspoň tak se nám to zatím jeví.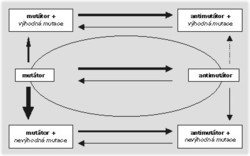
Dvojí způsob regulování frekvence mutací
Jak je to tedy s mutacemi a s evolucí? Ačkoliv jsou v populaci bakterií mutátoři, nikdy není tato vlastnost způsobena změnou v aktivitě DNA-polymerázy, přestože alely způsobující větší frekvenci chyb mohou vzniknout a fungovat. Mutátorový fenotyp je způsoben vždy fungováním či nefungováním některého z opravných systémů – v drtivé většině je to systém oprav chybného párování. Přestože jsou různé verze DNA-polymerázy podobně (pro nás neodlišitelně) funkční, je v přírodě téměř absolutně preferována jenom jedna verze. Zdá se tedy, že existují dvě úrovně regulování frekvence mutace. Jedna velmi jemná a mimořádně důležitá, která byla vyladěna kdysi dávno a od té doby je dodržována. Ta se odráží v mimořádné konzervativnosti důležitých domén DNA-polymerázy I a její výhody pro organizmy zatím nejsme schopni posoudit či změřit. Druhá úroveň je hrubá a lze ji snadno pozorovat. Vypínáním či zapínáním opravných systémů se z buňky stává mutátor či antimutátor, a určitý podíl mutátorů v populaci vždy vývoj popostrčí. Kolik mutací a kolik mutátorů je potřeba ke správnému tempu evoluce, to nám však bakterie zatím neřekly.Proč jsou části polymerázy I shodné u všech organizmů?
DNA-polymeráza I bakterie Thermus aquaticus patří také do rodiny I replikačních DNA-polymeráz. Úsek genu kódující doménu A byl in vitro pozměněn. Jednotlivé změněné verze genu polymerázy I (alely) byly vneseny do bakterií, kde byla testována jejich funkčnost. Po umělé mutagenezi domény A (13 aminokyselin) bylo získáno 8000 nových DNA-polymeráz, blíže analyzováno jich bylo 245. Nové polymerázy měly v oblasti domény A až 6 změněných aminokyselin. 95 % takto vzniklých nových polymeráz bylo funkčních a umožnily růst bakterií po 50 zkoumaných generací. Samozřejmě se od sebe lišily aktivitou (některé byly až dvakrát rychlejší než původní polymeráza), přesností (některé byly podstatně přesnější, jiné dělaly mnohem více chyb během syntézy nové molekuly DNA) a teplotním optimem. Naprostá většina nových verzí polymeráz byla svou aktivitou velmi podobná polymeráze původní.
Podobný experiment byl proveden také s oblastí kódující O-helix. Tato část polymerázy je nejspíš odpovědná za vazbu nového nukleotidu a jeho konktakt s kopírovanou molekulou DNA. O-helix je v přírodě mimořádně konzervativní, nicméně mutageneze provedená v laboratoři dovolila vytvořit 75 nových funkčních verzí DNApolymerázy I, které se liší právě v O-helixu. Nové bílkoviny měly maximálně 6 aminokyselinových změn a některé se značně lišily od původní polymerázy. Byly nalezeny dvě nové verze, které během syntézy DNA chybovaly třikrát méně než původní polymeráza. První přesnější polymeráza měla změněny tři aminokyseliny a větší přesnosti oproti původnímu typu dosahovala tím, že vůbec neprodukovala jeden typ chyb (transverzi). Druhá polymeráza s větší přesností měla pouze jednu aminokyselinovou změnu a větší přesnosti dosahovala úměrným snížením všech typů chyb, které mohou polymerázy vytvořit. Byly také nalezeny polymerázy s menší přesností (některé chybovaly až čtrnáctkrát více než původní typ). Většina nově vzniklých polymeráz však měla vlastnosti zhruba shodné s původním typem.
Těmito experimenty bylo tedy prokázáno, že jak O-helix, tak doména A mohou být i velmi zásadně pozměněny, aniž by to ovlivnilo funkčnost polymerázy. Přesto jsou obě tyto oblasti mimořádně konzervativní. Ve 147 vzorcích bakterie Escherichia coli odebraných na nejrůznějších místech celého světa nebyla nalezena ani jediná aminokyselinová změna v rámci O-helixu a A-domény DNA-polymerázy. Všechny tyto experimenty byly provedeny v laboratořích Lawrence Loeba v Seattlu.
Ke stažení
 Článek ve formátu PDF [155,7 kB]
Článek ve formátu PDF [155,7 kB]















