Umelá evolúcia proteínov
Proteíny (bielkoviny) sú obrovské molekuly, ktoré v živých organizmoch plnia najrozličnejšie funkcie. Transportujú kyslík krvou, umožňujú pohyby svalov, zúčastňujú sa na replikácii DNA... Vedci si už dlho kladú otázku, či by bolo možné proteíny využiť aj pre iné úlohy, ktoré sú síce z hľadiska fungovania živých organizmov nepotrebné, ale pre ľudské ciele by mohli byť užitočné. Umelé proteíny by mohli nájsť uplatnenie napríklad v chemickom priemysle ako katalyzátory chemických reakcií, pri likvidovaní nebezpečných odpadov alebo v medicíne...
Pri pohľade na neuveriteľnú variabilitu proteínov a na množstvo funkcií, ktoré v živých systémoch zastávajú, si môžeme byť takmer istí, že by mohli vykonávať aj mnohé z nami žiadaných nových úloh. Vedci sú dnes schopní vyrobiť ľubovoľný nový proteín, nedokážu však určiť, ako bude fungovať. Inými slovami, vzťah medzi chemickým zložením proteínu (či už prirodzeného, alebo umelého), jeho priestorovou štruktúrov a jeho funkciou je neznámy. Keďže množstvo potenciálne vyrobiteľných proteínov je obrovské, skúšať vyrobiť nejaký náhodou a potom testovať, či snáď nemá požadované vlastnosti, je nemožné.
Úsilie o výrobu umelých bielkovín by mohlo pri tomto konštatovaní skončiť, avšak predsa existuje spôsob, ako nájsť vhodný proteín pre požadovanú funkciu, je ním evolúcia. Na prvý pohľad by sa zdalo, že to je príliš pomalý proces trvajúci milióny rokov. My sme však svedkami toho, že sa u mikroorganizmov vyvinuli proteíny rozkladajúce chemikálie, ktoré ľudia začali produkovať len pred niekoľkými desaťročiami, a rezistencia proti antibiotikám sa u baktérií vyvíja ešte rýchlejším tempom. Vedci, ktorí túžia vyrobiť nový proteín v časovom horizonte niekoľkých týždňov či mesiacov, v najhoršom prípade počas trvania postgraduálneho štúdia, teda majú dôvod k miernemu optimizmu.
Laboratórna evolúcia
Jeden z prvých experimentov zameraných na umelú evolúciu uskutočnili v Kalifornskom technologickom inštitúte. Tamojší vedci vyšli z proteázy nazývanej subtilizín E (proteáza je enzým štiepiaci proteíny) a snažili sa dosiahnuť jej väčšiu odolnosť voči organickému rozpúšťadlu dimetylformamidu (DMF). Najprv vzali DNA kódujúcu subtilizín E a vytvorili z nej mnohé kópie pomocou polymerázovej reťazovej reakcie (pozri článok Z. Storchovej, Vesmír 77, 444, 1998/8). Neboli to však úplne verné kópie, snažili sa, aby v každej novovzniknutej molekule DNA bola nejaká mutácia. Potom takto vyrobené molekuly DNA vložili do baktérií, ktoré (ako každá živá bunka) obsahujú aparát schopný z molekúl DNA vyrábať bielkoviny. Takto získali druhú generáciu proteínu subtilizín E, mierne odlišnú od pôvodného prírodného proteínu. Po otestovaní odolnosti nových proteínov voči DMF vybrali tie najodolnejšie a zopakovali s nimi celý proces, aby získali tretiu, ešte odolnejšiu generáciu (obrázek). Po púhych štyroch generáciách laboratórnej evolúcie získali proteín, ktorý bol v 60 % DMF taký účinný, ako pôvodný proteín vo vodnom roztoku. Hoci cieľom tohoto experimentu bolo hlavne zodpovedať akademickú otázku, či je vôbec možné získať umelou evolúciou bielkovinu požadovaných vlastností, odolnosť enzýmu voči organickým rozpúšťadlám by mohla byť v budúcnosti žiadaná vlastnosť, napríklad ak by bolo potrebné, aby enzým katalyzoval reakciu látok nerozpustných vo vode.V opísanom postupe umelej evolúcie sa enzým zdokonaľoval vďaka postupnému hromadeniu jednotlivých mutácií. Umelá evolúcia by však bola účinnejšia, ak by sme v jednom dcérskom proteíne dokázali skombinovať výhodné mutácie z niekoľkých proteínov predošlej (rodičovskej) generácie – ak by sme evolúciu obohatili o sexualitu. Vo svojich ďalších experimentoch sa vedci sústredili práve na tento problém a do laboratórnej evolúcie zahrnuli genetickú rekombináciu.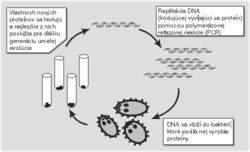
Genetická rekombinácia
Pri genetickej rekombinácii sa vychádza z niekoľkých proteínov, ktoré sú navzájom homologické, to znamená, že majú veľmi podobnú funkciu aj štruktúru, ale súčasne sú medzi nimi rozdiely, jeden napríklad môže byť odolnejší voči vysokej teplote, zatiaľ čo iný má vyššiu aktivitu... Molekuly DNA, ktoré kódujú tieto proteíny, sú teda navzájom tiež veľmi podobné, odlišujú sa len niekoľkými mutáciami.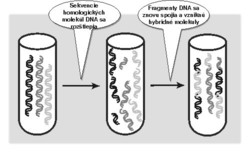
Homologické molekuly DNA sa najprv na niekoľkých miestach rozštiepia pomocou nukleáz (enzýmov štiepiacich DNA). Takto vzniknuté fragmenty sa potom nechajú znova pospájať, pričom nové molekuly vytvoria často fragmenty pochádzajúce z rôznych predkov – vzniknú hybridné molekuly DNA (obrázek). S týmito hybridnými molekulami DNA sa ďalej pracuje rovnako ako v predošlom pokuse: vložia sa do baktérií, tie z nich vyrobia bielkoviny, ktorých vlastnosti sa následne testujú.
Umelá evolúcia obohatená o genetickú rekombináciu prináša oproti umelej evolúcii založenej na postupnom hromadení jednotlivých mutácií dve základné výhody: Umožňuje rýchlo skombinovať niekoľko výhodných mutácií, a umožňuje zbaviť sa škodlivých mutácií, ktoré sa môžu objaviť súčasne s mutáciami užitočnými.
Využitie
Evolúcia proteínov v laboratórnych podmienkach sľubuje mnohé komerčné aplikácie. Nové proteíny by mohli slúžiť všade tam, kde je potrebné katalyzovať chemické reakcie, napríklad v chemickom priemysle alebo pri rozkladaní nebezpečných chemikálií v životnom prostredí. Tepelne odolné enzýmy, ktoré rozkladajú organické látky, nájdu uplatnenie ako súčasť pracích práškov a rôznych saponátov.Ukazuje sa však, že umelá evolúcia proteínov môže priniesť pokrok aj pri riešení otvorených akademických problémov, akým je napríklad otázka vzťahu medzi štruktúrou a funkciou bielkovín. Pokiaľ sa vedci pokúšali pristupovať k tomuto problému študujúc bielkoviny existujúce v prírode, mohli porovnávať len niekoľko málo proteínov s podobnou funkciou. Metóda umelej evolúcie umožňuje rýchlo preveriť vplyv veľkého množstva mutácií na funkciu bielkoviny, ako aj rozlíšiť mutácie užitočné od mutácií škodlivých a neutrálnych, ktoré nemajú na funkciu proteínu vplyv.
Aj v prípade už spomínaných proteínov odolných proti organickému rozpúšťadlu DMF boli vedci zvedaví na to, na ktorých miestach v molekule proteínu sa objavili užitočné mutácie, a ich zistenia boli v mnohom prekvapivé. Ukázalo sa, že mutácie zvyšujúce odolnosť enzýmu sa neobjavili v mieste enzýmu, na ktoré sa viaže substrát (v katalytickom mieste), ale najmä na povrchu proteínu, v oblastiach obklopujúcich katalytické miesto enzýmu. V týchto oblastiach neboli užitočné mutácie očakávané a zostávajú ťažko vysvetliteľné.
Je zrejmé, že evolúcia je veľmi účinný spôsob ako navrhovať nové proteíny, a že i vo svojej laboratórnej podobe nachádza a nájde široké uplatnenie. Na druhej strane sú vedci skeptickí voči schopnosti umelej evolúcie vyvíjať proteíny s úplne novými vlastnosťami, veľmi vzdialenými vlastnostiam existujúcich prírodných proteínov. Najnáročnejším krokom umelej evolúcie je totiž kontrolovanie, ktoré z nových mutácií sú užitočné. Pokiaľ by bolo potrebných príliš mnoho mutácií, aby sa získal z proteínu východiskového proteín vylepšený, bolo by nutné prekontrolovať vlastnosti obrovského množstva proteínov, a to presahuje súčasné technické možnosti. Takže hoci prvý dôležitý krok na ceste k umelým proteínom vedci urobili, sú si vedomí dlhej cesty, ktorá sa pred nimi nachádza.
Ke stažení
 Článek ve formátu PDF [122,4 kB]
Článek ve formátu PDF [122,4 kB]















