Soľno-vodný oscilátor
| 5. 3. 1995Nelineárna dynamika vzbudila záujem vedcov z rôznych disciplín. Študuje sústavy dostatočne vzdialené od termodynamickej rovnováhy, v ktorých prebiehajú deje opísané nelineárnymi vzťahmi,  a správanie systému sa môže kvalitatívne zmeniť a spontánne vytvárať časové a priestorové štruktúry, tzv. disipatívne. Príkladom nelineárnej dynamiky v chemických systémoch je Belousova-Žabotinského reakcia. (Jedná sa o oxidáciu kyseliny malónovej bromičnanovými iónmi. Reakcia prebieha vo vodnom roztoku kyseliny sírovej a je katalyzovaná ceritnými iónmi.) Pri tejto reakcii možno pozorovať ako sa roztok v pravidelných intervaloch sfarbuje do žlta a znova odfarbuje, čo je spôsobené periodickými osciláciami koncentrácie katalyzátora. Za iných podmienok možno pozorovať neperiodické "chaotické" oscilácie, alebo vzniká priestorová periodická štruktúra, napr. v podobe tzv. chemických vĺn v tenkej vrstve roztoku Belousova-Žabotinského sústavy (viď články Ľ. Treindla o disipatívnych štruktúrach a oscilačných reakciách, Vesmír 59, 355, 1980/6 a Vesmír 66, 265, 1987/5).
a správanie systému sa môže kvalitatívne zmeniť a spontánne vytvárať časové a priestorové štruktúry, tzv. disipatívne. Príkladom nelineárnej dynamiky v chemických systémoch je Belousova-Žabotinského reakcia. (Jedná sa o oxidáciu kyseliny malónovej bromičnanovými iónmi. Reakcia prebieha vo vodnom roztoku kyseliny sírovej a je katalyzovaná ceritnými iónmi.) Pri tejto reakcii možno pozorovať ako sa roztok v pravidelných intervaloch sfarbuje do žlta a znova odfarbuje, čo je spôsobené periodickými osciláciami koncentrácie katalyzátora. Za iných podmienok možno pozorovať neperiodické "chaotické" oscilácie, alebo vzniká priestorová periodická štruktúra, napr. v podobe tzv. chemických vĺn v tenkej vrstve roztoku Belousova-Žabotinského sústavy (viď články Ľ. Treindla o disipatívnych štruktúrach a oscilačných reakciách, Vesmír 59, 355, 1980/6 a Vesmír 66, 265, 1987/5).
Veľmi jednoduchým príkladom nelineárneho dynamického systému je soľno-vodný oscilátor, ktorý v roku 1970 objavil geofyzik S. Martin. 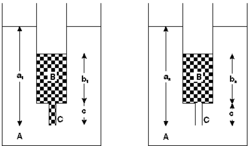 Z injekčnej striekačky odstránil piest, naplnil ju slanou vodou a čiastočne ponoril do väčšej nádoby s čistou vodou. Pozoroval zaujímavý jav - rytmické oscilácie vodného prietoku. Určitý čas prúd slanej vody vytekal z menšej nádobky (striekačky), potom sa smer toku obrátil a prúd čistej vody vtekal z väčšej nádoby do menšej. Tieto dva deje sa opakovali veľakrát za sebou. Pokus možno uskutočniť hoci aj v kuchyni, a aby oscilácie boli zreteľnejšie, možno bezfarebný slaný roztok nahradiť napr. malinovým sirupom. Obrázok obrázek ukazuje dva možné stacionárne stavy systému, ktorý pozostáva z rezervoára A naplneného vodou, malej nádobky B obsahujúcej
Z injekčnej striekačky odstránil piest, naplnil ju slanou vodou a čiastočne ponoril do väčšej nádoby s čistou vodou. Pozoroval zaujímavý jav - rytmické oscilácie vodného prietoku. Určitý čas prúd slanej vody vytekal z menšej nádobky (striekačky), potom sa smer toku obrátil a prúd čistej vody vtekal z väčšej nádoby do menšej. Tieto dva deje sa opakovali veľakrát za sebou. Pokus možno uskutočniť hoci aj v kuchyni, a aby oscilácie boli zreteľnejšie, možno bezfarebný slaný roztok nahradiť napr. malinovým sirupom. Obrázok obrázek ukazuje dva možné stacionárne stavy systému, ktorý pozostáva z rezervoára A naplneného vodou, malej nádobky B obsahujúcej
koncentrovanejší slaný roztok alebo roztok s väčšou hustotou a obmedzujúceho spojenia C medzi oboma kvapalinami. Spojenie je tvorené kapilárou alebo len malým otvorom na dne nádobky B. Rytmická zmena je pozorovaná medzi prúdením čistej vody smerujúcej hore a prúdením hustejšej kvapaliny smerujúcej dolu.
V stacionárnom stave 1 je kapilára plná slaného roztoku. V stacionárnom stave 2 je kapilára plná vody. Sústava by mohla zotrvať nekonečne dlho v jednom z týchto dvoch stacionárnych stavov, ak by v nej neboli fluktuácie a zanedbali by sme extrémne pomalú difúziu soli cez ústie kapiláry. Ak však v stacionárnom stave 1 malé množstvo kvapaliny z A vstúpi do ústia kapiláry, tlak v B a C nebude schopný udržať rovnováhu pri rovnakej hladine v A a voda z rezervoáru bude vtekať do kapiláry so zväčšujúcou sa hnacou silou. Čistá voda bude prúdiť do kapiláry až dovtedy, kým jej hladina nestúpne na úroveň zodpovedajúcu stacionárnemu stavu 2. Avšak aj stacionárny stav 2 je kvôli fluktuáciám nestabilný. Ak do kapiláry vstúpi malé množsvo slaného roztoku z nádobky B, zväčšený tlak spôsobí zrýchlenie prietoku a kapilára sa opäť naplní slaným roztokom. Prúd slaného roztoku z B bude pokračovať až do dosiahnutia stacionárneho stavu 1. Systém samozrejme nie je perpetuum mobile. Chvíľu roztok tečie z B do A, systém sa blíži k stavu l a hustota vody sa zväčšuje, potom tečie z A do B, systém sa blíži k stavu 2 a hustota slaného roztoku sa zmenšuje. Voľná energia sa znižuje monotónne bez ohľadu na smer prietoku a oscilácie skončia, keď sa hustoty roztokov v oboch nádobkách vyrovnajú. 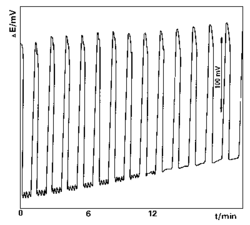
Perióda oscilácií môže byť niekoľko sekúnd alebo niekoľko minút, jej veľkosť závisí od hustoty roztoku v menšej nádobke, resp. od rozdielu hustôt oboch roztokov, od dĺžky kapiláry, jej priemeru, od viskozity roztoku atď. Perióda oscilácií je konštantná počas niekoľkých desiatok cyklov prietoku. Martin sa pokúsil vysvetliť mechanizmus soľno-vodného oscilátora na základe rovnice popisujúcej pohyb viskóznej kvapaliny. Yoshikawa so spolupracovníkmi vyšli z Martinovej rovnice, použili numerickú simuláciu založenú na jednoduchej nelineárnej diferenciálnej rovnici a ukázali, že soľno-vodný oscilátor má rôzne nelineárne vlastnosti, napr. limitný cyklus, bifurkáciu oscilačného prietoku atď. Hlavnou hnacou silou oscilácií je gravitačná nestabilita spôsobená rozdielom hustôt. Oscilačné reakcie prebiehajú aj v systémoch, ako napr. glycerol - voda, alebo v systémoch s nepolárnymi látkami, ako napr. benzén - cyklohexán, v ktorých nie je prítomná soľ. Podstatné je, aby hustejšia kvapalina bola umiestnená nad riedšou. Tieto systémy sa nazývajú hydrodynamické oscilátory.
Oscilačné javy na membráne alebo na rozhraní fáz hrajú dôležitú úlohu v samoorganizácii živých organizmov. V systéme pozostávajúcom z oleja a vody, ktorý predstavuje model živej bunky, možno namerať rytmické oscilácie elektrického potenciálu (ich tvar a perióda závisí od pridania rôznych typov povrchovo aktívnych látok).
Hydrodynamický oscilátor, keďže má schopnosť periodicky prenášať hmotu, môže byť využitý na sledovanie spriahnutia dvoch rôznych chemických oscilátorov (nádobka B môže obsahovať oscilátor Na-BrO3-H2S04-Mn2+s kyselinou malónovou, nádobka A oscilátor s kyselinou oxálovou ako substrátom), na periodickú perturbáciu oscilačného systému látkou, ktorá iniciuje alebo inhibuje oscilačnú kinetiku, a tiež na periodické miešanie reaktantov jedného oscilačného systému. Pri štúdiu spriahnutých chemických oscilátorov boli pozorované rozmanité dynamické javy vrátane chaosu. Hydrodynamický oscilátor umožňuje vznik chemických oscilácií aj v systémoch, kde by sme ich neočakávali.
Literatura
1. R.M. Noyes : J. Chem. Educ. 66, 207 (1989).2. K. Yoshikawa, S. Nakata, M. Yamanaka, T. Waki : J. Chem. Educ. 66, 205 (1989).
3. Ľ. Adamčíková, Z. Melichová : Collect. Czech. Chem. Commun. 57, 1621 (1992).
4. K. Yoshikawa, N. Oyama, M. Shoji, S. Nakata : Am. J. Phys. 59, 137 (1991).
Oscilační reakce patří k vzrušujícím oblastem chemické reakční kinetiky posledních dvaceti let. Zatímco většina chemických reakcí probíhá buď jedním směrem od reaktantů k produktům, nebo do rovnováhy mezi reaktanty a produkty, v oscilačních reakcích se koncentrace produktu s časem periodicky mění, reakční produkt v pravidelných fázích střídavě vzniká nebo je spotřebováván. Oscilační reakce otevírají nadto cestu k daleko složitějším a hlubším jevům, jako je chaos a uspořádání v chemických soustavách: ukazuje se, že tvořící se produkt (pokud je jej možno např. barevně odlišit) nevzniká v různých místech soustavy (např. v roztoku) náhodně, ale vlivem kombinace chemické reakce s difuzí vytváří pravidelné obrazce (spirály, kruhové terče, vlákna a pod.). Ve Vesmíru o této problematice psal už prof. Ľ. Treindl. Oscilační reakce hrají významnou roli v biologických soustavách, četné biochemické systémy jeví oscilační charakter (enzymatické reakce, reakce glykolýzy, tj. přeměny glukózy na alkohol, oscilační jevy v mitochondriích). Proto se k nim vracíme v následujících příspěvcích.

























