Tekutost krve
 Krev není voda, i když teče. Podobně jako voda může zatuhnout, ale nepotřebuje k tomu bod mrazu. Tento jev, koagulace, nás sice chrání při poranění před vykrvácením, avšak může ohrozit náš život, jestliže k ní dojde uvnitř věnčitých tepen nebo v cévách mozku. Faktory rozhodující o tekutosti krve mají životní důležitost. Které to jsou a jak působí?
Krev není voda, i když teče. Podobně jako voda může zatuhnout, ale nepotřebuje k tomu bod mrazu. Tento jev, koagulace, nás sice chrání při poranění před vykrvácením, avšak může ohrozit náš život, jestliže k ní dojde uvnitř věnčitých tepen nebo v cévách mozku. Faktory rozhodující o tekutosti krve mají životní důležitost. Které to jsou a jak působí?
Kromě asi 80 % vody obsahuje krev řadu bílkovin (albuminy, globuliny a fibrinogen) tvořících krevní plazmu. Téměř polovinu objemu krve zabírají krevní buňky, většinou červené krvinky – erytrocyty. V jednom litru krve, jíž má dospělý člověk celkem asi 5,5 l, je 4,5 – 6 bilionů (6.1012) erytrocytů, 150 – 400 miliard (4.1011) krevních destiček (trombocytů) a 5 –10 miliard (109) bílých krvinek (leukocytů), které rozlišujeme na granulocyty, lymfocyty a monocyty.
 Fibrinogen je klíčovou bílkovinou, která umožňuje změny tekutosti krve. Při normální koncentraci (1,5 – 3,5 g v litru krve) je schopen proměnit tekoucí krev v tuhý rosol – krevní koagulum. Štěpením z něj vzniká nerozpustný fibrin a celý tento proces zahajuje enzym trombin. Je zřejmé, že tento enzym nemůže být v krvi přítomen v aktivní formě („neboť jinak bychom měli z krve huspeninu“). Krev skutečně obsahuje bílkovinu protrombin bez proteinázové aktivity, ten se však může účinkem jiných proteináz přeměnit na aktivní trombin. Dostáváme se k ústřednímu problému srážlivosti krve:
Fibrinogen je klíčovou bílkovinou, která umožňuje změny tekutosti krve. Při normální koncentraci (1,5 – 3,5 g v litru krve) je schopen proměnit tekoucí krev v tuhý rosol – krevní koagulum. Štěpením z něj vzniká nerozpustný fibrin a celý tento proces zahajuje enzym trombin. Je zřejmé, že tento enzym nemůže být v krvi přítomen v aktivní formě („neboť jinak bychom měli z krve huspeninu“). Krev skutečně obsahuje bílkovinu protrombin bez proteinázové aktivity, ten se však může účinkem jiných proteináz přeměnit na aktivní trombin. Dostáváme se k ústřednímu problému srážlivosti krve:
Spuštění a zastavení tvorby trombinu
Krev je po nabrání ze žíly do zkumavky tekutá, avšak po chvíli se spontánně začne srážet. Když před sražením odstředíme krevní buňky a získáme tak krevní plazmu, rovněž se po čase srazí. Je tedy zřejmé, že vše potřebné ke srážení krve je již obsaženo v plazmě. Výzkum procesu srážení krve ve zkumavce probíhá intenzivně zhruba sto let. Velmi brzy se zjistilo, že se ho účastní různé složky plazmy. Když se začali studovat pacienti s poruchami srážlivosti krve, zjistilo se, že tyto poruchy způsobuje nepřítomnost nebo nefunkčnost určitých složek plazmy a postupně tak vznikal koncept koagulačních faktorů. Normálního srážení krve těchto pacientů se ve zkumavce dosáhlo přidáním chybějících faktorů, izolovaných ze zdravé krve. Tyto pokusy ukázaly cestu k léčení řady poruch srážlivosti, neboť koncentrované faktory lze dodávat přímo do krevního oběhu nemocných.
Výzkum procesu srážení krve ve zkumavce probíhá intenzivně zhruba sto let. Velmi brzy se zjistilo, že se ho účastní různé složky plazmy. Když se začali studovat pacienti s poruchami srážlivosti krve, zjistilo se, že tyto poruchy způsobuje nepřítomnost nebo nefunkčnost určitých složek plazmy a postupně tak vznikal koncept koagulačních faktorů. Normálního srážení krve těchto pacientů se ve zkumavce dosáhlo přidáním chybějících faktorů, izolovaných ze zdravé krve. Tyto pokusy ukázaly cestu k léčení řady poruch srážlivosti, neboť koncentrované faktory lze dodávat přímo do krevního oběhu nemocných.
Koncept koagulačních faktorů
spočívá na představě lineární kaskády (respektive dvou kaskád) faktorů, které mohou být buď v neaktivní (zymogenové), nebo v aktivní formě. Aktivní faktor z předcházející části kaskády působí na následující neaktivní faktor a přemění jej na aktivní, až v posledním stupni z protrombinu vzniká trombin. Koagulační kaskáda se zcela uměle dělí na dráhu “vnitřní“ (která se tak nazývá asi proto, že k její aktivaci dojde při vnějším poranění) a dráhu “vnější“ (aktivovanou samozřejmě uvolněním vnitřního proteinu z buněk). Ve skutečnosti jsou obě dráhy propojeny (např. faktor VIIa z “vnější“ dráhy může aktivovat faktor IX z “vnitřní“ dráhy). Koagulační kaskáda funguje na podobném principu jako fotonásobič: vstupní signál je v následujících stupních opakovaně zesilován. To umožňuje snížit koncentrace koagulačních faktorů v plazmě: tak zatímco výkonného činitele koagulace – fibrinogenu je potřeba okolo 2 g v litru, prvního členu koagulační kaskády, faktoru XII, může být přítomno 70krát méně. Tato skutečnost je mnohem důležitější, než se může na první pohled zdát. Rozpustnost proteinů ve vodě není neomezená (tj. rozpuštěné proteiny „zabírají místo“, za určité koncentrace se další proteiny do roztoku „nevejdou“) a snížení koncentrace kterékoliv ze složek plazmy (při zachování funkce) poskytuje prostor pro další proteiny, které se mohou uplatnit jako regulační prvky, a tím zjemnit odpovědi celého koagulačního systému na měnící se vnější i vnitřní podmínky.Schematické zobrazení aktivačních procesů na obrázku naznačuje, že musí docházet ke spolupráci různých faktorů. Ve skutečnosti dochází k vytváření fyzických komplexů. Nejdůležitějším z nich je protrombinázový komplex, který je výsledkem aktivity jak „vnější“, tak „vnitřní“ dráhy. Tvoří ho faktory Xa, Va, membránový povrch a ionty vápníku. Tento enzymový komplex katalyzuje štěpení dvou peptidových vazeb v molekule protrombinu a tím dává vzniknout trombinu. Asociace faktorů Xa a Va za vzniku protrombinázového komplexu může probíhat na povrchu řady buněk, například krevních destiček, endotelií, nebo monocytů. Trombin pozitivní zpětnou vazbou zvyšuje aktivitu protrombinázového komplexu jednak tím, že aktivuje FV, jednak aktivací FVIII přispívá ke zvýšení tvorby FXa, který také aktivuje FV (čárkované šipky v obrázku).
Protrombinázový komplex vzniká v důsledku aktivity dvou dalších enzymových komplexů aktivujících FX – „vnitřního“ a “vnějšího“. „Vnitřní“ komplex je tvořen FIXa asociovaným s faktorem VIIIa na povrchu membrány v přítomnosti vápníkových iontů. „Vnější“ komplex je tvořen FVIIa asociovaným s tkáňovým faktorem v přítomnosti iontů vápníku a může katalyzovat aktivaci FIX nebo FX. Proteolytická aktivace zvyšuje aktivitu FVIIa jen stonásobně v porovnání s desetitisícinásobným zvýšením aktivity ostatních aktivovaných faktorů. Další komplex – aktivační – se vytváří ze souboru proteinů, které zahajují celou kaskádu.
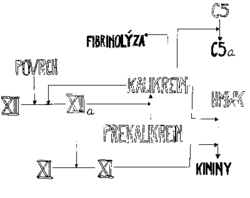
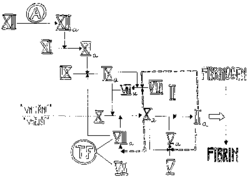 Členy aktivačního komplexu působí i na ostatní složky plazmy. Tak FXIIa přispívá k produkci FVIIa, kalikrein aktivuje proces rozpouštění krevní zátky – fibrinolýzu a rovněž aktivuje složky komplementu, které potom působí jako chemoatraktanty a aktivátory leukocytů (komplement je soubor vzájemně se aktivujících proteinů, který v konečné podobě zabíjí cizorodé buňky vytvořením pórů v jejich stěnách).
Členy aktivačního komplexu působí i na ostatní složky plazmy. Tak FXIIa přispívá k produkci FVIIa, kalikrein aktivuje proces rozpouštění krevní zátky – fibrinolýzu a rovněž aktivuje složky komplementu, které potom působí jako chemoatraktanty a aktivátory leukocytů (komplement je soubor vzájemně se aktivujících proteinů, který v konečné podobě zabíjí cizorodé buňky vytvořením pórů v jejich stěnách).
Z údajů o krvácivosti pacientů se sníženým obsahem některých prvků aktivačního komplexu však vyplývá, že tento komplex není pro zastavení krvácení rozhodující, jelikož jeho nedostatečnost se neprojevuje zvýšenou krvácivostí. Ve skutečnosti první pacient, u něhož byla zjištěna nedostatečnost FXII, zemřel na plicní embolii, tedy následkem zvýšené srážlivosti krve. Zdá se, že pro zastavení krvácení je nejdůležitější aktivování koagulace tkáňovým faktorem.
Inaktivační proces
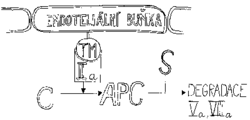
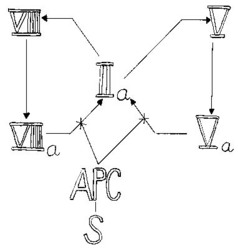
Celý soubor procesů od spuštění koagulace až po vytvoření trombinu může v krátké době proměnit všechnu krev v krevní sraženinu. Je zřejmé, že současně s tvorbou trombinu se musí spustit procesy vedoucí k jeho inaktivaci. Nejcitlivějším indikátorem přítomnosti trombinu je ovšem trombin sám. Podobně jako zesiluje svoji produkci aktivováním faktorů VIII a V, působí sám i ke své zhoubě. To se děje za pomoci dalších proteinů: trombomodulinu (TM), proteinu C a proteinu S.Endoteliální buňky, které tvoří výstelku vnitřku cévy, mohou na svém povrchu vystavit trombomodulin, jenž váže trombin. Takto modifikovaný trombin potom aktivuje protein C cirkulující v plazmě. Vzniká aktivovaný protein C (APC), který v komplexu s kofaktorem, proteinem S, působí degradaci aktivovaných proteinů Va a VIIIa působením na tytéž členy koagulační kaskády.
 Komplex aktivovaného proteinu C prudce sníží produkci trombinu, je však třeba zlikvidovat i trombin již vytvořený. To je úloha pro další protein krevní plazmy, antitrombin III, který ve spolupráci s heparinem inhibuje nejen trombin, ale i FXa, čímž veškerá produkce ustane a zastaví se tvorba fibrinu.
Komplex aktivovaného proteinu C prudce sníží produkci trombinu, je však třeba zlikvidovat i trombin již vytvořený. To je úloha pro další protein krevní plazmy, antitrombin III, který ve spolupráci s heparinem inhibuje nejen trombin, ale i FXa, čímž veškerá produkce ustane a zastaví se tvorba fibrinu.
Klasický kaskádový koncept koagulace nedokázal vysvětlit,
proč dochází ke krvácení u hemofiliků
– pacientů se sníženou koncentrací nebo s chybějícím faktorem VIII. FVIII se nachází ve „vnitřní“ koagulační dráze (viz obrázek), a není zřejmé, proč nefunkční „vnitřní“ dráhu nemůže zastoupit dráha “vnější“, zejména z hlediska důležitosti tkáňového faktoru pro zahájení koagulace. Tuto záhadu pomohlo objasnit objevení inhibitoru koagulace asociovaného s lipoproteiny plazmy (lipoprotein-associated coagulation inhibitor – LACI). LACI totiž vytváří komplex Xa-LACI-VIIa-TF a tím blokuje „vnější“ dráhu produkce trombinu. Zůstává tak otevřená jedině aktivace FIX komplexem TF a faktoru VII. Vzniklý FIXa vyžaduje k aktivaci FX přítomnost FVIIIa, a ten se právě hemofilikům nedostává. Navíc u hemofiliků dochází ke krvácení zejména ve tkáních se sníženým obsahem TF, jako jsou klouby a svaly, kde je handicap nedostatku FVIII ještě zesílen nedostatkem TF.Funkce krevních buněk
Dosud jsme se dívali na vznik trombinu a tvorbu fibrinu bez přílišného zdůrazňování funkce krevních buněk v tomto procesu. Z hlediska regulace tekutosti krve mají však krevní buňky výrazné uplatnění a krevní destičky hrají hlavní roli při zastavení krvácení. Nejdříve se podívejme na konstrukci „potrubí“, kterým krev protéká v těle.Krev obíhá uvnitř cév, jež se dělí na stále užší, až do krevních kapilár. Celková plocha cévních stěn přesahuje 6 300 m2. Na tomto obrovském povrchu musí být zajištěn hladký průtok krve. Je zřejmé, že povrch vnitřku cév musí mít zcela speciální vlastnosti. O to pečuje asi trilion (1015) endoteliálních buněk, které tvoří výstelku vnitřního povrchu cév a které ovlivňují vlastnosti krve aktivně – jsou vybaveny schopností působit prokoagulačně i antikoagulačně.
Nežádoucímu srážení krve brání především stavbou svých membrán, které obsahují heparansulfát. Ten umožňuje inaktivaci trombinu a dalších koagulačních faktorů antitrombinem III. Už také víme, že endoteliální buňky obsahují trombomodulin, jenž umožňuje zastavení koagulace aktivací proteinu C. Kofaktor pro APC – protein S – je rovněž syntetizován a uvolňován do oběhu endoteliálními buňkami. Tyto buňky také regulují přilnutí (adhezi) nebo uvolnění různých krevních buněk ze svého povrchu, a tím rozhodují o průchodnosti cév.
 Srážení krve mohou endoteliální buňky zahájit svým smrštěním. Tím odhalí subendoteliální povrch cév tvořený kolagenem, na který začnou nasedat obíhající krevní destičky a dojde k jejich shlukování (agregaci). Už jsme se dověděli, že k adhezi destiček je potřebný von Willebrandův faktor. Ten je také syntetizován a uvolňován do oběhu endoteliálními buňkami. Endoteliální buňky rovněž přispívají k zahájení koagulace vystavením TF na svém povrchu a také syntetizují FV. Změnou svých povrchových vlastností mohou sloužit jako podklad pro sestavení „vnitřního“ komplexu aktivujícího FX. Při poranění cévy se endoteliální buňky podílejí na regulaci celého procesu tvorby krevní zátky na mnoha úrovních.
Srážení krve mohou endoteliální buňky zahájit svým smrštěním. Tím odhalí subendoteliální povrch cév tvořený kolagenem, na který začnou nasedat obíhající krevní destičky a dojde k jejich shlukování (agregaci). Už jsme se dověděli, že k adhezi destiček je potřebný von Willebrandův faktor. Ten je také syntetizován a uvolňován do oběhu endoteliálními buňkami. Endoteliální buňky rovněž přispívají k zahájení koagulace vystavením TF na svém povrchu a také syntetizují FV. Změnou svých povrchových vlastností mohou sloužit jako podklad pro sestavení „vnitřního“ komplexu aktivujícího FX. Při poranění cévy se endoteliální buňky podílejí na regulaci celého procesu tvorby krevní zátky na mnoha úrovních.
Scénář událostí při poranění cévy
Jakékoliv narušení celistvosti cév iniciuje fyziologický proces známý jako primární a sekundární hemostáza. Má za následek spontánní zastavení krvácení a zahrnuje lokální seškrcení cévy (vazokonstrikci), adhezi krevních destiček a jejich agregaci, tvorbu fibrinu a zachycení dalších buněk (erytrocytů, leukocytů) do fibrinové sítě.Záchranné práce probíhají na mnoha místech současně. Při poškození cévy dojde k odkrytí kolagenu a hladkého svalstva tvořícího cévní stěnu. To je signálem pro vznik aktivačního komplexu „vnitřní“ dráhy. Na výsledek si ale musíme chvíli počkat. Okamžitě však dojde k obnažení TF, vazbě FVII, aktivaci FX a vzniku trombinu. Téměř současně je tato dráha zablokována LACI. Mezitím na povrch rány adheroval vWF, jednak z cirkulace, jednak uvolněný okolními endoteliálními buňkami. Na vWF se začínají vázat krevní destičky. Stopy trombinu vzniklé „vnější“ dráhou a kontakt s kolagenem vedou k jejich aktivaci. Aktivovaná krevní destička je něco úplně jiného a aktivitou přímo srší. Aktivované destičky se začnou navzájem spojovat prostřednictvím fibrinogenu a vytvářejí zátku, která ránu ucpe. Produkují rovněž faktory urychlující jejich aktivaci a agregaci, uvolňují obsažené koagulační faktory (FV, FXIII, fibrinogen, vápník) a začínají produkovat růstové faktory, které podporují dělení fibroblastů a hladkých svalů, čímž se v konečné fázi rána zahladí.
 Při agregaci destiček dochází rovněž ke změnám ve složení jejich membrány, takže se může vytvářet protrombinázový komplex z FXa, který mezitím vznikl spojeným úsilím „vnitřní“ a “vnější“ koagulační dráhy. Aktivační komplex „vnitřní“ dráhy rovněž dodá bradykinin, který instruuje endoteliální buňky k syntéze látky zvané „faktor aktivující destičky“ (PAF). PAF jednak přispívá k urychlení agregace destiček, a pak také slouží k vyvolání pocitu bolesti, čímž nás osobně angažuje na zastavení krvácení. Mezitím protrombinázový komplex na povrchu aktivovaných destiček produkuje trombin, jenž vytváří fibrinovou síť, která zpevňuje krevní zátku a zachycuje další krevní buňky. Ty se dostavují na místo akce i dobrovolně, přivolány chemoatraktanty. Jedna taková látka, složka komplementu C5a, vzniká účinkem aktivačního komplexu „vnitřní“ dráhy (obrázek). Pravděpodobně nejdůležitější událostí při aktivaci destiček je
Při agregaci destiček dochází rovněž ke změnám ve složení jejich membrány, takže se může vytvářet protrombinázový komplex z FXa, který mezitím vznikl spojeným úsilím „vnitřní“ a “vnější“ koagulační dráhy. Aktivační komplex „vnitřní“ dráhy rovněž dodá bradykinin, který instruuje endoteliální buňky k syntéze látky zvané „faktor aktivující destičky“ (PAF). PAF jednak přispívá k urychlení agregace destiček, a pak také slouží k vyvolání pocitu bolesti, čímž nás osobně angažuje na zastavení krvácení. Mezitím protrombinázový komplex na povrchu aktivovaných destiček produkuje trombin, jenž vytváří fibrinovou síť, která zpevňuje krevní zátku a zachycuje další krevní buňky. Ty se dostavují na místo akce i dobrovolně, přivolány chemoatraktanty. Jedna taková látka, složka komplementu C5a, vzniká účinkem aktivačního komplexu „vnitřní“ dráhy (obrázek). Pravděpodobně nejdůležitější událostí při aktivaci destiček je
uvolnění kyseliny arachidonové
z buněčné membrány. Kyselina arachidonová ( Vesmír 70, 536, 9/1991) slouží jako substrát pro dva různé enzymové systémy. Destičky aktivují zejména cyklooxygenázu, produkující prostaglandiny a tromboxany, které urychlují jejich agregaci. Druhý enzymový systém, představovaný lipoxygenázou je přítomen hlavně v leukocytech a produkuje leukotrieny. Destičky uvolněním kyseliny arachidonové a meziproduktů její oxidace do okolí přispívají ke komplexním interakcím v místě tvorby hemostatické zátky. Kyselina arachidonová může např. sloužit granulocytům k syntéze leukotrienu A4, který vstupuje do erytrocytů, kde je přeměněn na leukotrien B4, jenž potom účinkuje jako chemoatraktant na cirkulující granulocyty, indukuje jejich adhezi na endoteliální buňky a navozuje uvolnění obsahu jejich granulí, v nichž se nachází soubor baktericidních prostředků. Dá se samozřejmě očekávat, že v místě poranění dojde k bakteriální invazi.Aktivní účast buněk při tvorbě hemostatické zátky
Dříve se předpokládalo, že krevní buňky jsou pouze pasivně zachyceny v síti fibrinu. To platilo zejména o erytrocytech, jejichž metabolické možnosti jsou v porovnání s leukocyty mnohem menší. Kromě uvedeného příkladu účasti erytrocytů na syntéze leukotrienu B4 mohou však erytrocyty přispívat i k regulaci velikosti hemostatické zátky a k obnovení normálního průtoku krve. Mohou totiž uvolňovat adeninové nukleotidy, které v počátečních fázích tvorby zátky podporují agregaci destiček, ale v dalších fázích se stanou obětí enzymu vylučovaného endoteliálními buňkami, který provede jejich konverzi na adenozin. Ten uvolňuje stažení cévy a zabraňuje další aktivaci destiček, čímž zastavuje růst hemostatické zátky. Také uvolňuje adherované leukocyty a inhibuje jejich produkci peroxidu vodíku, který už není potřeba k potírání bakterií, a mohl by naopak vést k poškození vlastních tkání.K ukončení obranných reakcí
přispívají i endoteliální buňky, pro které jsou oxidační produkty adherovaných leukocytů signálem k syntéze a uvolnění prostacyklinu (prostaglandinu I2). Ten rovněž zabraňuje agregaci dalších destiček a uklízí reaktivní sloučeniny kyslíku (např. superoxid) produkované stimulovanými leukocyty. Endoteliální buňky ještě na závěr vypustí relaxační faktor EDRF, o kterém se ví, že to je oxid dusnatý. NO přispěje k úplnému zastavení agregace destiček a uvolnění staženou cévu. A protože už ustala produkce faktoru aktivujícího destičky (PAF) a prostaglandinů, mediátorů bolesti, nad ucpanou ránou se rozhostí klid a mozek si dopřeje svoji dávku endogenních morfinů.
A protože už ustala produkce faktoru aktivujícího destičky (PAF) a prostaglandinů, mediátorů bolesti, nad ucpanou ránou se rozhostí klid a mozek si dopřeje svoji dávku endogenních morfinů.
Nesmírná rozlehlost
regulačních pochodů koagulace sahá od jednotlivých chemických reakcí až po mnohačetné interakce mezi různými typy buněk. Charakteristické je zejména časté uplatnění pozitivní zpětné vazby. Mohlo by se zdát, že zneprůchodnění cév je naprosto nevyhnutelným důsledkem pokusů o ucpání rány. Že tomu tak však není, a k tragickým následkům poruchy koagulace dochází pouze při onemocnění, svědčí o účinnosti těchto regulací.Na příkladu „vnější“ a “vnitřní“ dráhy je vidět, že rozdělení předmětu studia na různé části může sice zjednodušit prostudování jednotlivých prvků, ale také bránit pochopení, jak systém funguje vcelku. Na mnoha místech procesu koagulace dochází k interakci s dalšími systémy přítomnými v krvi, které jsme si prozatím označili jako „systém komplementu“, „imunitní systém“ atd.
Tyto systémy jsou jen naše abstraktní koncepce, které nám brání pochopit, jak vlastně funguje „homeostatický supersystém“.
V České republice je evidováno 699 nemocných hemofilií. 595 nemocných trpí hemofilií A a 104 nemocných hemofilií B. Kromě toho je evidováno kolem 300 nemocných von Willebrandovou chorobou, která se od hemofilie klinicky příliš neliší. Rozlišení jednotlivých typů onemocnění je možné pouze na základě podrobného laboratorního vyšetření.
Klinický obraz hemofilie je odvislý od výše hladiny faktoru VIII nebo IX (u hemofilie B). Pouze nemocní s hladinou menší než 1% trpí spontánními krvácivými projevy především do kloubů a svalů. Lehčí forma nemoci působí krvácení pouze po úrazech nebo po chirurgických výkonech.
Nemocní jsou léčeni podáváním chybějícího koagulačního faktoru, připraveného z normální lidské plazmy, nebo koncentráty, připravenými metodami genového inženýrství.
U dospělého člověka se v kostní dřeni některých kostí tvoří všechny červené krvinky, 60–70 % bílých krvinek (tj. granulocyty) a všechny krevní destičky (trombocyty). Lymfatické tkáně tvoří lymfocyty (tj. 20–30 % bílých krvinek). Retikuloendoteliální tkáň sleziny, jater, lymfatických uzlin a dalších orgánů tvoří monocyty (tj. 4–8 % bílých krvinek). Trombocyty, což jsou spíše malé fragmenty buněk než celé buňky, se tvoří z cytoplazmy megakaryocytů kostní dřeně.
U lidského embrya je prvým místem tvorby krevních buněk žloutkový vak. Později v životě embrya se stanou nejdůležitějším orgánem tvořícím krevní buňky játra, avšak brzy je nahradí kostní dřeň. Typické počty vytvořených buněk jsou pro dospělého člověka: 200 miliard červených krvinek, 10 miliard bílých krvinek a 400 miliard krevních destiček denně.

























