Zpráva o usměrněných mutacích
| 8. 11. 1995Jednou ze základních vlastností živých organizmů je dědičnost, která je zárukou toho, že se potomci podobají svým rodičům. Důležité je ono slovo „podobají“; skutečně nikdy nejde o dokonalé kopie. To je do jisté míry zajištěno spojením vlastností obou rodičů, což je ovšem možné jen u pohlavně se rozmnožujících organizmů, a vždy jde jen o novou kombinaci starých vlastností. Opravdu nové vlastnosti mohou vzniknout pouze změnou v zápisu dědičné informace – mutací. Dlouho nebylo jasné, jak mutace vznikají. Postupně se ukazovalo, že existují dva různé způsoby – jednak mohou být vyvolány přímým poškozením molekuly DNA (např. UV-zářením nebo chemikáliemi), jednak mohou vznikat spontánně chybou při zdvojování DNA. Vždy však je to záležitost náhodná, bez určení kdy, kde a jak se odehraje a jaký bude výsledek.
Jádrem mnohých sporů přírodovědců i laiků je právě to, do jaké míry je předchozí věta pravdivá. Máme na svět nahlížet očima neodarwinistů, pro něž je každá změna oproti originálu chybou (která se někdy může vyplatit) a evoluce vedlejším produktem nedokonalosti enzymů zdvojujících DNA (v součinnosti se skutečností, že všichni přežít nemohou)? Nebo smíme organizmům přiznat schopnost zdokonalovat sebe sama v souladu s požadavky okolního prostředí a nové lepší vlastnosti přenášet na potomky, jak o tom snil Lamarck?
Odpověď nebude jednoduchá. Jako ukázka otevřenosti a zamotanosti tohoto problému může posloužit zpráva, jak si dnes v tomto ohledu stojí bakterie (viz také N. Symonds, Vesmír 71, 129, 1992/3). Vždyť někteří evoluční i jiní biologové alespoň čas od času připouštějí, že právě bakteriím by se schopnost reagovat na okolní prostředí a případné vhodné získané změny předat svým potomkům mimořádně hodila – změna v genomu kterékoliv bakterie se totiž přenáší na všechny její budoucí potomky. Přitom objevy, které přivedly biology od Lamarcka k mutacím jako náhodným chybám DNA polymerázy při replikaci DNA byly umožněny hlavně intenzivním výzkumem bakterií.
Repetitorium o původu mutací
Řádně a systematicky se testováním hypotéz o původu mutací začali zabývat na počátku 40. let pánové Salvator Luria a Max Delbrück a vymysleli na to fluktuační test. Jako model jim posloužily bakterie citlivé k bakteriofágu (bakteriálnímu viru) T1, které vysévali na misky obsahující právě tohoto bakteriofága. Pokud by mutace vznikaly bez jakéhokoliv vlivu vnějšího prostředí, pak by počet kolonií odolných buněk na miskách závisel pouze na tom, kdy během kultivace k mutaci v bakteriální kultuře došlo. Na většině misek bychom nenašli žádné kolonie (pravděpodobnost vzniku mutace je nízká), na některých by vyrostlo pár kolonií a na několika málo by velký počet kolonií svědčil o tom, že k příslušné mutaci došlo již na začátku života kultury. Jestliže ale mutace vznikají pouze vlivem vnějšího prostředí, pak by měl být počet odolných kolonií na všech miskách přibližně stejný. Výsledky Lurii a Delbrücka odpovídaly velmi přesně první hypotéze. Podobně dopadly i další testy, které byly provedeny později a byly založeny na odlišných postupech. Tyto pokusy skutečně potvrdily, že mutace někdy mohou vznikat náhodně a nezávisle na vnějším prostředí. Rozhodně však neprokázaly, že mohou vznikat pouze tímto způsobem.Hlavní problém totiž spočíval (jak to tak v biologii často bývá) ve zvoleném modelu. Bakteriofág T1 je velmi virulentní – ihned po vstupu do hostitele ničí jeho DNA a veškerý jeho metabolizmus podřizuje svým požadavkům. Navíc jsou k tomu, aby se bakterie změnila z citlivé na odolnou, zapotřebí i určité změny na povrchu buňky. V tomto uspořádání tedy bakterie buď příslušnou mutaci náhodou měla už po prababičce a přežila, anebo nezdědila nic, a pak měla smůlu, protože všechno šlo tak rychle, že zemřela dřív, než se vzpamatovala. I ve všech dalších pokusech byl použit podobný způsob selekce – pokud buňka neměla potřebnou vlastnost, zahynula. Bakterie prostě vůbec neměly čas prokázat svou (potenciální) schopnost tvořit vhodné mutace. Luria i Delbrück si toho byli dobře vědomi a v diskusi ke svým výsledkům uvedli, že „zcela jiná situace by byla zřejmě v případě mutací genů energetického metabolizmu“, při níž by bylo možno použít neletální selekci, takže bakterie by nezahynuly ihned. Jejich hlas zřejmě zanikl v radostných ovacích nad vyřešením problémů s mutacemi.
O 45 let později vystoupil s kritikou fluktuačního testu John Cairns se spolupracovníky a s bakteriemi mutovanými v genu pro enzym βgalaktozidázu. Tyto bakterie nejsou schopny využívat jako zdroj uhlíku a energie laktózu, nicméně vysejeme-li je na selektivní médium (médium, kde vytvoří kolonii jen buňky s určitou vlastností; v tomto případě médium s laktózou), nezahynou ihned, ale ještě několik dní celkem dobře přežívají – mají tedy čas ukázat, zda si dovedou se svízelnou situací poradit. Při tomto uspořádání Cairnsova skupina zjistila, že se na miskách s laktózou objeví asi po 2 dnech (tedy v době, kdy mají řádné bakteriální kolonie narůst) několik málo kolonií zřejmě spontánních mutantů a že ještě několik dalších dní přibývají kolonie nové. Tyto „opožděné“ kolonie vyrostly zřejmě z buněk, které potřebnou mutaci získaly v době, kdy se už bakterie na misce nedělily (protože se dělit nemohly, nemajíce energie nazbyt). Cairns navíc prokázal, že se tyto pozdní mutace objevují skutečně pouze v přítomnosti laktózy a že jsou specifické, neboť se týkají jenom toho genu, jehož změna umožní buňce vyřešit kritickou situaci. Bakterie tedy zjistily, že by se jim zatraceně hodil gen pro β-galaktozidázu, a jelikož byl poškozený, opravily si jej.
Výsledky Cairnsovy skupiny vyvolaly bouřlivou debatu. Vždyť (přinejmenším) naznačovaly, že mutace vznikají i v nedělících se buňkách a jsou zřejmě usměrněné tak, aby byly pro organizmus v daném prostředí výhodné, tedy že bakterie mohou specificky reagovat na vnější prostředí změnou své genetické informace, což by se v neodarwinistickém světě skutečně dít nemělo! Navíc Cairns své výsledky interpretoval způsobem, který byl i na značně volné mravy vědy konce 20. století trochu příliš neortodoxní.
Odpůrci a přívrženci
Přívrženci se soustředili na prokázání usměrněných (cairnsovských, adaptivních, vynucených, cílených – jak je komu libo) mutací u co největšího počtu modelových systémů. Do elitního klubu usměrněných mutací mohla být zařazena jen taková mutace, která- je specifická, tedy její vznik vyřeší kritickou životní situaci mikroorganizmu,
- je (zřejmě) nezávislá na replikaci, tedy vzniká i v nerostoucích buňkách.
V krátké době byla publikována řada nejrůznějších pozorování usměrněných mutací u Escherichia coli. Autoři těchto článků náhle zjišťovali, že bakterie mají neobyčejnou a nepochybnou schopnost měnit svou genetickou informaci přesně tak, jak právě potřebují. Pokud mají poškozený gen, který kóduje enzym účastnící se výroby nějaké pro život nezbytné látky, dovedou jej v případě nouze „opravit“. Tato mutace – oprava probíhá v buňce na selektivním médiu, která se již dávno nedělí (protože jí chybí právě ta jedna látka), je cílená na jeden jediný potřebný gen a vzniká mnohem častěji než běžná mutace při replikaci. Některé pokusy dokonce prokázaly, že si bakterie v nouzi dovede opravit i gen, který je poškozen dvěma nezávislými mutacemi, nebo naopak dva nezávislé geny, každý s jednou mutací, k čemuž při běžné replikaci téměř vůbec nedochází. Kromě bodových mutací, tedy záměn jednoho nukleotidu za jiný, byly pozorovány i opravy posunových mutací, kdy je vložen (nebo odebrán) určitý počet nukleotidů tak, že je genetická informace čtena špatně – po špatných trojicích nukleotidů. I v tomto případě byl příslušný gen opraven, pokud se bakterie nacházela v takové situaci, že pouze tato oprava jí umožnila dále se rozmnožovat.
Na světlo světa byly znovu vyneseny některé starší výsledky, které mohly být teď „nově“ interpretovány. Mezi ně patřila zejména pozorování Jamese Shapira, že k vystřižení bakteriofága Mu, který se umí vložit (a zase vystřihnout) do bakteriálního chromozomu, dochází s větší frekvencí tehdy, je-li pro růst bakterie potřebný právě ten gen, jenž byl vložením bakteriofága poškozen.
Usměrněné mutace byly zjištěny i u některých jiných jednobuněčných organizmů, například u bakterie Salmonella typhimurium, kvasinky Saccharomyces cerevisiae a dalších.
Ani odpůrci nelenili. Velmi často se snažili publikované výsledky vysvětlit jako artefakt nevhodně provedených pokusů. Jednu možnost kritiky poskytuje vlastní způsob hledání bakterií s usměrněnou mutací. Nejsnáze určíme u mikroorganizmů dědičné vlastnosti a jejich změny tak, že buňky vyséváme na různá selektivní média a čekáme, zda vyroste nějaká kolonie. Protože je frekvence usměrněných mutací (a mutací vůbec) relativně nízká, vysévá se na každou misku asi 108 buněk. Některé odolnější bakterie by tedy prý mohly kanibalsky týt z buněk, které hladovějíce odumřely a následně uvolnily žádané živiny. A tak prý senzacechtiví badatelé zaměňují hypotetické usměrněné mutanty s kanibaly na základě jediné dobře pozorovatelné vlastnosti mikroorganizmů – schopnosti dělit se a tvořit kolonie. Nicméně přívrženci zjistili, že si hladovějící bakterie na Petriho misce udržují životaschopnost velmi dlouhou dobu, a i když už ztratí schopnost rozmnožovat se, zůstávají ještě nějakou dobu neporušeny.
 Zajímavá je námitka, že by mutantní buňky mohly růst pomaleji, což by způsobovalo onen optický dojem opožděného objevování. Ve většině sledovaných případů však šlo o návrat k původnímu stavu (uměle poškozený gen byl opraven – bakterie získala zpět svou původní vlastnost), o němž lze jen těžko předpokládat, že se v něm buňka bude rozmnožovat pomaleji. Navíc rychlost růstu buněk z kolonií, které na médiu s laktózou vyrostly tak rychle, že zřejmě příslušnou mutaci musely už dávno mít, a buněk, jež se objevily opožděně, se nijak neliší.
Zajímavá je námitka, že by mutantní buňky mohly růst pomaleji, což by způsobovalo onen optický dojem opožděného objevování. Ve většině sledovaných případů však šlo o návrat k původnímu stavu (uměle poškozený gen byl opraven – bakterie získala zpět svou původní vlastnost), o němž lze jen těžko předpokládat, že se v něm buňka bude rozmnožovat pomaleji. Navíc rychlost růstu buněk z kolonií, které na médiu s laktózou vyrostly tak rychle, že zřejmě příslušnou mutaci musely už dávno mít, a buněk, jež se objevily opožděně, se nijak neliší.
Většina námitek, které odpůrci vznesli, má jednu vadu – nevylučuje usměrněné mutace jako celek, ale zpochybňuje jednotlivé pokusy (a to zdaleka ne všechny). Takového typu byla i námitka uplatněná v případě specifického vystřižení bakteriofága Mu (mutátorového, způsobujícího mutace), který byl podrobně studován.
Podivná historie
Bakteriofág Mu je virus, který je schopen vložit svůj chromozom do bakteriálního chromozomu a za určitých okolností jej zase vystřihnout. Bakterie, které měly jeden gen poškozený vložením bakteriofága Mu, projevovaly nevídanou schopnost fága Mu odstranit, jestliže byl daný gen nezbytný pro další růst a rozmnožování. Pokud ovšem byla bakterie s takto poškozeným genem pěstována za podmínek, kdy daný gen nepotřebovala a i bez něj se normálně dělila, nebylo vystřižení bakteriofága vůbec zjištěno. Jenže odpůrci namítali, že bakteriofág Mu je speciální případ a k jeho vystřižení nedochází vlivem hladovění na médiu, jež bakterie neumí využívat, dokud se nezbaví fága, ale že k odstranění fága stačí jakékoliv hladovění. Neboť hladovějící bakterie zřejmě brzy zemře a tak bakteriofág hledí, aby se rychle vystřihl a spasil alespoň svůj život.Tato námitka zní natolik rozumně, že si hned několik skupin dalo práci a pokusilo se ji různými způsoby prověřit. Ukázalo se, že vystřižení fága Mu je skutečně vyvoláno prostým hladověním – s jedním drobným rozdílem. Je-li vystřižení indukováno jakýmkoliv nespecifickým hladověním, tak k němu také dojde jakýmkoliv způsobem (fág Mu je vložen tak, že k obnovení funkce sledovaného genu může dojít několika způsoby vystřižení). Jestliže však bakterie hladoví na selektivním médiu a jedině vystřižení bakteriofága ji může zachránit, pak je k tomuto spásnému činu použit jen jediný z možných způsobů.
Podobné zjištění bylo učiněno i u obnovení funkce genu kódujícího β-galaktozidázu (v tomto případě neexistovala žádná rozumná zpochybňující námitka). I zde byl gen mutován vložením kratší nepotřebné sekvence DNA, která ve funkční části genu způsobovala posun čtecího rámce o jeden nukleotid, takže genetická informace genu pro β-galaktozidázu byla čtena po špatných trojicích nukleotidů. I zde mohlo k obnově funkce sledovaného genu dojít velkým počtem nejrůznějších řešení. Stačilo jen, aby v konečném součtu ubyl jeden nukleotid. A i zde v případě opožděně vzniklých, usměrněných mutací byl použit jen jediný typ řešení, zatímco u mutací náhodně vzniklých během replikace bylo zjištěno několik řešení bez preference kteréhokoliv z nich.
Usměrněné mutace se tedy odlišují nezávislostí na replikaci a specifičností, která je nečekaně potvrzena i na molekulární úrovni. Přinejmenším u bakterií zřejmě vznikají mutace nejen náhodně, chybou polymerázy, ale i nějakým dalším, dosud neznámým způsobem.
Hypotézy
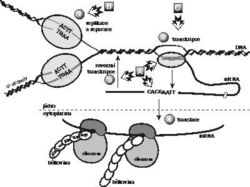
Lidský důvtip je nekonečný, nebo alespoň hodně veliký, takže existuje i velký počet více či méně zajímavých hypotéz o molekulárním mechanizmu vzniku usměrněných mutací. Tyto hypotézy můžeme rozdělit na neolamarckistické a neodarwinistické. Bez ohledu na to, co Lamarck svým lamarckizmem myslel (kdo z molekulárních biologů četl Philosophie Zoologique?), pokládejme za neolamarckistické ty teorie, které podporují představu specifické nenáhodné změny dědičných vlastností organizmu v reakci na vnější prostředí.Jedinou alespoň trochu neolamarckistickou hypotézu vytvořil Cairns se spolupracovníky. Předpokládal, že nejenom replikace, ale i transkripce (přepis z DNA do RNA) může být mutagenní, takže každý organizmus produkuje z jednoho genu různorodou sadu molekul mRNA. Podle poškozeného genu se tvoří mRNA, jejichž překladem vznikají nefunkční bílkoviny. Někdy je ale náhodou přepsána molekula mRNA s takovou „chybou“, že jejím překladem vznikne bílkovina správná a buňka náhle získá ten jediný enzym, který potřebovala k růstu (stačí i jen několik málo molekul). Jakýsi (dosud neznámý) monitorovací systém zaregistruje onu správnou mRNA, zapamatuje si ji a udržuje v dohledu a ve vhodném okamžiku ji reverzní transkriptázou přepíše z RNA do DNA, takže vznikne příslušný správný gen. Buňka mezitím začne růst a replikovat DNA, takže potřebná mutace je natrvalo zaznamenána.
Tato hypotéza zní uchu znalce hodně fantasticky, a hlavně díky ní nabrala debata o usměrněných mutacích obrátky. Její autoři vynaložili hodně energie na její potvrzení – v modelových bakteriích například velmi usilovně hledali reverzní transkriptázu, která se, zřejmě jako památka po různých retrovirech, vyskytuje u ostatních organizmů poměrně pravidelně. V použitém bakteriálním kmeni však nebyla.
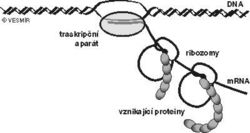
V této souvislosti je docela zajímavé si představit, jak to v bakterii při výrobě bílkovin vypadá (viz obrázek). Molekuly mRNA jsou téměř ihned po zahájení transkripce ověšovány korálky ribozomů, takže nějakou dobu probíhají transkripce a translace současně. Vznikající mRNA i proteiny jsou stále v těsné blízkosti přepisovaného genu a první funkční protein může vzniknout jen zlomek sekundy po ukončení transkripce. Cairnsova hypotéza je skutečně dost fantastická, ale měli bychom připustit, že žádné složité monitorovací a pamatovací zařízení možná ani není potřeba. Třeba by stačilo, kdyby vznikající vhodná mRNA byla dost dlouho spojená s DNA (nebyla by předčasně ukončena transkripce) a kdyby byla zároveň dostatečně dlouho vázána na ribozomy se vznikajícími proteiny (nebyla by ani předčasně ukončena translace).
Zároveň s Cairnsem publikoval svou hypotézu F. Stahl. Ten předpokládal, že i v nerostoucích bakteriích probíhá metabolizmus DNA, chromozom je oprašován, tu a tam je něco vyměněno nebo rekombinováno. Při této činnosti může docházet i ke vzniku mutací, které jsou většinou opraveny, ale poněvadž je už na tom buňka obecně dost špatně, jdou jí ty opravy pomalu. Někdy náhodou dojde ke vhodné mutaci, díky níž se utvoří funkční protein, který umožní buňce růst a dělit se. Obživlá bakterie zahájí tedy rychle replikaci DNA, takže je příslušná mutace fixována (přenesena do nové kopie DNA) dříve, než se stihne opravit.
Stahlova hypotéza fascinuje svou úspornou jednoduchostí. Podobným způsobem se k usměrněným mutacím postavil i F. Ryan, který je vlastně v 50. letech objevil. Pro něj byly zejména důkazem metabolizmu DNA u buněk v klidovém stavu. Ryanovy práce se však větší pozornosti dočkaly až koncem 80. let (dlouho po jeho smrti).
Další představa vychází z toho, že při transkripci, kdy jsou od sebe oddělena vlákna dvoušroubovice DNA (transkribováno je vždy jen jedno vlákno), dochází k mutacím ve zvýšené frekvenci, neboť jednořetězcová DNA je mnohem citlivější k jakémukoli mutagennímu působení než dvouřetězec. Čím více je produkt genu potřeba, tím více je transkribován, tím více je vystaven mutagenním vlivům a tím více mutací (i vhodných) může vznikat.
Navržena byla i hypotéza, v níž hraje hlavní roli amplifikace, tedy zmnožení počtu kopií nějakého genu. Podle ní může buňka rozeznat, která oblast chromozomu je neustále transkribována (tedy produktu je zřejmě nedostatek), a tuto oblast může několikanásobně zmnožit. Podle již výše uvedené úvahy, čím více prostoru (DNA) bude k dispozici, tím více mutací může vznikat a tím větší je pravděpodobnost vzniku vhodné mutace. Amplifikace některých oblastí chromozomu za určitých kritických okolností byly již v několika případech prokázány a zřejmě stály i na počátku vzniku některých genů. V tomto případě by však zřejmě nastaly potíže při odstraňování nadbytečných kopií. Jak buňka určí, podle které ze stovek kopií genu vzniká funkční protein, a jak zajistí, aby právě tato kopie zůstala?
Poslední hypotéza, o které se zmíním, je představa hypermutabilního stavu. To je hypotetický buněčný stav, do nějž se za kritických okolností může dostat alespoň část bakteriální populace. V tomto stavu buňky zvýšeně mutují, opravný systém je přetížen a tak některé z nich mohou získat vhodnou mutaci, díky níž se začnou dělit a vytvoří viditelnou kolonii. Valná většina bakterií si však vyrobí dříve nějakou mutaci letální a zemře. Tato teorie ovšem předpokládá objevení nějakých mutací (alespoň neutrálních) i na jiných místech genomu, což zatím nebylo potvrzeno.
Nejoblíbenější a nejprostudovanější model
Dvě badatelské skupiny zvolily nyní cestu intenzivního prověřování posunové mutace v genu pro β-galaktozidázu u E. coli.Zjistily, že usměrněné mutace vznikají jen tehdy, má-li buňka funkční gen rec-A. Produkt tohoto genu je nezbytný pro rekombinaci a opravu DNA a hraje centrální roli v takzvané reakci SOS, která je spouštěna při poškození DNA bakterie. Frekvence usměrněných mutací je ovlivňována i poškozením některých dalších genů patřících do opravného systému SOS řízeného genem rec-A, takže je nepochybné, že tento systém je pro vznik usměrněných mutací mimořádně důležitý. Kromě toho byla u několika různých mutantů osekvenována oblast DNA, v níž k mutacím dochází, a bylo zjištěno, že u usměrněných mutantů byl použit vždy jen jeden typ řešení, a to delece v mononukleotidových repeticích. Navzdory složitému jménu je princip velmi jednoduchý – gen je nepoužitelný, protože má jeden nukleotid navíc, takže je-li z posloupnosti nukleotidů např. AAAA (to je ta mononukleotidová repetice, tj. krátké opakování jednoho typu nukleotidu, v tomto případě adeninu) ubrán jeden nukleotid, vznikne AAA (tedy o jeden nukleotid méně) a potřebná mutace je hotova. Tento typ mutací byl zjištěn u některých lidských dědičných chorob a nádorů a in vitro vzniká při replikaci sklouznutím DNA-polymerázy po řetězci DNA.
Autoři tedy navrhli následující mechanizmus: v hladovějící buňce vznikají velmi často jednořetězcové i dvouřetězcové zlomy ve vláknu DNA. Tyto zlomy dovedou rozeznat proteiny rec-A opravné dráhy a dovedou i zajistit, aby je DNA-polymeráza začala opravovat. Jenže poněvadž v té době už v buňce nefunguje nic dobře, tak chybuje i polymeráza, a výsledkem je právě sklouznutí na mononukleotidových repeticích.
Tohle vysvětlení zní docela pěkně a zajímavě, má však dva malé háčky. Jednak platí (pokud vůbec) zřejmě jen pro tento jediný typ mutace v tomto jediném případě, a jednak vůbec, ale vůbec nevysvětluje, jakým způsobem může být zajištěna specifita příslušné opravy. Přitom právě předpoklad, že by buňka dokázala přesně rozeznat, který gen má poškozený, kvůli kterému genu nemůže v daném prostředí růst a dělit se, byl na objevu usměrněných mutací nejvíce provokující.
Zajištění specifity
U našeho oblíbeného modelu (stále posunová mutace v genu lac-Z) byla specifita potvrzena dvěma způsoby. Za prvé bylo zjištěno, že v nepřítomnosti laktózy (tedy pouhým nespecifickým hladověním) usměrněné mutace vyvolat nelze. Za druhé, při kultivaci buněk na médiu s laktózou (za podmínek neselektivních vzhledem k jakékoliv jiné vlastnosti) nebyla pozorována zvýšená frekvence mutací v druhém sledovaném genu. Tento typ pokusů staví na tom, že bakterie na daném médiu vyrostou nebo nevyrostou, protože mají nebo nemají nějakou vlastnost. O tom, jak zmíněnou vlastnost asi získaly, vypovídají jen určité indicie, v tomto případě statistikého charakteru, a také skutečnost, že se za těchto podmínek bakterie už zřejmě nedělí (tj. nereplikují DNA), takže ty mutace prostě musí získávat nějak jinak než chybou DNA polymerázy. Poněkud přehlížena ovšem zůstávala jedna zajímavá skutečnost, že totiž studovaný poškozený gen byl umístěn na F-plazmidu (malá cytoplazmatická kruhová molekula DNA) a nikoli na bakteriálním chromozomu. Vlastní chromozomový gen pro β-galaktozidázu byl v tomto případě zcela odstraněn. Jenže u plazmidů může být všechno jinak než u chromozomů. Zejména u plazmidu F, který svým hostitelským bakteriím udílí schopnost konjugovat (tj. přenášet genetickou informaci, v tomto případě plazmid F) s jinými bakteriemi, které plazmid F nemají. Dlouho se předpokládalo, že bakterie s F-plazmidem nemohou žádný další F-plazmid přijmout. Teprve nedávno byly publikovány výsledky, podle nichž bakteriální buňky s F-plazmidem ztrácejí při hladovění imunitu vůči přijímání dalších F-plazmidů. A to je přesně ta situace, ke které dochází při sledování usměrněných mutací v genu lac-Z. Bakterie, kterých je na misce obrovské množství v nejtěsnějším sousedství, ztrácejí vlivem hladovění veškeré zábrany a začnou konjugovat navzdory tomu, že už nějaký ten F-plazmid mají. Konjugace je ovšem spojena s replikací – F-plazmid dárcovské buňky je replikován a do příjímající buňky vstupuje jedna kopie. Jak už víme, při replikaci vznikají náhodné chyby, které mohou a nemusí být opraveny (ale hladovějící buňka je unavena a opravy jsou neefektivní – viz Stahlovu hypotézu). Některé z těchto chyb dají vzniknout funkčnímu genu pro β-galaktozidázu, buňka se začne dělit – a nadšený mikrobiolog zpozoruje kolonii objevivší se s výrazným zpožděním. Specifita usměrněné mutace je dána prostě tím, že na F-plazmidu žádný jiný sledovatelný gen není.
Jenže u plazmidů může být všechno jinak než u chromozomů. Zejména u plazmidu F, který svým hostitelským bakteriím udílí schopnost konjugovat (tj. přenášet genetickou informaci, v tomto případě plazmid F) s jinými bakteriemi, které plazmid F nemají. Dlouho se předpokládalo, že bakterie s F-plazmidem nemohou žádný další F-plazmid přijmout. Teprve nedávno byly publikovány výsledky, podle nichž bakteriální buňky s F-plazmidem ztrácejí při hladovění imunitu vůči přijímání dalších F-plazmidů. A to je přesně ta situace, ke které dochází při sledování usměrněných mutací v genu lac-Z. Bakterie, kterých je na misce obrovské množství v nejtěsnějším sousedství, ztrácejí vlivem hladovění veškeré zábrany a začnou konjugovat navzdory tomu, že už nějaký ten F-plazmid mají. Konjugace je ovšem spojena s replikací – F-plazmid dárcovské buňky je replikován a do příjímající buňky vstupuje jedna kopie. Jak už víme, při replikaci vznikají náhodné chyby, které mohou a nemusí být opraveny (ale hladovějící buňka je unavena a opravy jsou neefektivní – viz Stahlovu hypotézu). Některé z těchto chyb dají vzniknout funkčnímu genu pro β-galaktozidázu, buňka se začne dělit – a nadšený mikrobiolog zpozoruje kolonii objevivší se s výrazným zpožděním. Specifita usměrněné mutace je dána prostě tím, že na F-plazmidu žádný jiný sledovatelný gen není.
Tak, a tohle by mohl být konec pohádky o usměrněných mutacích. Jenže, popravdě řečeno, není – jenom evoluční biologové si mohou oddechnout, protože učebnice se přepisovat nebudou (většina z nich si to stejně myslela od začátku). Autoři konjugačních pokusů totiž zcela zahodili všechny starší (mnohdy i vlastní) výsledky. Jenže by zřejmě stálo za to objasnit, proč jsou při tomto způsobu vzniku mutací zapotřebí geny systému recA nebo proč vzniká jenom jeden typ mutace, když při konjugaci probíhá konvenční replikace. A navíc, další dobře otestované modelové systémy, nejenom u Escherichia coli, ale i u kvasinky Saccharomyces cerevisie, vysvětlení konjugací nedovolují už proto, že sledované geny byly v těchto případech na chromozomech.
Nový pohled
Ať už to dopadne s usměrněnými mutacemi jakkoliv, je nepochybné, že přinutily molekulární (i jiné) biology zaměřit se na mikroorganizmy i z jiného hlediska.Bakterie (a asi i eukaryotické mikroorganizmy) totiž disponují netušeným arzenálem možností, jak zacházet samy se sebou i se svým genomem. Na vnější podmínky jsou zřejmě schopny reagovat překvapivě pružně (i když možná ne zcela specificky) buď aktivací dosud nepoužívaných genů (tzv. kryptických), nebo rozvolněním ochranných bariér intracelulárního prostředí i genomu či spuštěním nových drah, v nichž může hrát výraznou roli právě opravný systém (viz rec-A). Zvláště v poslední době je na modelu jednobuněčné kvasinky Saccharomyces cerevisiae odhalována košatost opravných systémů u eukaryotických organizmů. Jaké mohou být možnosti těchto drah, může naznačit i těsná provázanost bílkovin opravných systémů s enzymatickými aparáty replikace i transkripce. Dalším kamínkem do mozaiky je zjištění, že některé dědičné choroby i zhoubné nádory souvisí právě s poškozením opravného systému. A zpátky v kruhu k usměrněným mutacím – přinejmenším na některé typy rakovinných buněk se můžeme dívat jako na buňky, které prostě získaly v klidovém stavu a bez replikace DNA mutaci, která jim umožňuje dělit se i v nepřítomnosti nějakého pro ostatní buňky zcela nezbytného vnějšího faktoru.
Studium usměrněných mutací zároveň upozornilo na další velkou neznámou – stacionární stav buněk. Pro mnohé molekulární biology je totiž bakterie hlavně výborný model, který se krásně dělí každých 20 minut a všechno se na něm dělá hodně snadno a rychle. Jakžtakž chápeme, co se v bakterii odehrává v exponenciální fázi růstu (hlavně pěkné grafy a vzorce o tom umíme), ale na druhou stranu, jak často se asi bakterie v přírodě dělí exponenciálně? Vždyť i v tak relativně bohatém „médiu“, jako je půda, se odhaduje generační doba bakterií nejméně na 24 hodin. A v mořské vodě se bakterie dělí zřejmě jen jednou za několik desítek nebo i stovek dní.
Jenže ono opravdu není jednoduché studovat nerostoucí buňky. Vždyť i při sledování usměrněných mutací nakonec zase pracujeme právě s těmi buňkami, které vyhrály, a tudíž vyrostly. A o těch ostatních statisících padlých se nikdy nedozvíme, zda zhynuly celkovým vyčerpáním, nebo neúspěšným hypermutováním vlastního genomu.
centrální dogma
- Dvojřetězcová šroubovice DNA je během replikace rozvinuta do samostatných řetězců, k nimž je po částech přiřazováno nové vlákno. Přiřazování probíhá na principu komplementarity: 4 stavební kameny DNA (báze, jejichž prostřednictvím jsou komplementární vlákna spojena) tvoří pouze 2 typy párů – adenin (A) se páruje jen s tyminem (T) a cytozin (C) jen s guaninem (G). Replikační enzymy nepracují bezchybně, občas například zařadí chybnou bázi, takže párování není dodrženo a změní se pořadí bází. Nové vlákno DNA je sice hned po replikaci kontrolováno, ale ani tato výstupní kontrola není dokonalá. Chyby, které opravnému systému uniknou, jsou příští replikací fixovány a přenášeny do další generace. Frekvence mutací nemusí být na všech místech DNA stejná, neboť některá uspořádání bází jsou náchylnější k záměnám. Průměrně však dochází k jedné chybě v 108 správně zařazených bází.
- DNA slouží jako vzor k vytvoření mRNA při transkripci. Molekula mRNA, která vzniká také na principu komplementarity, zprostředkuje převod dědičné informace z DNA na bílkoviny. I během transkripce může docházet k nesprávnému zařazení báze. Tyto chyby však nejsou přenášeny do dalších generací.
- U několika skupin virů slouží jako nositelka dědičné informace molekula RNA. Retroviry ji využívají s malou oklikou – RNA je přepsána reverzní transkriptázou na dvouřetězcovou DNA a včleněna do hostitelského genomu. Tato cizorodá DNA je normálně transkribována a translatována hostitelskými enzymy.
- Během translace je informace překódována z abecedy bází do abecedy aminokyselin, které tvoří bílkoviny. Každé „slovo“, sestavené ze tří bází (např. CCG), je přeloženo jednou aminokyselinou (v tomto případě prolinem). Pořadí bází je tedy zcela klíčové. Dojde-li k bodové mutaci (záměně jedné báze za jinou), může být změněn smysl trojice, a tedy i typ aminokyseliny, dojde-li k posunové mutaci (mRNA je čtena po špatných trojicích nukleotidů), vzniká na ribozomu zcela jiný protein.
Úrovně, na nichž vznikají usměrněné mutace:
A. podle Cairnsovy hypotézy
B. podle Stahlovy hypotézy (zahrnuje i opravné systémy nesvázané s replikací)
C. podle hypotézy mutagenní transkripce