Klonování savčího embrya
Zpráva o jehněti narozeném po přenosu jádra somatické buňky do oocytu zbaveného jádra, kterou loni publikoval Ian Wilmut se spolupracovníky (Nature 385, 810, 1997), vzbudila pozornost jak v laických, tak v odborných kruzích. Veřejnost se nezajímala ani tak o podstatu problému, jako spíš o následky při použití podobných technik pro lidské embryo. Z odborníků, kteří studium regulace embryonálního vývoje považují za svou celoživotní náplň, do té doby nikdo nepředpokládal, že by z diferencované somatické buňky sloužící jako zdroj jádra mohl vzniknout nový jedinec identický s dárcem, z něhož byla buňka získána. Z mnoha dřívějších experimentů na obojživelnících a později i savcích bylo zřejmé, že schopnost zopakovat od samého počátku všechny pochody podmiňující vývoj až po jeho ukončení mají za určitých podmínek pouze embryonální buňky a jejich jádra, u nichž došlo jen k částečné diferenciaci. Ta zahrnuje řadu složitých, dosud málo známých pochodů, jejichž výsledkem je vznik buněk s vymezenou funkcí již v období před spojením embrya s děložní sliznicí matky (implantací). U řady živočišných druhů embrya krátce po oplození nesyntetizují novou ribonukleovou kyselinu a v počátcích svého vývoje používají tu, která se nacházela v cytoplazmě oocytu. Transkripce (syntéza RNA) se stává nezbytným požadavkem pro další vývoj až teprve po určitém počtu buněčných dělení a má druhově specifický charakter. Ze savců je aktivace genů v embryonálním vývoji velmi dobře prostudována u laboratorní myši. Skládá se ze dvou kroků, první zahrnuje slabou transkripční aktivitu již v pozdním jednobuněčném stadiu, druhý krok pak hlavní počátek transkripční aktivity v pozdním dvoubuněčném stadiu. Tento krok má za následek kompletní změnu syntetizovaných proteinů (obrázek). U ostatních druhů savců transkripce embryonálního genomu začíná až později v embryonálním vývoji, po dvou až třech buněčných děleních. Např. u skotu hlavní transkripční aktivita začíná v pozdním, osmibuněčném stadiu. Tento mezidruhový rozdíl má zřejmě za následek rozdílnou obtížnost klonování embrya myši a embrya hospodářských zvířat. O definování aktivace embryonálního genomu u hospodářských zvířat se řadou originálních publikací zasloužil V. Kopečný, nyní působící v Ústavu molekulární genetiky v Krči.
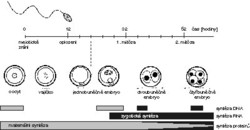 Vývoj savčího embrya, charakteristický postupným dělením, se podařilo za různých experimentálních podmínek popsat dost přesně. Shromážděné poznatky, včetně předchozích pozorování o přenosu jader u obojživelníků, chytře využil S. M. Willadsen a již v roce 1986 navrhl postup klonování savčího embrya. Dokázal tehdy, že každá z 8–16 buněk (blastomer) izolovaná z 3–4denního embrya ovce má schopnost se dále dělit po splynutí s oocytem, ze kterého byla odstraněna chromozomová výbava (genetický materiál). V ideálním případě tak lze z každého rozděleného embrya rekonstruovat 8–16 dalších embryí, která mohou po přenosu do vhodného příjemce pokračovat ve vývoji. Navíc blastomery rekonstruovaného embrya mohou znovu sloužit jako dárci jádra. Svými výsledky Willadsen rozšířil předchozí poznatky dokazující, že vývoj izolovaných blastomer (bez splynutí s cytoplastem oocytu) pokračuje u ovce více či méně úspěšně jen v případech, kdy výchozí stadium nepřekročilo 2–4 buňky.
Vývoj savčího embrya, charakteristický postupným dělením, se podařilo za různých experimentálních podmínek popsat dost přesně. Shromážděné poznatky, včetně předchozích pozorování o přenosu jader u obojživelníků, chytře využil S. M. Willadsen a již v roce 1986 navrhl postup klonování savčího embrya. Dokázal tehdy, že každá z 8–16 buněk (blastomer) izolovaná z 3–4denního embrya ovce má schopnost se dále dělit po splynutí s oocytem, ze kterého byla odstraněna chromozomová výbava (genetický materiál). V ideálním případě tak lze z každého rozděleného embrya rekonstruovat 8–16 dalších embryí, která mohou po přenosu do vhodného příjemce pokračovat ve vývoji. Navíc blastomery rekonstruovaného embrya mohou znovu sloužit jako dárci jádra. Svými výsledky Willadsen rozšířil předchozí poznatky dokazující, že vývoj izolovaných blastomer (bez splynutí s cytoplastem oocytu) pokračuje u ovce více či méně úspěšně jen v případech, kdy výchozí stadium nepřekročilo 2–4 buňky.
Pozornost se soustředila nejen na techniky spojení embryonální buňky s cytoplastem, ale hlavně na problém, nakolik je možné již částečně diferencované jádro použít ke klonování. Vedle ovce se takto podařilo rozmnožit i skot, králíka, prase, a dokonce opici. Postupně se zvyšovalo stáří jader dárcovských buněk, a tedy i stupeň jejich diferenciace. Zároveň s novými výsledky bylo třeba zjistit, jak reaguje jádro již částečně diferencované buňky na prostředí představované cytoplazmou oocytu, zda se již zahájená diferenciace pouze zastavuje, nebo zda se i diferencované buňky opět vrátí do původního stavu. V komerčních a chovatelských kruzích převažoval optimizmus posilovaný představou o možné produkci neomezeného počtu identických jedinců s žádanými užitkovými vlastnostmi. Nepřekvapil ani bezprostřední vznik společností, které za výhodných finančních podmínek získávaly odborníky pro urychlené naplnění svých záměrů.
Postupně však původní optimizmus mizel tak, jak se objevovaly problémy, které se v počátcích jevily jako okrajové. Zklamání přinášela zejména malá efektivita použitých postupů, končící ziskem jen velmi nízkého podílu embryí vhodných k přenosu a mizivým počtem narozených potomků. Metoda klonování se vrátila znovu do laboratoří na stůl těm, kteří již v počátcích nabádali k opatrnosti. Jejich početné experimenty vyústily v rozdělení možných příčin selhání do tří okruhů:
- zda cytoplast pocházející z ovulovaného oocytu a oocytu zrajícího in vitro podporuje shodně reprogramování jádra a následný vývoj rekonstruovaného embrya,
- jakou úlohu má při reprogramování stupeň diferenciace jádra dárcovské buňky a stadium buněčného cyklu,
- jak minimalizovat destrukční vlivy použitých mikromanipulačních zásahů na úroveň slučitelnou s dalším vývojem.
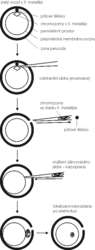 Zopakujme: tvorba rekonstruovaného embrya spočívá ve splynutí embryonální buňky s cytoplastem oocytu. Za zdroj cytoplastu slouží převážně oocyt, který pokročil ve svém zrání do metafáze II (M II). V té době se polovina chromozomové výbavy nachází v pólovém tělísku vyloučeném v perivitelinním prostoru (z ř. peri – kolem, vitellus – žloutek) a druhá polovina je uspořádána v M II (obrázek). Oocyt v takovém stadiu zrání je možné získat buď výplachem vejcovodu krátce po ovulaci, nebo z vaječníků komerčně poražených zvířat. Výplach vejcovodu se pro svoji časovou a ekonomickou náročnost využívá spíše výjimečně, a tak jako obvyklý zdroj cytoplastu slouží snadno dostupné oocyty izolované z vhodných folikulů. V době izolace má jejich jádro typickou strukturu, charakteristickou jemně rozptýleným chromatinem a zřetelnou jadernou membránou. V definovaném kultivačním médiu tyto oocyty dozrávají na úroveň oocytů ovulovaných a připravených k oplození, tj. do stadia M II. Vhodnou pipetkou lze obě sady chromozomů pod stereomikroskopem odsát, aniž se vážněji poškodí vnější obal oocytu či naruší cytoplazma. Průměr oocytu většiny savců se pohybuje okolo 0,1 mm, a proto jen opakovaná zkušenost a vhodně zvolená kapilára vedou k získání cytoplastu bez zbytků chromozomů (obrázek). Není proto překvapující, že se objevily snahy získat funkční cytoplast tak, že se jádro zlikviduje jinými přístupy, včetně fyzikálních metod (UV-záření, laser). Destrukční působení na buněčné struktury však jejich uplatnění v technologii klonování prozatím vyloučilo.
Zopakujme: tvorba rekonstruovaného embrya spočívá ve splynutí embryonální buňky s cytoplastem oocytu. Za zdroj cytoplastu slouží převážně oocyt, který pokročil ve svém zrání do metafáze II (M II). V té době se polovina chromozomové výbavy nachází v pólovém tělísku vyloučeném v perivitelinním prostoru (z ř. peri – kolem, vitellus – žloutek) a druhá polovina je uspořádána v M II (obrázek). Oocyt v takovém stadiu zrání je možné získat buď výplachem vejcovodu krátce po ovulaci, nebo z vaječníků komerčně poražených zvířat. Výplach vejcovodu se pro svoji časovou a ekonomickou náročnost využívá spíše výjimečně, a tak jako obvyklý zdroj cytoplastu slouží snadno dostupné oocyty izolované z vhodných folikulů. V době izolace má jejich jádro typickou strukturu, charakteristickou jemně rozptýleným chromatinem a zřetelnou jadernou membránou. V definovaném kultivačním médiu tyto oocyty dozrávají na úroveň oocytů ovulovaných a připravených k oplození, tj. do stadia M II. Vhodnou pipetkou lze obě sady chromozomů pod stereomikroskopem odsát, aniž se vážněji poškodí vnější obal oocytu či naruší cytoplazma. Průměr oocytu většiny savců se pohybuje okolo 0,1 mm, a proto jen opakovaná zkušenost a vhodně zvolená kapilára vedou k získání cytoplastu bez zbytků chromozomů (obrázek). Není proto překvapující, že se objevily snahy získat funkční cytoplast tak, že se jádro zlikviduje jinými přístupy, včetně fyzikálních metod (UV-záření, laser). Destrukční působení na buněčné struktury však jejich uplatnění v technologii klonování prozatím vyloučilo.
Při hodnocení úlohy cytoplastu nelze opomenout jednu z jeho biologických aktivit, nazvanou maturation promoting factor (MPF). Po splynutí embryonální buňky s cytoplastem je její jádro vystaveno zcela novému prostředí. To bezprostředně přejímá řídící roli a rozhoduje o dalších pochodech, a to zcela bez ohledu na možný další vývoj rekonstruovaného embrya. Vzhledem k libovolnému stadiu buněčného cyklu dárcovského jádra může MPF vyvolat neprogramovanou syntézu DNA, chybnou segregaci a chromozomální anomálie, které dříve či později zastaví vývoj. Vztah mezi cytoplazmou a jádrem při tvorbě klonovaných embryí zatím nedovedeme cíleně ovlivnit, a proto zůstává efektivita klonování u savců na nízké úrovni.
Úloha dárcovského jádra a jeho vývojová schopnost
Stejně významné postavení v technologii klonování zaujímá jádro dárcovské buňky. Pohled na jeho úlohu významně ovlivnily experimenty na obojživelnících téměř před 50 lety, které jednoznačně prokázaly rozdíly v jádrech izolovaných z raných a pokročilejších vývojových stadií při regulaci vývoje po přenosu do cytoplazmy oocytů zbavených jádra. Na základě těchto výsledků byl přijat názor, že důsledkem diferenciace embryonálních jader je ztráta jejich totipotence. Tím slovem se označuje schopnost zajistit po zahájených děleních následný vznik různých typů specializovaných buněk a orgánů, které by zajišťovaly všechny funkce potřebné pro existenci normálního dospělého jedince. Proto nepřekvapuje, že při počátečních snahách o klonování savců sloužily za zdroj jádra blastomery izolované z 8–16buněčného 3–4 dny starého embrya ovce. Naše pozorování r. 1991 prokázala bezprostřední působení cytoplastu na přenesené jádro, které se projevilo mimo jiné změnami v syntéze RNA. Jádra osmibuněčného stadia, která byla použita ke klonování, již syntetizují novou RNA. Po přenosu do prostředí cytoplastu se syntéza RNA zastaví (obrázek) a zahájena je opět u klonovaného embrya skotu až na stadiu osmi buněk (obrázek). Postupně a opakovaně byly získány důkazy o zachování vývojové schopnosti rekonstruovaných embryí, dokládané stále častěji narozením normálních jedinců. Tyto výsledky také naznačovaly, že osmibuněčné nebo šestnáctibuněčné embryo nemusí být hranicí, kterou by bylo třeba při úvahách o stáří jádra přesně respektovat. A tak se podařilo jednoznačně prokázat, že i částečně diferencované buňky izolované z početné populace embryoblastu mají schopnost diferenciaci opět zrušit a chovat se shodně jako jejich partneři z osmi buněk – tedy po splynutí a přenosu vývoj ukončit narozením potomstva. Výjimku tvoří buňky trofoblastu (dávají základ formování plodových obalů), které jsou jako dárci jader zcela neefektivní. Výčet by nebyl úplný bez zmínky o postavení myši jako vhodného modelu pro studium základních zákonitostí embryonálního vývoje. Ta zaujímá (a zřejmě i někteří další hlodavci) výjimečné postavení. Dlouho platilo, že její embryonální buňky záhy ztrácejí totipotenci a již po dvou děleních (ve stadiu čtyř blastomer) nejsou schopny zajistit vývoj nového jedince. Tato pozorování zřejmě souvisejí se skutečností, že se embryonální vývoj myši liší například od embryonálního vývoje hospodářských zvířat. Teprve loni vnesli Y. Tsunoda a Y. Kato do dosud platné představy určité pochybnosti, když se jim podařilo klonovat myš z buňky izolované z moruly.Nové perspektivy pro technologii klonování otevřela r. 1994 sdělení M. Simsové a N. L. Firsta a r. 1996 K. H. S. Campbella se spolupracovníky o možném ustavení linií diferencovaných buněk izolovaných z embryoblastu, o jejich kultivaci ve vhodném médiu a vícekrát opakované pasáži (přenesení části populace buněk do čerstvého média). K významu prací přispěl důkaz schopnosti těchto buněk zrušit po splynutí s cytoplastem oocytu diferenciaci a po přenosu podporovat vývoj až do narození potomků identických s dárcem původních buněk. Navíc opakovaná pasáž neměla negativní vliv na vývojovou schopnost buněčné populace. To znamená, že při klonování není zapotřebí používat nediferencované embryonální kmenové buňky – za vhodných podmínek dá vznik novému jedinci i buňka diferencovaná. Dosud se s uplatněním tohoto přístupu narodily klonované ovce a skot v USA, Francii a na Novém Zélandu. Stále častěji se objevují představy o cílených zásazích do genové výbavy dárcovských buněk. A právě tento typ buněk by mohl být dostupným materiálem pro podobné manipulace. Uvažuje se tak zcela konkrétně o vytváření populací zvířat poskytujících potravu s příznivější skladbou pro lidskou výživu či vhodnějšími parametry pro průmyslové zpracování. Specifickou podporu u farmaceutického průmyslu nacházejí programy zaměřené na vnášení genů odpovědných za produkci biologicky aktivních látek užívaných v medicíně a získávaných dosud složitými laboratorními postupy. Není pochyb o tom, že se hledají cesty, i když se o nich příliš hlasitě nemluví, jak tyto změny co nejrychleji uskutečnit.
V embryologii savců se hledají a rozvíjejí i další slibné techniky. Jednu z nich představuje metodika izolace a kultivace embryonálních kmenových buněk. Jejich charakteristika a vlastnosti by si zasloužily samostatný článek. Lze je označit jako specifickou kategorii embryonálních buněk, které se v prostředí in vitro dělí v nediferencovaném stavu a po přenosu do blastocysty mají schopnost podílet se na tvorbě všech orgánů, včetně gonad. Tyto poznatky však platí dosud pouze pro myš a všechny snahy o jejich izolaci a kultivaci v nediferencovaném stavu skončily u hospodářskych zvířat neúspěšně.
 Zatímco všichni předchozí narození klonovaní jedinci, ať králíci, jehňata, telata či opice, pocházejí z rekonstruovaných embryí vytvářených splynutím oocytů s embryonální buňkou, jehně Dolly vzniklo z jádra buňky izolované z mléčné žlázy šestileté ovce. (Zjednodušeně je postup naznačen na obrázku v tabulce na s. 570–571.) To byla také příčina nebývalého překvapení a až nečekaného zájmu. Skutečnost, že se nepodařilo přesně stanovit typ buňky, ze které Dolly vznikla, vedla k námitkám o možném nahodilém úspěchu. Zcela nedávno však bylo opakovaně doloženo, že nejen jádra buněk mléčné žlázy, ale i fetální fibroblasty, kožní buňky, či některé kategorie folikulárních buněk mají schopnost při aplikaci podobných postupů zajistit vývoj až do narození.
Zatímco všichni předchozí narození klonovaní jedinci, ať králíci, jehňata, telata či opice, pocházejí z rekonstruovaných embryí vytvářených splynutím oocytů s embryonální buňkou, jehně Dolly vzniklo z jádra buňky izolované z mléčné žlázy šestileté ovce. (Zjednodušeně je postup naznačen na obrázku v tabulce na s. 570–571.) To byla také příčina nebývalého překvapení a až nečekaného zájmu. Skutečnost, že se nepodařilo přesně stanovit typ buňky, ze které Dolly vznikla, vedla k námitkám o možném nahodilém úspěchu. Zcela nedávno však bylo opakovaně doloženo, že nejen jádra buněk mléčné žlázy, ale i fetální fibroblasty, kožní buňky, či některé kategorie folikulárních buněk mají schopnost při aplikaci podobných postupů zajistit vývoj až do narození.
Významní světoví embryologové a buněční biologové si kladou otázku, jak je možné, že jádro, které je schopno vykonávat již jen velmi omezený rozsah činností, dokáže znovu aktivovat všechny geny potřebné pro řízení vývoje a diferenciaci stejně efektivně jako buňka z embrya v počátcích dělení. Všichni se shodují v názoru, že je nutné, aby jádro somatické buňky po vystavení cytoplazmě oocytu pozbylo diferenciace, ovšem dosud nikdo není schopen vysvětlit, jaké pochody se pod tím skrývají. Je to tím obtížnější, že dosud jsou jen okrajově objasněny mechanizmy odpovědné za regulaci normálního vývoje jak ve stadiu před implantací, tak těsně po ní. Zůstává tak volný prostor pro více či méně podložené spekulace. Ian Wilmut spatřuje důležitý faktor úspěchu v použitém schématu kultivace dárcovských buněk včetně snížení obsahu séra v médiu z původních 10 % postupně až na 0,5 %. Buňky v takto „ochuzeném“ prostředí zastavují dělení a jejich jádra přecházejí do stadia zvaného fáze G0. Wilmut se domnívá, že za nastalé situace se uvolňuje vazba proteinů na DNA a ta se chová jako neaktivní DNA spermie či neoplozeného oocytu.
U většiny savců zajišťují prvá tři dělení po oplození i po fúzi jádra s oocytem proteiny a mRNA obsažené v cytoplazmě oocytu. Teprve později, ve stadiu 8 buněk, se aktivuje embryonální genom a přejímá odpovědnost za regulaci vývoje. R. Schulz z Pensylvánské univerzity se domnívá, že to jsou právě tři cykly, které dovolují u ovce a skotu zrušení diferenciace, aniž dojde k poruchám v dělení rekonstruovaného embrya. U myši nastupuje regulace vývoje embryonálními geny velmi časně, v dvoubuněčném stadiu, a na reprogramaci jádra tak zbývá necelý jeden buněčný cyklus. Podle některých embryologů je to příliš krátká doba na to, aby se DNA v dárcovském jádře zbavila proteinů a navázala nové, přítomné v cytoplazmě oocytu zbaveného jádra. To bylo zřejmě důvodem, proč byla nejprve úspěšně klonována hospodářská zvířata (ovce, skot), a teprve nyní i laboratorní myš. Lidské embryo by podle dnešních znalostí a při platnosti této hypotézy mělo na reprogramaci o 1 buněčný cyklus méně než ovce a o dva víc než myš. Vzhledem k nízké efektivitě používaných postupů klonování, vycházejících převážně z empirie, se nezdá být zneužití v humánní medicíně aktuální. Tento názor podporují i druhově specifické rozdíly, jejichž definování vyžaduje množství experimentů a lidské embryo není pro tyto záměry vhodným objektem. Navíc legislativa bude svými nástroji podobné pokusy jistě účinně omezovat. Nejen na stránkách Nature nyní probíhají obsáhlé výměny názorů na možné následky, které by klonování u lidí přineslo. V USA se zase snaží předložit návrh zákona, který by experimenty vedoucí ke klonování lidských embryí jednoznačně vyloučil a porušení zákona by postihoval. Tyto diskuse vycházejí spíš z etických a právních pohledů bez přihlédnutí k skutečnému stavu problematiky.
Všichni, kteří na klonování pracují nebo se o něj hlouběji zajímají, vědí, jaké poznatky je ještě třeba získat, aby výsledky nenesly známky nahodilosti. Rekonstruování se skládá z řady úkonů a chyba na libovolné úrovni vede k zániku embrya. Současný stav jen potvrzuje, že o následcích vyvolaných uměle utvořenými vztahy mezi buňkami víme jen velmi málo. Již první dělení rekonstruovaného embrya je poznamenáno značnou redukcí a k vývoji do moruly či blastuly, tj. stadií, která orientačně slouží jako indikátor životaschopnosti embrya, dochází za optimálních podmínek ve 30 % případů. Z nich se po přenosu vybraným příjemcům rodí obvykle ne víc než 5 % mláďat. Aby se narodilo jediné jehně Dolly, rekonstruoval I. Wilmut se spolupracovníky 277 embryí. Z nich bylo po 6denní kultivaci podle morfologických kritérií 29 vhodných pro přenos, ale pouze 1 skončilo narozením normálního jedince.
Ani při použití embryonálních buněk nebývají výsledky významně lepší a vyznačují se značnou variabilitou, jak mezi jednotlivými laboratořemi, tak v rámci téhož pracoviště. To přináší jen další důkaz o nízké úrovni poznání vhodných kritérií pro výběr a přípravu oocytu zbaveného jádra, výběr dárcovského jádra a zřejmě i o úrovni techniky a šetrnosti mikromanipulačních zásahů. Nelze ani vyloučit sníženou toleranci rekonstruovaných embryí k prostředí, ve kterém se kultivují během několika prvních dní. Také předložený důkaz o reprogramování diferencované somatické buňky nelze dosud zobecnit. Neví se zatím nic o tom, zda se buňky některých dalších orgánů budou chovat za srovnatelných podmínek shodně, či zda si vyžádají odlišné ošetření a budou-li vůbec použitelné. Otázek zbývá dost a budou se objevovat stále nové. Nedávné období mnoho napovědělo, ale jen málo vysvětlilo. Čeká se na použití náročných metod, které přispějí k pochopení základních dějů na makromolekulární úrovni a umožní cílené zásahy do vývoje rekonstruovaných embryí. Nedávné výsledky zájem o klonování savců podpořily a spolu s projekty zaměřenými na studium základních zákonitostí embryonálního vývoje za různých experimentálních podmínek se objevují i programy sledující již převážně praktické cíle.
Ke stažení
 DATA A SOUVISLOSTI - Klonování [2 MB]
DATA A SOUVISLOSTI - Klonování [2 MB] Článek ve formátu PDF [307,85 kB]
Článek ve formátu PDF [307,85 kB]