Kmenové buňky pro obnovu mozku
V posledních letech obrovsky vzrůstá zájem o možnost léčit některé závažné nemoci nebo poranění pomocí kmenových buněk. Jejich „zázračné“ vlastnosti budí pozornost široké veřejnosti. O jejich využití se bouřlivě dohadují badatelé, lékaři, etikové i právníci. Zvedla se též vlna šarlatánských spekulací. Obchodníci si začínají brousit zuby na obrovský zisk. Polemiky o budoucnosti kmenových buněk dnes zasahují do volebních kampaní politiků, a tedy i do budoucnosti národů. Někteří vidí v izolaci kmenových buněk z lidských embryí znesvěcení mravních zákonů, jiní se obávají, že by se použití těchto buněk v lékařství mohlo vymknout kontrole a způsobit pacientovi větší škodu než užitek. Navzdory bouřlivým debatám však mnozí vzhlížejí ke kmenovým buňkám s úpěnlivou nadějí v záchranu a úlevu ve strasti.
Zdroj všech tkání
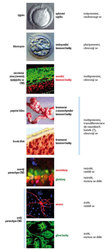 Kmenové buňky jsou čile se dělící populací, která je nutná pro tvorbu nejrůznějších tkání (obr. 1). Brzy po oplození vajíčka vznikají embryonální kmenové buňky. Zpočátku je jejich počet vzhledem k množství nedělících se (postmitotických) diferencovaných buněk vysoký a jejich schopnost specializovat se do rozličných buněčných typů (nervových, kožních, svalových) je téměř neomezená (pluripotentní). Během vytváření orgánů však postupně počet kmenových buněk i jejich přizpůsobivost klesá. Vznikají buněčné typy, které jsou strukturálně a funkčně diferencované (multipotentní). Tkáně pak vytvářejí centra kmenových buněk, a to buď přechodná (mozek), nebo trvalá (kůže, střevní epitel, krev). K multipotentním typům patří například kmenové buňky kostní dřeně, které jsou nutné pro tvorbu bílých a červených krvinek, nebo nervové kmenové buňky, z nichž vznikají buňky nervového systému (neurony a gliové buňky).
Kmenové buňky jsou čile se dělící populací, která je nutná pro tvorbu nejrůznějších tkání (obr. 1). Brzy po oplození vajíčka vznikají embryonální kmenové buňky. Zpočátku je jejich počet vzhledem k množství nedělících se (postmitotických) diferencovaných buněk vysoký a jejich schopnost specializovat se do rozličných buněčných typů (nervových, kožních, svalových) je téměř neomezená (pluripotentní). Během vytváření orgánů však postupně počet kmenových buněk i jejich přizpůsobivost klesá. Vznikají buněčné typy, které jsou strukturálně a funkčně diferencované (multipotentní). Tkáně pak vytvářejí centra kmenových buněk, a to buď přechodná (mozek), nebo trvalá (kůže, střevní epitel, krev). K multipotentním typům patří například kmenové buňky kostní dřeně, které jsou nutné pro tvorbu bílých a červených krvinek, nebo nervové kmenové buňky, z nichž vznikají buňky nervového systému (neurony a gliové buňky).
V dospělosti je četnost kmenových buněk pro daný orgán či tkáň charakteristická. V některých tkáních (v kůži nebo ve střevním epitelu) jsou hojné, stále se během života dělí a jsou přirozeným zdrojem buněk nezbytných pro regeneraci poraněné tkáně. V jiných částech těla, jako je srdce nebo mozek, bývá kmenových buněk poskrovnu. Možnost opravit poškození těchto orgánů je značně omezená (viz Vesmír 84, 320, 2005/6 a 84, 413, 2005/7). Jednou ze strategií je transplantace (buď celého orgánu, nebo jeho částí), druhou je přenos kmenových buněk.
Zkoumají se kmenové buňky z různých oblastí těla (například z kostní dřeně či z pupeční šňůry) nebo z časných (embryonálních) vývojových stadií orgánu. Chování kmenových buněk se testuje jak v buněčných a tkáňových kulturách, tak v interakci s hostitelovou tkání. Výsledky rozsáhlého výzkumu a testování na zvířecích modelech některých nemocí ukázaly, že lze transplantovat krvetvorné (hematopoetické) kmenové buňky pacientům po ozáření nebo při leukemii (viz Vesmír 78, 504, 1999/9). Tyto transplantace vedou bezesporu k zlepšení stavu nemocných a stále více se používají v praxi. Jiné druhy kmenových buněk a jejich interakce s příjemcem ještě nebyly prozkoumány tak dobře, aby mohly být spolehlivě využity pro člověka. K nim patří i kmenové buňky centrálního nervového systému (CNS).
Regenerační schopnost centrálního nervového systému
 Lidský mozek odjakživa budil pozornost a hledaly se techniky, které by lépe objasnily jeho složení, funkci a vývoj. Jednou z nich je neurotransplantace, s jejíž pomocí lze studovat vývoj CNS, vytváření nervových spojení, buněčné interakce, reakce na poškození i odolnost. Současná doba je však poznamenaná netrpělivostí, snahou využít co nejdříve kmenové buňky pro léčbu neurodegenerativních chorob a opravy poranění mozku či míchy. Jsou však výsledky laboratorního zkoumání natolik jasné, aby se již daly uplatnit v praxi?
Lidský mozek odjakživa budil pozornost a hledaly se techniky, které by lépe objasnily jeho složení, funkci a vývoj. Jednou z nich je neurotransplantace, s jejíž pomocí lze studovat vývoj CNS, vytváření nervových spojení, buněčné interakce, reakce na poškození i odolnost. Současná doba je však poznamenaná netrpělivostí, snahou využít co nejdříve kmenové buňky pro léčbu neurodegenerativních chorob a opravy poranění mozku či míchy. Jsou však výsledky laboratorního zkoumání natolik jasné, aby se již daly uplatnit v praxi?
Opravit spletitou buněčnou architekturu CNS není snadné, protože její vývoj sleduje geneticky kódovanou časoprostorovou posloupnost a její struktura je neustále obměňována zkušenostmi i učením. Je možné, že opravy znesnadňuje právě vysoká funkční specializace a složité propojení miliard buněk, z nichž každá má přesně definované vlastnosti a úkoly. Třeba omezená schopnost regulace „obranným“ mechanizmem sloužícím k tomu, aby se nevytvořily chybné spoje, nezmátly paměťové stopy či neselhalo řízení celého organizmu.
Na vývoj CNS působí mnoho faktorů. Tvorba nervové tkáně a vývoj orgánů se ovlivňují navzájem. Patologická změna na periferii, která se projeví v kritickém období, může způsobit chybný vývoj odpovědných oblastí CNS, a naopak zásah do formování určitých oblastí CNS v raných fázích může negativně ovlivnit tvorbu odpovídající části těla. Také učení a získávání zkušeností v časných obdobích života je pro vývoj CNS rozhodující. Pro jedince je nezbytné uchovávat informace. Získané zkušenosti se ukládají ve struktuře CNS v podobě paměťových stop. Možná proto se většina buněk CNS u savců tvoří již před narozením. V dospělosti neurony v zásadě nevznikají (až na malé neurony mozečku, hippocampu nebo čichových laloků). Tyto poznatky dovedly vědce a lékaře k dlouhodobé skepsi a k dogmatu o „regenerační rigiditě“ CNS. Nedůvěra v možnost obnovy poškozeného mozku a míchy ovlivňovala výzkum neurověd až do druhé poloviny 20. století.
Z historie neurotransplantací
 Výsledky prvních pokusů s transplantacemi do CNS byly publikovány před více než 100 lety (viz též Jan Bureš, Vesmír 64, 198, 1985/4). Ačkoliv štěp se obvykle neuchytil nadlouho, vyšlo najevo, že doba jeho přežití závisí na dvou klíčových podmínkách: dárcova tkáň musí být v době odběru nezralá a po přenosu včas dobře vyživovaná hostitelem. Tato pozorování však nedošla zasloužené odezvy snad proto, že se pro ně nenašlo okamžité uplatnění.
Výsledky prvních pokusů s transplantacemi do CNS byly publikovány před více než 100 lety (viz též Jan Bureš, Vesmír 64, 198, 1985/4). Ačkoliv štěp se obvykle neuchytil nadlouho, vyšlo najevo, že doba jeho přežití závisí na dvou klíčových podmínkách: dárcova tkáň musí být v době odběru nezralá a po přenosu včas dobře vyživovaná hostitelem. Tato pozorování však nedošla zasloužené odezvy snad proto, že se pro ně nenašlo okamžité uplatnění.
Nová vlna zájmu se vzedmula o mnoho desetiletí později, spolu s rozvojem imunologického výzkumu a vzrušenými debatami o vyšší imunitní snášenlivosti CNS (v porovnání s ostatními orgány). Rovněž se rozvinul výzkum histokompatibility, resp. molekul na povrchu buněk, které jsou odpovědné za imunitní odpovědi a rozeznávání vlastních částí těla od cizích (viz Vesmír 78, 565, 1999/10).
V osmdesátých letech 20. století vytvořil nový koncept neurotransplantací. Ten byl založen na přenosu primární (čerstvě připravené) embryonální nervové tkáně a o něco později kmenových buněk. Původním cílem těchto studií byla náhrada poškozené struktury novými buňkami, o nichž se věřilo, že mají schopnost se v hostitelově CNS namnožit a dozrát v buňky, jež byly zničeny nebo zraněny. Druhý směr výzkumu, který započal v devadesátých letech 20. století a v němž mají prioritu vědci českého původu, je založen na objevu indukce hostitelových regeneračních schopností vlivem přeneseného štěpu.
 Na počátku byly transplantovány kousky neurální tkáně nebo buněčné suspenze získávané z různých oblastí CNS zvířecích embryí. První výsledky, získané počátkem osmdesátých let 20. století v různých světových laboratořích včetně ústavů AV ČR, byly velmi povzbudivé. Přenesená tkáň v CNS příjemce dlouhodobě přežívala a včlenila se mezi jeho buňky. Pokud byl štěp transplantován do mozků zvířat trpících degenerací nervových buněk (například při Parkinsonově nemoci), stoupla v odpovědné oblasti hladina chybějícího neuropřenašeče a příznaky choroby vymizely. Tyto úspěchy vedly r. 1989 na pracovišti Univerzity v Lundu k překotným transplantacím štěpů do mozku pacientů s Parkinsonovou chorobou (viz Vesmír 78, 330, 1999/6), jimž degenerují mozkové neurony produkující neuropřenašeč dopamin (viz např. Vesmír 74, 65, 1995/2 nebo 80, 13, 2001/1). Výsledky operací však nebyly přesvědčivé a lékaři došli k závěru, že širší uplatnění zákroku vyžaduje více vědeckých podkladů. I když transplantace kousků nebo suspenzí embryonální nervové tkáně představuje v historii neurověd důležité období, téměř se od této strategie upustilo. Nejen proto, že odběr tkáně je technicky náročný a získávat dostatečné množství čerstvého materiálu je obtížné, ale především kvůli etickým problémům, jež jsou s tím spojeny. Začaly se hledat jiné buněčné zdroje a jiné metody. Jednou z nich se staly kmenové buňky.
Na počátku byly transplantovány kousky neurální tkáně nebo buněčné suspenze získávané z různých oblastí CNS zvířecích embryí. První výsledky, získané počátkem osmdesátých let 20. století v různých světových laboratořích včetně ústavů AV ČR, byly velmi povzbudivé. Přenesená tkáň v CNS příjemce dlouhodobě přežívala a včlenila se mezi jeho buňky. Pokud byl štěp transplantován do mozků zvířat trpících degenerací nervových buněk (například při Parkinsonově nemoci), stoupla v odpovědné oblasti hladina chybějícího neuropřenašeče a příznaky choroby vymizely. Tyto úspěchy vedly r. 1989 na pracovišti Univerzity v Lundu k překotným transplantacím štěpů do mozku pacientů s Parkinsonovou chorobou (viz Vesmír 78, 330, 1999/6), jimž degenerují mozkové neurony produkující neuropřenašeč dopamin (viz např. Vesmír 74, 65, 1995/2 nebo 80, 13, 2001/1). Výsledky operací však nebyly přesvědčivé a lékaři došli k závěru, že širší uplatnění zákroku vyžaduje více vědeckých podkladů. I když transplantace kousků nebo suspenzí embryonální nervové tkáně představuje v historii neurověd důležité období, téměř se od této strategie upustilo. Nejen proto, že odběr tkáně je technicky náročný a získávat dostatečné množství čerstvého materiálu je obtížné, ale především kvůli etickým problémům, jež jsou s tím spojeny. Začaly se hledat jiné buněčné zdroje a jiné metody. Jednou z nich se staly kmenové buňky.
Přednosti kmenových buněk
Ve srovnání s primární embryonální nervovou tkání mají kmenové buňky mnohé výhody. Nemusí se získávat vždy jen z embrya – jejich zdrojem může být například pupeční šňůra nebo buňky kostní dřeně (obr. 1). Pokud jsou kmenové buňky izolovány ze zárodečné tkáně, stačí pro jejich přípravu, expanzi a založení buněčné linie s definovanými vlastnostmi malý počet embryí. Teoreticky by se jeden zárodek mohl stát základem k produkci takřka nevyčerpatelného množství kmenových buněk. Dalšími přednostmi kmenových buněk jsou stejnorodost (homogenita), poměrně snadná manipulace a snadné uchovávání. Vhodné kmenové buňky se skladují ve speciálních „buněčných bankách“, podobně jako krev pro krevní transfuze.Zkoumají se nové metody, jimiž by se vlastnosti kmenových buněk mohly vhodně a bezpečně upravovat, tak aby nejlépe vyhovovaly požadavkům té které neurotransplantace. Ještě před přenosem do hostitelova těla lze kmenové buňky podnítit k zrání do žádaných buněčných typů (obr. 2A). Například do neuronů vyrábějících dopamin pro pacienty s Parkinsonovou nemocí nebo do buněk gliových, které tvoří myelin pro nemocné trpící například roztroušenou sklerózou nebo degenerací myelinových obalů optického nervu.
Strategie obnovy nervového systému
Pro studování léčby neurodegenerativních nemocí a poranění CNS kmenovými buňkami se využívá několik taktik.Nejstarší taktikou je náhrada poškozené buněčné populace novými buňkami. Takové „buněčné záplatování“ však nelze řešit pouhým dodáním „stavebního materiálu“ – čerstvých buněk – a udržováním štěpu při životě. Přenesené buňky se musí včlenit do hostitelovy tkáně a vytvořit spojení, která je funkčně propojí s odpovídajícími oblastmi CNS. A také se naopak hostitelská tkáň musí dorozumět s buňkami transplantátu. Tento proces je složitý a dosavadní výsledky získané v laboratořích i v klinické praxi nejsou zcela uspokojivé.
Další, možná nadějnější taktika využívá kmenové buňky jako nosiče pro doručení důležitých látek nebo přímo pro „výrobu“ těchto látek v oblastech, v nichž je jich nedostatek. Takovými látkami jsou například některé enzymy nebo neuropřenašeče.
Jinou možností je přemostit poraněná místa polymery (organickými látkami tvořenými řetězci stejných molekul), které pomáhají směrovat nové napojení nervových vláken.
Pro tuto taktiku se vědci snaží vyvinout speciální „lešení“, po němž by kmenové buňky mohly šplhat do určených oblastí a prorůstající nervová vlákna by tak získala patřičnou oporu i směr. Po zacelení by se „lešení“ samo vstřebalo, aby tkáň zbytečně nedráždilo. Tak by se zároveň zabránilo vzniku gliové jizvy, která je pro růst vláken neprostupná, tudíž znemožňuje nová propojení.
Vlastnosti kmenových buněk se dají před transplantací obměňovat metodami genetického inženýrství. Cílenými změnami v genetickém kódu mohou kmenové buňky získat nové vlastnosti, které zvýší jejich životaschopnost nebo urychlí jejich pohyb v hostitelském prostředí, a tím usnadní osídlování poškozených oblastí. Kmenové buňky lze také vést k časovanému dozrávání do žádoucích buněčných typů. Diferenciace transplantovaných buněk se dá pozdržet tak, aby k ní došlo, jen když hostitel začne strádat. Tato strategie by se mohla uplatnit u geneticky vázaných onemocnění (například při Alzheimerově chorobě), kdyby byli pacienti odhaleni při laboratorním vyšetření a transplantováni před vypuknutím choroby.
Jednou ze zvláštností kmenových buněk je, že aktivně cestují do postižených nebo ohrožených míst. Této vlastnosti by se mohlo využít v léčení například nádorového onemocnění CNS. Pokusy na zvířatech ukázaly, že geneticky uzpůsobené kmenové buňky jsou schopny selektivně osídlit postiženou oblast, infiltrovat nádor a uvolňovat do něj látky, které buněčné bujení potlačují. Tato taktika by navíc byla vhodná pro difuzní typ onemocnění nebo v případě, že se dá postižená oblast těžko lokalizovat.
Vybuzení regeneračních schopností
Novým přístupem je transplantace kmenových buněk s cílem aktivovat regenerační schopnost hostitelovy tkáně (obr. 2B). Kmenové buňky jsou bohaté na růstové a indukční faktory, z nichž pravděpodobně většina dosud nebyla izolována. A právě tyto látky podporují dělení a diferenciaci neurálních buněk. V souvislosti s transplantacemi embryonální nervové tkáně se zjistilo, že neurální štěp může indukovat regeneraci poškozeného CNS. Prvně byl tento jev popsán před 14 lety u myší, jimž byly kousky embryonální mozkové tkáně transplantovány do mechanicky poškozené kůry předního mozku, a poté došlo k dobré strukturální rekonstrukci. Při detailnějším prostudování se však (k překvapení samotných vědců) zjistilo, že nová tkáň patří hostiteli a ne dárci. V tu dobu se věřilo, že CNS není schopen obnovy, a tak autoři své pozorování hostitelovy schopnosti regenerace probuzené štěpem publikovali jen s obtížemi. I když se tento jev později potvrdil a rozšířil o nová pozorování, trvalo přes deset let, než myšlenka neurální ochrany a indukované regenerace CNS vzbudila pozornost vědců. Že je tato vlastnost embryonální neurální tkáně charakteristická také pro kmenové buňky, se zjistilo až počátkem nového milénia. Ukázalo se, že neurální kmenové buňky izolované z tkáně novorozených myší jsou schopny zachránit ohrožené a špatně fungující oblasti CNS starých parkinsonických zvířat.Moderní výzkumy ukazují, že v některých oblastech mozku jsou kmenové buňky přítomny, byť v malém množství, i v dospělosti. Jsou to dospělé endogenní neurální kmenové buňky, které se mohou za určitých podmínek (například po poranění) začít dělit a diferencovat do nervových a gliových buněk. Tato reakce je však velmi slabá a snad proto se o ní dlouho nevědělo. Možná že transplantované (exogenní) buňky mohou reakci endogenních kmenových buněk zesílit a spolu s nimi se aktivně účastnit regenerace a ochrany buněk CNS. Ukazuje se totiž, že většina buněk transplantovaných do mozku pokusných zvířat s vyvolanou degenerací nervových buněk produkujících dopamin a s příznaky podobnými Parkinsonově nemoci nedospívá do neuronů, jak se očekávalo, ale zůstává dlouhodobě nezralá. Tyto buňky jsou bohaté na výrobu růstových faktorů, reagují s mikroprostředím hostitelova CNS a povzbuzují poškozené buňky, aby opět začaly dopamin „vyrábět“. Podobné výsledky přinesly i pokusy se zvířaty trpícími Hungtingtonovou chorobou nebo pohybovými defekty v důsledku degenerace Purkyňových buněk mozečku. Největší naději na ochranu a obnovu tkáně mají ty transplantace, které se provedou do několika hodin, popř. dnů po poranění, nebo v počátcích neurodegenerativního onemocnění, kdy se ještě nemoc neprojevuje změnami v chování, pohybu, myšlení apod.
Ochranné vlastnosti kmenových buněk by se mohly v budoucnu uplatnit i v preventivní terapii dědičných nemocí, kdy je odumírání buněk CNS geneticky časováno do pozdějších stadií života dítěte nebo dospělého jedince. V tom případě by se ohrožená oblast CNS mohla osadit kmenovými buňkami ještě před vypuknutím choroby.
Etika a zákony
Ačkoliv se využití kmenových buněk zdá být slibné, získávání lidských buněčných linií způsobilo rozruch. Největší pochybnosti pramení z představy obětování lidského embrya pro izolaci kmenových buněk. Ačkoliv v úvahu přicházela pouze embrya pocházející z umělého přerušení těhotenství, která by byla tak jako tak odsouzena k zániku, zůstává otázkou, zda je jejich použití pro odběr kmenových buněk etické. Druhou stranou mince však je, že na záchranu čekají miliony nemocných lidí trpících a umírajících pro nedostatek vhodné léčby. Ve vyspělém světě vznikají stále nové organizace, které pořádají sbírky pro podporu výzkumu kmenových buněk a neurotransplantací. Nedá se popřít, že vyvíjená technologie transplantací kmenových buněk má obrovský výzkumný i léčebný potenciál.Ne všechny státy daly povolení k použití lidských embryonálních kmenových buněk a ne všude byla pevně stanovena pravidla s jejich zacházením. (Pozn. red.: V České republice nabyl zákon 227/2006 sbírky o výzkumu na embryonálních kmenových buňkách účinnos ti 1. června 2006.) Důvod k přísným opatřením je dvojí: etický a právní. Především se musí předejít zneužívání lidské tkáně a možnostem s jejím „kšeftařením“. Tyto zákony musí být formulovány ve spolupráci s vědci, kteří mají dostatek odborných vědomostí. Problém se však netýká jenom získávání lidských kmenových buněk, ale také překotné snahy provádět transplantace s nemístnou filozofií „uvidíme, co se stane“. Vybraní pacienti nebývají většinou pro provedení transplantací nejvhodnější – jejich choroba je ve velmi pokročilém stadiu, anebo, v případě míšních poranění, zastaralá. Vysoká neúspěšnost takových operací ohrožuje důvěru lidí v medicínu a ochromuje úsilí badatelů zkoumajících vlastnosti kmenových buněk.
Nutnost dalšího studia
Možnost léčit poškozený CNS embryonálními štěpy nervové tkáně a později kmenovými buňkami se intenzivně zkoumá několik desetiletí. Tušíme, že potenciál této léčebné metody by mohl být obrovský, pro odpovědnou aplikaci do lékařské praxe však musíme získat více znalostí. Pozorování kmenových buněk nám odhaluje důležitá poznání, ale i další neznámé obzory. Ty musíme prozkoumat, než získáme morální oprávnění k transplantacím u lidských pacientů.Stále si nejsme jisti v otázkách týkajících se dlouhodobého přežívání štěpů, nemáme jistotu, že nehrozí zvrat do nádorového bujení, nevíme přesně, jak se kmenové buňky diferencují v hostitelově tkáni. Musíme najít způsob, který by zaručil správná spojení a obnovu původní funkce. Potřebujeme doplnit chybějící údaje o chování transplantovaných buněk po delší době, než jsme schopni testovat u drobných laboratorních zvířat.
Jakkoliv jsou první výsledky s ovlivňováním vlastností kmenových buněk in vitro nadějné, nemáme ještě dost údajů o jejich chování v hostiteli. Zatímco obnovu základních pohybových a smyslových funkcí si dovedeme představit, těžko si uděláme obraz o rekonstrukci oblastí, které jsou důležité pro paměť a uchování lidské osobnosti. Nadějnou cestou by mohla být již zmíněná preventivní transplantace s cílem ochránit poškozené, avšak dosud žijící buňky CNS. Pouze další intenzivní studium a dostatečné pochopení interakcí mezi kmenovými buňkami a hostitelem v konkrétních typech onemocnění nám pomůže vyvinout vhodnou strategii.
Ke stažení
 článek v souboru pdf [385,47 kB]
článek v souboru pdf [385,47 kB]

























