Rezistence na antibiotika
Antibiotika jsou přirozené látky produkované mikroorganizmy (někdy i vyššími rostlinami či živočichy), které potlačují růst jiných organizmů. K „producentům“ antibiotik patří bakterie, houby, řasy, lišejníky aj. (viz tabulku, Vesmír 78, 30, 1999, 1). V nějaké formě se antibiotika musela používat již ve starém Egyptě, protože v mumiích se našly stopy tetracyklinu. Ve středověku prý lidé používali k léčbě hnisavých ran plesnivý chléb. Skutečný rozvoj antibiotik však začal až Flemingovým objevem penicilinu r. 1929. Cesta od zjištění, že kolonie plísně Penicillium notatum na Petriho miskách brání růstu zlatého stafylokoka Staphylococcus aureus, však byla ještě velmi dlouhá... Klinicky byl penicilin použit poprvé až koncem druhé světové války při léčení zraněných spojeneckých vojáků. Další antibiotika pak již byla objevována jako na běžícím pásu. S možností rezistence se tenkrát příliš nepočítalo.
Dnes je až 40 % klinických kmenů běžné bakterie Staphylococcus aureus rezistentních vůči penicilinu a zdá se, že stafylokokové infekce mohou být spolehlivě léčeny pouze vankomycinem. Mycobacterium tuberculosis (původce tuberkulózy) vykazuje vícenásobnou rezistenci vůči antibiotikům a chemoterapeutikům a odhaduje se, že každý desátý případ plicní tuberkulózy je smrtelný. Neisseria gonorrhoeae (původce kapavky, přenášené pohlavním stykem) je rezistentní vůči penicilinu, tetracyklinu, chinolonům a některé kmeny i vůči cefalosporinu. Zvláště vážná je také situace šířících se nemocničních infekcí, které postihují zejména pacienty s nižší účinností imunitního systému.
Rezistence primární a získaná
- Primární rezistence (poměrně vzácná) vůči určitému antibiotiku je dána druhem bakterie a jeho přirozenými vlastnostmi. Bez jakékoli genetické změny je takový druh bakterie rezistentní prostě proto, že pro dané antibiotikum nenese zásahové místo. Například některé gramnegativní bakterie jsou ve srovnání s grampozitivními podstatně méně citlivé na penicilin, jsou však citlivé vůči antibiotikům jiným. Přirozená vícenásobná rezistence se může vyskytovat u bakterií žijících v prostředí (ve vodě, v půdě), kde již byly účinkům antibiotik vystaveny. Jako příklad volně žijícího patogena s vysokým stupněm přirozené rezistence může sloužit Pseudomonas aeruginosa. Většina kmenů této bakterie byla vůči mnoha antibiotikům rezistentní hned od začátku, v době, kdy se s antibiotiky teprve začínalo.
- Získaná rezistence (tj. většina rezistencí) vzniká jako důsledek mutací nebo různých genetických přenosů. Bakterie, kterou původně antibiotikum zabíjelo, najednou začne být odolná.
- Změna průchodnosti buněčných obalů bakterie. Obal bakteriální buňky se skládá z vnější buněčné stěny a vnitřní plazmatické membrány. Tato struktura umožňuje průchod živin a produktů látkové výměny, a přitom účinkuje jako bariéra proti látkám, které bakteriální buňce škodí. Slizová vrstva však většinou není pro antibiotika velkou překážkou. Buněčná stěna grampozitivních bakterií je poměrně silná, ale pro většinu antibiotik průchodná. Buněčná stěna gramnegativních bakterií je tenčí, zato však složitější. Na povrchu buňky jsou molekuly lipopolysacharidu, jejichž hydrofilní konce směřují z buňky ven. Jejich vnitřní (lipofilní) konce se ovlivňují navzájem s mastnými kyselinami fosfolipidické vrstvy vnitřního povrchu. Fosfolipidy a lipopolysacharidy vnější membrány vytvářejí klasickou lipidickou dvojvrstvu, která brání vstupu hydrofobních i hydrofilních antibiotik. Rozdíly ve složení buněčné membrány mezi grampozitivními a gramnegativními bakteriemi jsou odpovědné nejen za rozdíly v přirozené průchodnosti nejrůznějších látek, ale také za rozdíly v přirozené rezistenci vůči antibiotikům.
Hydrofobní antibiotika mohou vstupovat do buněk gramnegativních bakterií napříč tukovou vrstvou membrány, ale hustě uspořádané molekuly lipopolysacharidů kryjících membránu mohou mechanicky vstupu látky bránit. Hydrofilní antibiotika (jichž je většina) procházejí dovnitř do gramnegativních buněk kanálky vytvořenými membránovými bílkovinami (poriny). Proto některé typy rezistence vůči antibiotikům u gramnegativních bakterií závisí vlastně na snížené koncentraci porinů.
- Zneškodnění antibiotika bakteriálními enzymy. Jako příklad může sloužit rezistence na β-laktamová antibiotika (peniciliny, cefalosporiny). Rezistentní bakterie produkují enzymy β-laktamázy, které se navážou na antibiotika vazebnými místy obsahujícími aminokyselinu serin a otevřou β-laktamový kruh. Ten se již neváže na své zásahové místo, a proto nemá žádnou antimikrobní aktivitu. Transformace penicilinu katalyzovaná β-laktamázou je znázorněna na obr. 1. Podobné mechanizmy byly nalezeny také u bakterií rezistentních vůči aminoglykosidickým antibiotikům, jako jsou streptomycin, neomycin a kanamycin. Specifické enzymy zde modifikují aminoskupiny nebo hydroxylové skupiny antibiotika, a molekuly modifikovaného antibiotika již nejsou schopny se vázat na cílové ribozomální bílkoviny.
U grampozitivních bakterií β-laktamová antibiotika snadno vstupují do buněk a β-laktamáza se uvolňuje do vnějšího prostředí a snižuje koncentraci penicilinu v blízkosti buňky. V optimálních podmínkách jedna molekula enzymu dokáže rozložit 100 000 molekul penicilinu za minutu. Rezistence zlatého stafylokoka (Staphylococcus aureus) je tedy vlastně také populační jev, velká společenství bakterií jsou mnohem rezistentnější než malá.

U gramnegativních bakterií buněčná stěna zpomaluje vstup penicilinu a cefalosporinu do buňky, βlaktamáza může proto zbavovat účinnosti pouze ty molekuly antibiotika, které vnikly do buňky (antibiotikum, jež zůstává v prostředí, není pro bakteriální buňky škodlivé).
- Aktivní vypuzování antibiotika. U rezistentních bakterií je rychlá exkrece antibiotika spojena s produkcí membránových bílkovin. To platí např. pro bílkoviny nazývané Tet, které vypuzují antibiotikum z buňky. K tomu typu rezistence náleží rezistence vůči tetracyklinu, některým chinolonům, ale i některým dezinfekčním prostředkům a těžkým kovům. Zdá se, že tento typ rezistence je mnohem častější, než se původně předpokládalo.
- Změna zásahového místa antibiotika v buňce způsobí, že se antibiotikum nenaváže. Jako příklad uveďme vazebné bílkoviny pro penicilin. Jsou to bílkoviny buněčných obalů, které vážou penicilin, a jsou tedy zásahovými místy pro β-laktamová antibiotika. Každá bakteriální buňka má těchto bílkovin několik. Vlastně jde o enzymy, které se účastní biosyntézy bakteriální buněčné stěny a buněčného růstu. Některé z nich bakteriální buňka potřebuje pro své přežití. Trochu připomínají již zmíněné β-laktamázy, na rozdíl od nich však vytvářejí s β-laktamovými antibiotiky stálé komplexy a samy při tom přestávají být aktivní. Tato antibiotika zbavují vazebné bílkoviny aktivity a zabraňují tak normálnímu buněčnému růstu a dělení. V důsledku toho je vadná buněčná stěna, což často vede k smrti bakteriální buňky.
Změna zásahových struktur odpovídá také za rezistenci bakterií vůči jiným antibiotikům. Sem patří například klinicky velmi významná rezistence původce tuberkulózy vůči streptomycinu. Nejběžnější typ získané rezistence na erytromycin a klindamycin, kterou nacházíme u streptokoků, enterokoků a stafylokoků, je založena na tvorbě enzymů metylujících ribozomální RNA, což snižuje vazbu těchto látek na ribozomy.
Příčiny rezistence vůči antibiotikům
Genetická podstata získané rezistence
Získaná rezistence vzniká buď vinou mutací ovlivňujících geny na bakteriálním chromozomu, nebo tím, že bakterie získá geny přenášející rezistenci na (původně) citlivé mikroorganizmy.- Mutace: Může jít o bodové mutace, odstranění části genu (deleci), jeho náhradu (substituci), anebo přidání (adici) jednoho či několika párů bází v deoxyribonukleové kyselině, které mají za následek výměnu jedné nebo více aminokyselin v zásahové peptidové struktuře. Syntetizuje se tak bílkovinný produkt, který má omezenou schopnost vázat antibiotikum. Jako příklad může sloužit rezistence Mycobacterium tuberculosis, původce tuberkulózy, vůči streptomycinu, způsobená mutací, která ovlivňuje specifickou bílkovinu vázající streptomycin.
Asi před padesáti lety byla antibiotika zavedena do léčby nemocí způsobených mikroorganizmy a očekávalo se, že jednou provždy skončí nebezpečí infekčních onemocnění. Pro mikrobní populace to měla být katastrofální situace, avšak tehdy ne zcela ještě známá genetická flexibilita mikroorganizmů umožnila jejich přežití. Co se skutečně mikrobním populacím jako celku přihodilo, to se pravděpodobně nikdy nedovíme, protože zatím není možné kultivovat všechny bakteriální druhy a rody, které žijí v určitém prostředí (kultivovat dovedeme jen asi 1 % všech mikroorganizmů).
 Navíc není takovou zajímavou studii v oboru mikrobní ekologie možné provést proto, že naše prostředí bylo již antibiotiky významně ovlivněno. Rozvoj bakterií rezistentních vůči antibiotikům vede ke krizovým situacím při léčbě infekčních nemocí. Některé nemocnice v Evropě a Severní Americe jsou zaplaveny enterokokálními infekcemi, které jsou rezistentní vůči všem klinicky doporučovaným antibiotikům, proti vícenásobně rezistentním stafylokokům nám zbylo jediné antibiotikum. Podobně se zvýšila rezistence pneumokoků a to všechno vlastně vrací léčbu infekčních onemocnění do předantibiotikálního období. Tato situace se nevyvinula bez předchozích varovných signálů. Odborníci (lékaři i mikrobiologové) na toto nebezpečí upozorňovali již od prvního použití antibiotik, ale nápravná opatření nebyla nikdy přijata. Šíření rezistence vůči antibiotikům dosud pokračuje.
Navíc není takovou zajímavou studii v oboru mikrobní ekologie možné provést proto, že naše prostředí bylo již antibiotiky významně ovlivněno. Rozvoj bakterií rezistentních vůči antibiotikům vede ke krizovým situacím při léčbě infekčních nemocí. Některé nemocnice v Evropě a Severní Americe jsou zaplaveny enterokokálními infekcemi, které jsou rezistentní vůči všem klinicky doporučovaným antibiotikům, proti vícenásobně rezistentním stafylokokům nám zbylo jediné antibiotikum. Podobně se zvýšila rezistence pneumokoků a to všechno vlastně vrací léčbu infekčních onemocnění do předantibiotikálního období. Tato situace se nevyvinula bez předchozích varovných signálů. Odborníci (lékaři i mikrobiologové) na toto nebezpečí upozorňovali již od prvního použití antibiotik, ale nápravná opatření nebyla nikdy přijata. Šíření rezistence vůči antibiotikům dosud pokračuje. - Přenos rezistence na mikroorganizmy, které byly původně na antibiotikum citlivé.
- Plazmidy jsou nezávisle se replikující molekuly kyseliny deoxyribonukleové, které mohou existovat mimo bakteriální chromozom a mohou nést rezistenci vůči jednomu nebo více antibiotikům. Přenášejí se konjugací, transdukcí pomocí bakteriofágů nebo transformací DNA bez jakéhokoli nosiče. Dva poslední případy přenosu rezistence jsou v přírodě dosti vzácné, zatímco přenos konjugací je běžný. Plazmidy mají obvykle omezené spektrum hostitelů, např. plazmidy z gramnegativních bakterií většinou nemohou přenášet rezistenci na grampozitivní druhy.
- Transpozony jsou zvláštní sekvence DNA, které se mohou pohybovat z jedné replikační jednotky (chromozomu nebo plazmidu) na druhou, proto se jim také říká „přeskakující geny“. Mohou kódovat rezistenci vůči širokému spektru antibiotik, podobně však mohou určovat i řadu jiných vlastností.
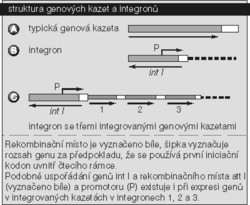
- Genové kazety. Nedávno byl popsán systém genových kazet, které umožňují pohyb rezistenčních genů. Kazety obsahují pouze jeden gen kódující rezistenci vůči určitému antibiotiku a celou rodinu receptorových prvků, integronů, které poskytují místo pro integraci kazety, ale kódují i enzym, který je odpovědný za pohyb genu. Pohyb genových kazet, tj. jejich vnesení a vytržení z integronů, se odehrává specifickou rekombinací. Integrony se však mohou také přemísťovat, což je velmi důležité pro pohyb rezistenčních genů mezi různými bakteriálními druhy. Umožňuje to totiž integronům a rezistenčním genům připojení na řadu plazmidů se širokým spektrem hostitelů.
Kazety se mohou integrovat do receptorových elementů (integronů), nebo se z nich vydělit, anebo se integrovat na jiných místech chromozomu. Tak může vzniknout sestava několika rezistenčních genů (viz obr. 2).
Schopnost integronů přijímat více než jednu kazetu kódující rezistenci, spojení integronů s většími transpozony, které mohou nést další rezistenční geny, a spojení vícenásobných transpozonů v tomtéž plazmidu vysvětluje nyní již zcela obecný výskyt klinických kmenů patogenních bakterií, jež jsou rezistentní vůči mnoha různým antibiotikům zároveň.

Kdo může za rezistenci bakterií vůči antibiotikům?
Na začátku čtyřicátých let, kdy se sulfonamidy a antibiotika dostaly do klinické praxe, byla většina nemocničních infekcí způsobena pneumokoky, β-hemolytickými streptokoky a kmeny Staphylococcus aureus. Rezistentní kmeny těchto mikroorganizmů v podstatě neexistovaly a většinu lékařů ani nenapadlo, že by se rezistence mohla stát problémem. Objevila se teprve jako důsledek celosvětové exploze užívání antibiotik. Kdykoli byla na trh zavedena nová antibakteriální látka, dříve či později se začaly objevovat rezistentní kmeny (viz příklady v tabulce II). Snad nejdéle zůstal zcela účinný vankomycin (ale ani to již neplatí).Není pochyb o tom, že za vznik rezistence mohou hlavně bakterie samy, neboť jsou neobyčejně geneticky proměnlivé a dokážou vyvinout obranné mechanizmy během velmi krátké doby. Na druhou stranu však antibiotika byla a ještě jsou v klinické praxi často předpisována, ačkoli to není nutné. Platí to zejména o banálních onemocněních respiračního traktu. Statistiky ukazují, že až 70 % terapeutických postupů využívajících antibiotika není nezbytných. Lékaři nejsou vždy o způsobu použití antibiotika dobře poučeni (někdy získávají informace pouze od zástupců farmaceutických společností). Krom toho se dlouhou dobu antibiotika téměř bez kontroly uplatňovala ve výživě hospodářských zvířat, například tetracykliny se používaly k zvýšení užitné váhy dobytka. A nakonec může za vznik rezistence bakterií vůči antibiotikům i pacient sám: jednak tím, že se předepsání antibiotika dožaduje, a také tím, že nedodržuje léčebný postup.
Dříve nebo později budou bakterie rezistentní vůči všem běžně používaným antibiotikům. Zatím situace v České republice není tak vážná jako v některých jiných zemích, není proto důvod k panice. Cesty k nápravě nebo alespoň zlepšení současné situace jsou v podstatě dvě: nepoužívat antibiotikum, vůči němuž infekční bakterie začínají být rezistentní, a hledat nové látky a nové léčebné postupy.
ROZŠÍŘENÍ A CENY ANTIBIOTIK
Nyní je známo asi 10 000 antibiotik a podobných látek z mikroorganizmů, rostlin či živočichů, z nichž je dále odvozeno více než 100 000 polosyntetických a syntetických látek, získaných organickou syntézou. Z toho se sotva jedna setina používá v klinické praxi. I tak je však počet nových nebo modifikovaných léčiv na trhu každoročně vysoký (asi 6–7 %). V USA je například podíl antibiotik vůči ostatním léčivům asi 13 %, navíc jsou antibiotika hlavním produktem biotechnologickým. Také tržní cena antibiotik je vyšší než cena kterékoli jiné skupiny léčiv. Finanční obrat produkce antibiotik využívaných v humánní medicíně se pohybuje v rozmezí desítek miliard amerických dolarů ročně. Nejvíce se vyrábí penicilinu, tetracyklinu, cefalosporinu, erytromycinu a jejich derivátů. V naší republice bylo objeveno jediné antibiotikum – mucidin (V. Musílek a kol., 1970).
Slovníček
bakteriální konjugace – přenos genové informace z jedné bakteriální buňky do druhé při jejich kontaktu a cytoplazmatickém propojení (podmíněno přítomností specifického plazmidu)
bakteriální transdukce – proces, ve kterém bakteriofág vnáší vlastní genetický materiál do napadených bakterií a vyvolá tak u nich nové vlastnosti
bakteriální transformace – projev nově získaných vlastností buňky v důsledku mezibuněčného přenosu genetické informace
bakterie gramnegativní a grampozitivní – dvě skupiny eubakterií, lišící se v barvení podle Grama (díky rozdílům ve stavbě buněčné stěny)
hydrofobní – odpuzující vodu, nevsakující
hydrofilní – zadržující, nasávající vodu nebo se v ní rozpouštějící
rezistence – schopnost odolávat, vzdorovat něčemu
ribozom – základní částice v cytoplazmě buňky složená z bílkovin a nukleových kyselin, na níž probíhá syntéza bílkovin
OBNOVA CITLIVOSTI VŮČI ANTIBIOTIKU
Populace bakterií, které jsou vůči určitému antibiotiku rezistentní, se mohou někdy stát opět citlivými, když se antibiotikum přestane užívat. Tato možnost se studovala experimentálně: Při pětidenním použití tetracyklinu je počáteční odolnost bakterií v zažívacím traktu velmi nízká a dosahuje vrcholu po dvou dnech. Když je po pěti dnech léčení tetracyklinem ukončeno, citlivost rezistentních bakterií vůči tetracyklinu se začne pomalu obnovovat. Trvá obvykle 15 dní, než se ustálí počáteční hladina rezistence.
Antibiotika velmi účinně selektují nové rezistentní kmeny, ale obrácený proces je obvykle velmi pomalý. Skutečnost, že bakterie nese geny rezistence vůči určitému antibiotiku, je velmi výhodná v případě, že prostředí toto antibiotikum obsahuje. Odolnost vůči antibiotiku však může jít také na úkor jiných vlastností a procesů, které v bakteriální buňce probíhají, a může v jeho nepřítomnosti vést ke snížené konkurenceschopnosti rezistentních bakterií vzhledem k citlivé části populace.
Kdyby tomu tak skutečně bylo, stačilo by přestat brát antibiotika po dobu, než se výskyt odolných kmenů sníží na minimum a tak by bylo možno kontrolovat šíření rezistence. V řadě prací bylo skutečně ukázáno, že rezistentní kmeny jsou v nepřítomnosti antibiotika málo schopné konkurovat citlivým kmenům, což ukazuje, že rezistence něco stojí. V nepřítomnosti antibiotika rostou rezistentní kmeny často pomaleji než jejich citliví partneři. Mutační změny, které vedou k rezistenci, většinou porušují některé normální fyziologické procesy v buňce, což může mít pro takovou bakteriální buňku škodlivé důsledky. Při rezistenci kódované na plazmidech musí buňka produkovat další nukleové kyseliny a bílkoviny, a tato syntéza představuje pro buňku energetickou zátěž. Navíc mohou syntetizované produkty narušit buněčnou fyziologii. Odolné bakterie tak mohou být skutečně v prostředí bez antibiotika oproti buňkám citlivým v nevýhodě.
Ke stažení
 DATA A SOUVISLOSTI - Antibiotika [1,08 MB]
DATA A SOUVISLOSTI - Antibiotika [1,08 MB] Článek ve formátu PDF [605,56 kB]
Článek ve formátu PDF [605,56 kB]















