Molekulárno-genetické metódy detekcie mikroorganizmov
| 5. 3. 1995laboratórna diagnostika,
ktorá má za cieľ určiť v klinických vzorkách pacienta (krv, sérum, moč, stery, výkaly a pod.) prítomnosť infekčného činiteľa. Pri troche fantázie dôkaz infekčného agensa pripomína prácu detektíva.Najcitlivejšou metódou dôkazu na úrovni corpus delicti je priama izolácia mikroorganizmu (baktéria, vírus a pod.) z analyzovaného materiálu, ktorý bol odobratý pacientovi. Žiaľ, k tomuto dôkazu je potrebná bunková kultivácia, t.j. práca s chúlostivejším biologickým materiálom, dostatočne dlhý čas (dni až týždne), a často aj drahá prístrojová technika. Z praxe vieme, že lekár potrebuje k účinnému zásahu tieto dôležité výsledky čo najskôr. Preto diagnostická prax kladie na životaschopný diagnostický test popri jeho vysokej citlivosti a špecifickosti aj také požiadavky, ako sú rýchlosť, jednoduchosť a ekonomická nenáročnosť. Nie vždy sa darí tieto požiadavky racionálne spojiť. Podmienky diktované praxou podnecujú zrod stále nových diagnostických postupov. Zvlášť výrazne to môžeme pozorovať pri aktuálnej diagnostike vírusových infekcií. Popri priamej izolácii vírusu sa používa napr. dôkaz špecifických vírusových antigénov vyvolávajúcich imunologickú reakciu organizmu (imunofluorescenčný test), dôkaz niektorých vírusových enzýmov (napr. neuraminidázy u chrípkových vírusov, reverznej transkriptázy u retrovírusov), testy založené na špecifických biologických účinkoch vírusov (hematoglutinácia) a pod. Medzi najobľúbenejšie, dobre prepracované testy patria sérologické vyšetrenia založené na princípe dôkazu špecifických protilátok (napr. imunoprecipitačné testy, RIA, ELISA).
Dnes, v dobe prudkého rozvoja metodík molekulárnej biológie, neprekvapí, že do laboratórnej diagnostiky mikroorganizmov pribúdajú testy práve z tejto oblasti. Všetky sú založené na genetickom dôkaze mikroorganizmu. 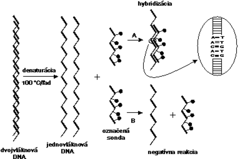
Mikroorganizmy majú genetický materiál zložený z molekúl DNA alebo RNA (niektoré vírusy). Ak dokážeme vo vyšetrovanej vzorke jeho prítomnosť, určíme pôvodcu infekcie. Ako však túto zdanlivo jednoduchú myšlienku zrealizovať v praxi? Jeden z nových molekulárnogenetických postupov je založený na dôkaze genetického materiálu mikroorganizmu s využitím špecifickej DNA alebo RNA sondy metódou
hybridizácie nukleových kyselín.
Aby sme pochopili princíp tejto metódy, musíme si objasniť základy vzájomnej interakcie nukleových kyselín.Genetický materiál mikroorganizmov je zložený z reťazca nukleotidov, pričom každý nukleotid obsahuje práve jednu z nukleotidových báz: adenín (A), tymín (T), guanín (G), cytozín (C), v prípade RNA je T nahradený uracilom (U). Nukleotidy vytvárajú jednovláknové alebo dvojvláknové nukleové kyseliny. Dvojvláknové útvary vznikajú špecifickým párovaním báz: A=T, G=C alebo A=U. Iné vzájomné párovanie báz neexistuje. Práve princíp špecifického párovania báz sa s úspechom využíva pri koncipovaní moderných diagnostických testov.
K dôkazu mikroorganizmu metódou hybridizácie nukleových kyselín je potrebné pripraviť špecifický úsek DNA alebo RNA (sondu), ktorý sledom nukleotidov presne zodpovedá malej (20-30 nukleotidov) alebo väčšej časti (100-2000 nukleotidov) jeho genómu. Ak necháme pri vhodných reakčných podmienkach zreagovať sondu so vzorkou, v ktorej predpokladáme prítomnosť genómu mikroorganizmu, po istom čase (sekundy-hodiny) sa vzájomne zodpovedajúce úseky nukleotidov spoja - zhybridizujú (obrázek) a vytvoria dvojvláknový útvar DNA-DNA, DNA-RNA alebo RNA-RNA. Pretože najlepšie vzájomne hybridizujú jednovláknové úseky nukleových kyselín, dvojvláknové formy genómov mikroorganizmov alebo i sondy sa pred reakciou hybridizácie rozvlákňujú denaturáciou, ktorá spočíva napr. v zohriatí nukleovej kyseliny a následnom prudkom ochladení v ľade.
Pozornejšiemu čitateľovi neuniklo, že detekcia mikroorganizmov touto metódou závisí od
kvality hybridizačnej sondy.
Na detekciu každého typu mikroorganizmu alebo skupiny mikroorganizmov musí byť použitá špecifická hybridizačná sonda. Jej konštrukcia je výsledkom molekulárnobiologických vedomostí o genóme mikroorganizmu, vhodného využitia molekulárnogenetických metodík pri príprave sondy a možností toho-ktorého laboratória. Dnes sa používajú DNA sondy častejšie ako RNA sondy, pretože DNA je stabilnejšia. Existuje niekoľko spôsobov konštrukcie hybridizačných sond. Jeden z nich využíva princíp, pri ktorom sa z genómu dvojvláknovej DNA (u vírusov sa genóm prepíše do DNA enzýmovým účinkom reverznej transkriptázy) vyštiepi pre daný mikroorganizmus špecifický úsek jednou alebo dvoma reštrikčnými endonukleázami (enzýmy, ktoré štiepia dvojvláknovú DNA v mieste výskytu charakteristického zoskupenia nukleotidov). Pretože pre diagnostické účely potrebujeme väčšie množstvo sondy, využíva sa klonovanie v bakteriálnych bunkách. Vyštiepený úsek sa vsunie do bakteriálneho plazmidu (obrázek) a tento sa vnesie do bakteriálnych buniek, kde sa pomnoží. Po spätnej izolácii takéhoto plazmidu máme k dispozícii dostatok DNA sondy.Iný spôsob prípravy sondy umožňuje syntéza špecifických fragmentov dlhých 20 - 40 nukleotidov v DNA-syntetizátoroch. V tomto prípade, na rozdiel od predchádzajúcej metódy, je potrebné poznať poradie nukleotidov v genóme mikroorganizmu a vybrať taký úsek, ktorý je pre daný mikrób charakteristický. Sondy obsahujúce syntetické fragmenty DNA súšpecifické, ale spravidla málo citlivé. Pri príprave RNA sond sa využívajú techniky konštrukcie rekombinantných plazmidov a účinky RNA polymeráz. 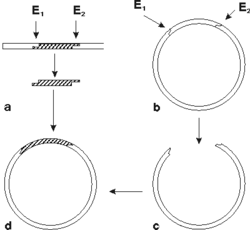
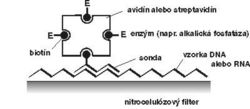
Aj keď sonda zhybridizuje s genetickým materiálom mikroorganizmu, oko experimentátora to nezaregistruje, lebo reakcia prebehne na molekulárnej úrovni. Zviditeľnenie reakcie je možné, až keď sondu označíme. Po rádioaktívnom označení, najčastejšie rádioizotopom 32P, sa hybridizačná reakcia dokáže autorádiografiou, t.j. reakciou rádioaktívneho fosforu (alebo iného rádionuklidu) s citlivou vrstvou filmu. Pretože rádioaktívne značené sondy sú drahé a zdravotne nebezpečné, v menej špecializovaných diagnostických laboratóriách sa nevyužívajú. Trend jednoznačne smeruje k nerádioaktívnym spôsobom značenia sond. Chemici z rôznych laboratórií odpovedali na túto odbornú výzvu a dnes už máme k dispozícii celú paletu postupov. Najčastejšie sa na nerádioaktívne značenie sond využíva biotín (vitamín H) (obrázek), digoxigenín a pod. Žiaľ, nerádioaktívne sondy sú menej citlivé, ale na druhej strane sú lacnejšie, nepredstavujú zdravotné riziko a sú stabilné niekoľko mesiacov, kým rádioaktívne sondy je potrebné označovať tesne pred ich použitím. Poznáme množstvo metodických postupov hybridizácie nukleových kyselín. Vzhľadom na metodickú nenáročnosť a rýchlosť sa v diagnostickej praxi často využíva metóda dot-blot hybridizácie (obrázek) s rôznymi technickými modifikáciami. Pri špeciálnych vyšetreniach je možné použiť aj in situ hybridizáciu (určenie lokalizácie DNA alebo RNA priamo v bunke) alebo Southern, resp. Nothern hybridizáciu (hybridizácia DNA, resp. RNA po jej štiepení a rozdelení elektroforézou). Aj keď odborná literatúra prináša množstvo dôkazov o úspešnom využívaní techniky hybridizácie nukleových kyselín pri vývoji diagnostických testov na vírusové, bakteriálne, parazitárne či iné infekcie, vývoj pokračuje ďalej.
Prerušme na chvíľu rozprávanie a zamyslime sa nad tým, čo sťažuje detekciu mikroorganizmov. Najčastejšie je to nedostatočné množstvo infekčného agensa v analyzovanej vzorke. V prípade hybridizácie nukleových kyselín je tento problém vyriešený vysokou citlivosťou testu. Keby však existovala možnosť zvýšiť množstvo genómu mikroorganizmu len chemickým postupom bez potreby kultivácie živých buniek, jeho dôkaz by bol oveľa jednoduchší. Veď spravidla čím viac je stanovenej látky, tým ľahšie sa dokazuje. Ukazuje sa, že molekulárni biológovia našli kľúč aj k riešeniu tohto problému. 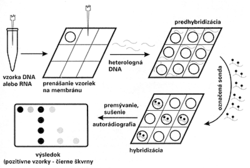
S možnosťou získavania krátkych syntetických fragmentov DNA na automatických DNA-syntetizátoroch sa do polovice 80. rokov začala prudko rozvíjať nová molekulárnogenetická technika -
PCR metóda
(polymerase chain reaction - polymerázová reťazová reakcia).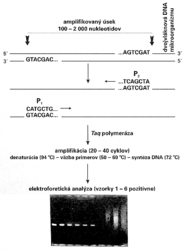 Nový, neobyčajne jednoduchý metodický postup umožňuje in vitro, t.j. v skúmavke, zmnoženie vybratého úseku dvojvláknovej DNA z nepatrného množstva (teoreticky aj z jednej molekuly) na množsto rádovo v oblasti nm - mm v priebehu 2 - 4 hodín. K amplifikácii DNA sú potrebné len dva krátke syntetické fragmenty DNA — primery — dlhé 20 - 25 nukleotidov, ktoré majú poradie nukleotidov zodpovedajúce koncom vybratého amplifikovaného úseku DNA. Primery sa spontánne hybridizujú k zodpovedajúcim sekvenciám nukleotidov vo vzorke DNA a po pridaní enzýmu Taq polymerázy sa stanú zárodkom (očkom) pre syntézu nového vlákna DNA (obrázek). Amplifikácia (zmnoženie) DNA sa dosahuje len jednoduchou cyklickou zmenou teploty reakčného roztoku, ktorá je dnes automatizovaná termocyklerom, bez potreby pridávania niektorej z reakčných zložiek. Po 20 - 30 cykloch je možné za 2 - 4 hodiny dosiahnuť 106 - 108násobné zmnoženie vybraného úseku DNA o dĺžke 100 - 2 000 nukleotidov. Keďže po zmnožení máme dostatočné množstvo fragmentu, jeho prítomnosť možno dokázať overením zvolenej fyzikálnej veľkosti (napr. elektroforézou, ktorá trvá len hodinu; obrázek). Podrobnosti o princípe a rôznom využití PCR metódy čitateľ nájde vo Vesmíre 69, 309, 1990/6 a 70, 629, 1991/11.
Nový, neobyčajne jednoduchý metodický postup umožňuje in vitro, t.j. v skúmavke, zmnoženie vybratého úseku dvojvláknovej DNA z nepatrného množstva (teoreticky aj z jednej molekuly) na množsto rádovo v oblasti nm - mm v priebehu 2 - 4 hodín. K amplifikácii DNA sú potrebné len dva krátke syntetické fragmenty DNA — primery — dlhé 20 - 25 nukleotidov, ktoré majú poradie nukleotidov zodpovedajúce koncom vybratého amplifikovaného úseku DNA. Primery sa spontánne hybridizujú k zodpovedajúcim sekvenciám nukleotidov vo vzorke DNA a po pridaní enzýmu Taq polymerázy sa stanú zárodkom (očkom) pre syntézu nového vlákna DNA (obrázek). Amplifikácia (zmnoženie) DNA sa dosahuje len jednoduchou cyklickou zmenou teploty reakčného roztoku, ktorá je dnes automatizovaná termocyklerom, bez potreby pridávania niektorej z reakčných zložiek. Po 20 - 30 cykloch je možné za 2 - 4 hodiny dosiahnuť 106 - 108násobné zmnoženie vybraného úseku DNA o dĺžke 100 - 2 000 nukleotidov. Keďže po zmnožení máme dostatočné množstvo fragmentu, jeho prítomnosť možno dokázať overením zvolenej fyzikálnej veľkosti (napr. elektroforézou, ktorá trvá len hodinu; obrázek). Podrobnosti o princípe a rôznom využití PCR metódy čitateľ nájde vo Vesmíre 69, 309, 1990/6 a 70, 629, 1991/11.
Metodická jednoduchosť a elegantnosť metódy PCR ju priam predurčuje na detekciu mikroorganizmov. Veď v porovnaní s metódou hybridizácie nukleových kyselín je výrazne jednoduchšia, citlivejšia, časove kratšia, nevyžaduje prácu s rádioaktívnym materiálom a možno ju automatizovať. Istým obmedzením je nutnosť poznať nukleotidovú sekvenciu aspoň časti genómu stanoveného mikroorganizmu. Existuje už množstvo prác, ktoré dokumentujú užitočnosť metódy PCR pri vývoji diagnostických testov na herpetické vírusy, HIV, cytomegalovírus, rôzne baktérie a iné mikroorganizmy. Keď si k amplifikácii vyberieme rôzne dlhé úseky DNA dvoch alebo troch typov mikroorganizmov, ktoré dokážeme elektroforeticky rozlíšiť, a pre každý mikroorganizmus máme špecifické páry primerov, metódou PCR je možné dokázať viac infekcií súčasne.
Citlivosť PCR testov je možné zvýšiť o niekoľko
radov v metodickom usporiadaní dvojitej PCR (nested PCR). Princíp metódy spočíva v tom, že po amplifikácii DNA metódou PCR sa produkt tejto reakcie (napr. DNA o dĺžke 300 bp) opäť amplifikuje v ďalšom teste PCR. Dôjde tým k dvojitej amplifikácii vybratého úseku DNA. Testy na princípe dvojitej PCR dokážu detekovať mikroorganizmy aj zo vzoriek, ktoré sú klasickým testom PCR negatívne, alebo diskutabilné.
Pri metóde PCR je nutné cyklovanie teploty reakčného prostredia (94 oC - denaturácia vzorky dvojvláknovej DNA, 50 - 60 oC - väzba primerov, 72 oC - optimálna teplota pre Taq-polymerázu pri syntéze nových vlákien DNA). Existuje však postup, pri ktorom amplifikácia DNA prebehne pri konštantnej izbovej teplote (!). Paradoxne sa pritom neamplifikuje DNA-vzorky, ale využíva sa
amplifikácia sondy.
Špecifická sonda sa nahybridizuje k stanovenej vzorke nukleovej kyseliny a nenaviazaná časť sondy sa odstráni. V ďalšom kroku sa uvoľní nahybridizovaná sonda zo vzorky, ale keďže je v malom množstve, ťažko sa dokazuje. Preto je potrebné ju namnožiť. Využíva sa pritom enzým QBeta-replikáza, ktorý je schopný už za 30 minút pri stálej teplote 20 oC amplifikovať sondu viac ako biliónkrát (napr. 0,14 fg nukleovej kyseliny zmnoží na 130 ng). Dôkaz takýchto obrovských množstiev nukleovej kyseliny nerobí žiadne problémy.
Novovyvíjané postupy diagnostická prax prijme iba vtedy, ak budú dokonalejšie ako doterajšie metodiky.
Aké výhody majú molekulárnogenetické testy?
Ako prvú výhodu uveďme možnosť diagnostiky infekčných chorôb na základe dôkazu genómu infekčného činiteľa bez potreby kultivácie buniek, pričom je zachovaná vysoká citlivosť a špecifickosť. Z tohto základného faktu sa odvíja ďalšia prednosť: infekčný proces je možné objaviť už v rannom štádiu, kedy môže byť lekársky zásah veľmi účinný. Výraznou výhodou takýchto testov je možnosť diagnostiky latentných stavov infekcií, kedy sú mikroorganizmy v pokojovom stave, takže mnohé klasické diagnostické testy sú nepoužiteľné. Využitie týchto metodík možno očakávať napr. u vírusov, ktoré sa ťažko množia na bunkových kultúrach alebo u mikroorganizmov potláčajúcich imunitnú odpoveď hostiteľa. Širšiemu využitiu nových postupov zatiaľ bráni nedostupnosť niektorých zložiek, ale to je prekážka, ktorej musia v čase svojho zrodu čeliť všetky nové metodiky.Domnievam sa, že molekulárnogenetické postupy napriek svojmu prudkému rozvoju nevytlačia úplne doterajšie, mnohokrát osvedčené testy mikroorganizmov. Pravdepodobne iba vhodne doplnia širokú paletu diagnostických metodík umožňujúcich detekciu mikroorganizmov na molekulárnej úrovni.
O autorovi
Štefan Vilček







