Věda pro život
4. 12. 2023Špičkoví vědci, nejlepší vybavení, zázemí excelentního vědeckého centra BIOCEV. I to je Biotechnologický ústav Akademie věd ČR. Místo, kde se pracuje na výzkumu léčby rakoviny, neplodnosti, neurologických onemocnění a výzkumu struktur proteinů a nukleových kyselin, které jsou zodpovědné za všechny biologické procesy v lidském těle.
Představit do detailu všechno, čemu se v BTÚ věnují, by vydalo na jedno samostatné číslo časopisu, proto se věnujme jen dvěma vybraným odlišným výzkumným směrům: výzkumu mitochondrií (Jiří Neužil) a strukturní biologii (Bohdan Schneider).
Mitochondrie:
Vice než „pouhý“ zdroj energie
Laboratoř molekulární terapie se již delší dobu zabývá rolí mitochondrií v nádorové biologii, a to zhruba ve 3 oblastech. První oblast má translační kontext, další 2 oblasti se týkají prioritně základního výzkumu.
Nosným prvkem výzkumu byla otázka využití mitochondrií jako molekulárního cíle pro inovativní terapii nádorových onemocnění. Zprvu se soustředili na látku sukcinát vitamin E (VES), který se ukázal jako relativně účinná protirakovinná látka pro více typů nádorů v myších modelech včetně velmi těžce léčitelných nádorů, jako je nádor pohrudnice (mezoteliom). Zjistili, že v rámci mitochondrií VES snižuje funkci mitochondriálního respiračního komplexu II, v důsledku čehož jsou rakovinné buňky nuceny tvořit reaktivní formy kyslíku (zejména superoxidu), který v nich selektivně vyvolává kaskádu reakcí vedoucí k jejich apoptotické smrti. Protože molekulární zásahové místo pro VES je v mitochondriích, rozhodli se modifikovat tuto látku pomocí malé pozitivně nabité skupiny (trifosfonium), která výrazně zvyšuje koncentraci látky v mitochondriích a zvyšuje její protirakovinnou účinnost a selektivitu pro nádorovou tkáň. Takto vytvořili mitochondriálně cílený sukcinát vitamin E (MitoVES). Tento postup posléze aplikovali na tamoxifen, kdy připravili mitochondriálně cílený tamoxifen (MitoTam). V porovnání s původní látkou měl MitoTam výrazně vyšší účinek a selektivitu pro rakovinné tkáně, jakož i širší spektrum nádorů, vůči nimž byl toxický. Například na rozdíl od tamoxifenu výrazně potlačoval trojnásobně negativní rakovinu prsu u myšího modelu. Na rozdíl od VES a MitoVES působí MitoTam na komplex I systému OXPHOS. V nedávné době realizovali první fázi klinického hodnocení látky MitoTam, která se ukázala velmi účinná v případě nádoru ledvin.
Strukturní biologie
Hlavním tématem strukturní biologie je zkoumání, jak souvisí struktura biomolekul s jejich funkcemi, takzvané vztahy struktura–funkce. Biomolekulární struktury jsou důležité v různých oblastech obecné biologie, jako jsou evoluční studie či imunologie, ale i ve specializacích s komerčně uplatnitelnými výsledky, jako je enzymologie a návrh léčiv. V BTÚ stanovují struktury molekul zejména krystalograficky a nově i metodou kryoelektronové mikroskopie (cryo-EM). Následující příklady ukážou, jak je možné využívat metody strukturní biologie v praxi.
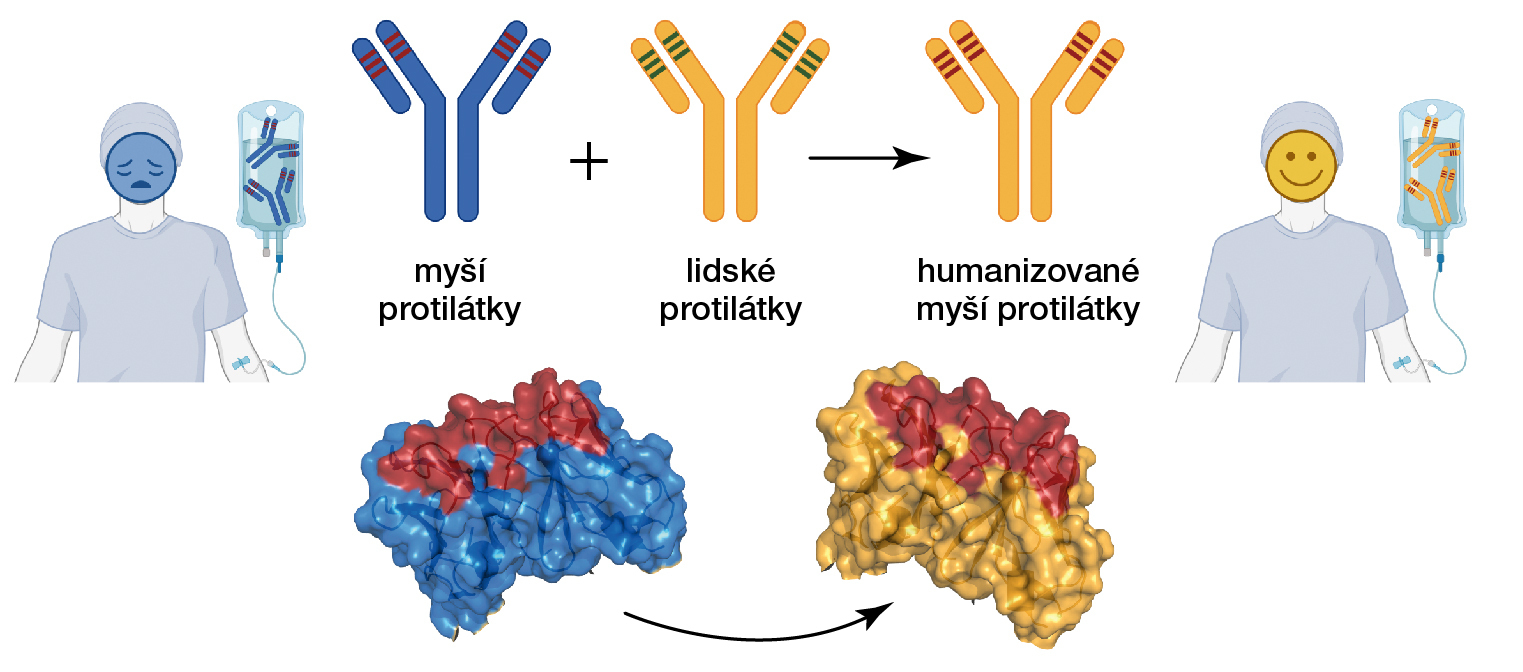
Humanizace protilátek
Protilátky, bílkovinné molekuly produkované buňkami imunitního systému, slouží jako obrana proti cizorodým látkám nepřátelským vůči danému organismu. Za účelem vývoje nových léků a terapeutických postupů jsou protilátky primárně získávány z imunitních buněk myší; tyto mohou být v laboratořích dále upravovány pomocí postupů proteinového inženýrství. Komplikovaný proces proteinového inženýrství je výrazně usnadněn díky znalosti trojrozměrné struktury dané protilátky, kterou vědci odhalují pomocí metod strukturní biologie. Laboratoře BTÚ vytvořily tzv. humanizované („polidštěné“) protilátky, které lze využít k zobrazování a léčbě nádorů prostaty. Při procesu humanizace byly sekvence původních myších protilátek nahrazeny lidskými sekvencemi, což omezuje nežádoucí vedlejší účinky původních protilátkových molekul. Obrázek 2 ilustruje tento proces.
Nové mechanismy rezistence bakterií vůči antibiotikům
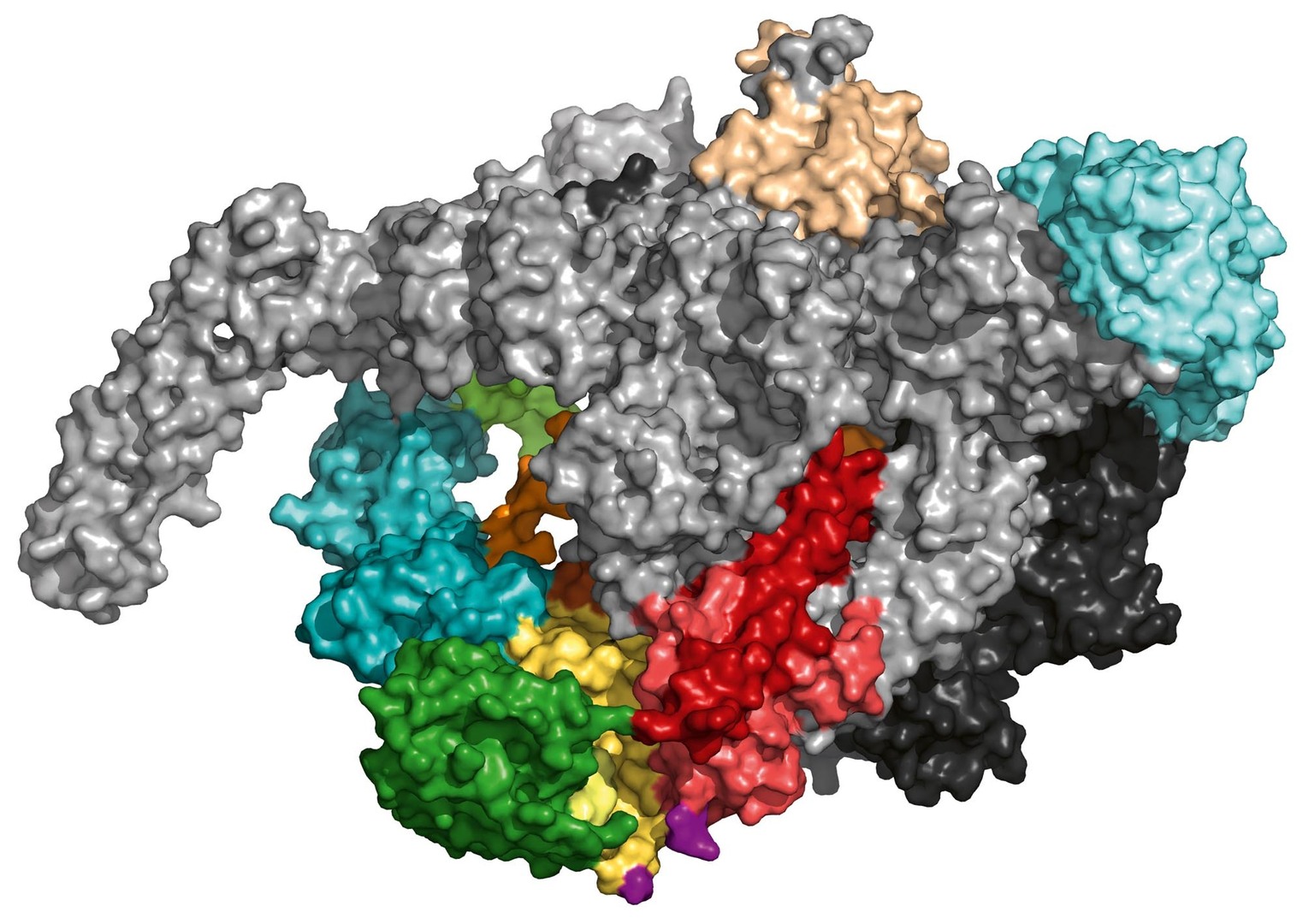
Bakterie způsobující závažná onemocnění často odolávají působení antibiotik a využívají přitom několik známých mechanismů. Jedna z tříd bakterií, mykobakterie, způsobuje závažná onemocnění, jako jsou tuberkulóza nebo malomocenství, a k jejich léčbě se využívá antibiotikum rifampicin. Pomocí nástrojů molekulární a strukturní biologie se podařilo prokázat novou unikátní interakci mezi RNA-polymerázou (obr. 3), zodpovědnou za syntézu RNA uvnitř bakterie, a doposud málo popsaným proteinem HelD. HelD umí odstranit z kanálů polymerázy DNA i RNA, a tak případně odblokovat zastavenou syntézu RNA, ale současně mění tvar vazebné kapsy pro rifampicin. Tím komplikuje jeho vazbu a umožňuje mykobakterii uniknout inhibici rifampicinem. Tyto poznatky vedou k lepšímu pochopení nových mechanismů rezistence bakterií vůči léčivům a zároveň naznačují nové možnosti boje proti bakteriální rezistenci.
Strukturní biologie cytokinů
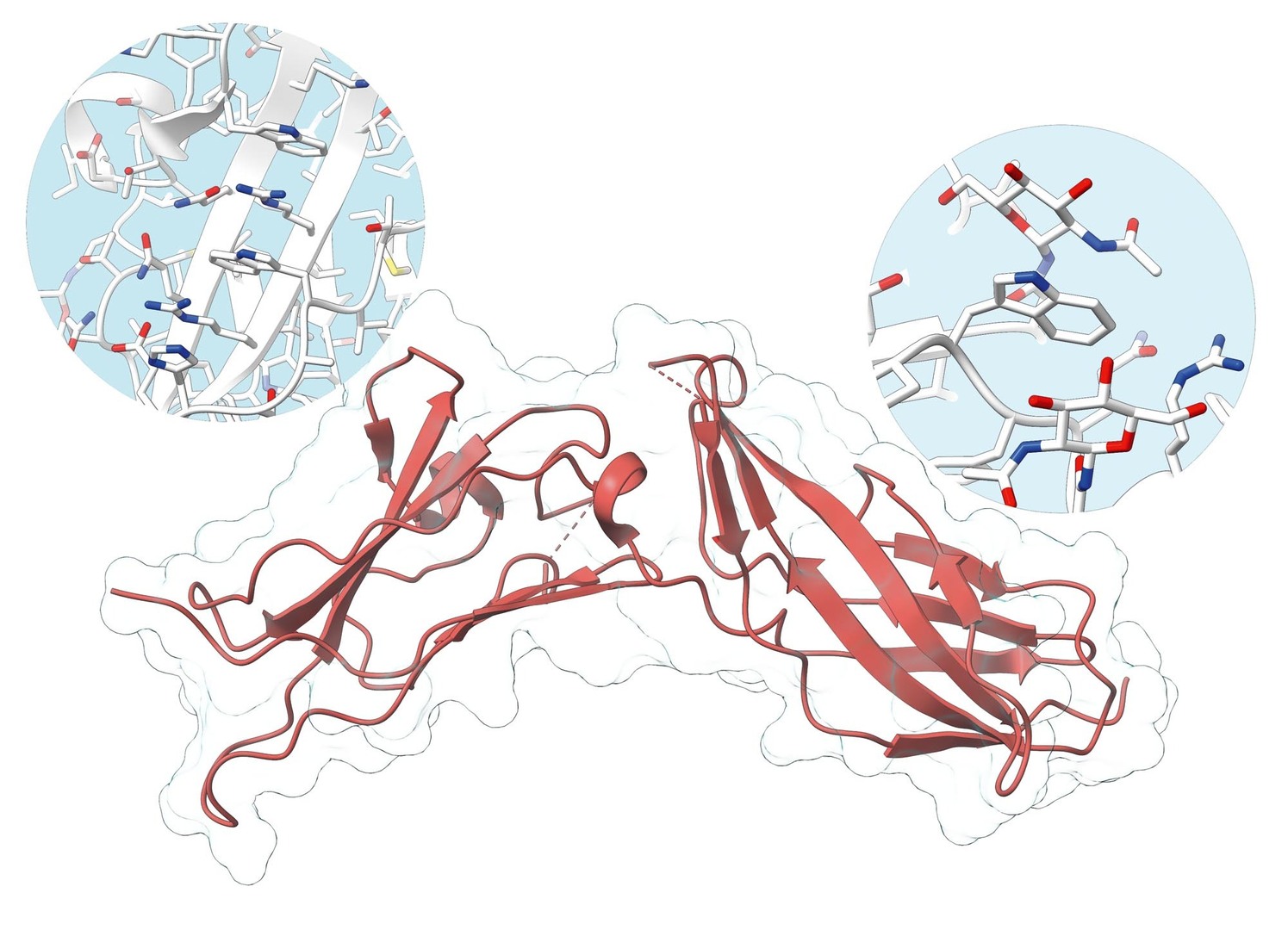
V laboratoři biomolekulárního rozpoznávání se zabývají strukturními vlastnostmi signálních proteinů, obecně známých jako cytokiny. Tyto molekuly hrají zásadní úlohu v imunitním systému obratlovců včetně člověka. Jedním z cytokinů, které zkoumají, je interferon gama (IFN-γ). Všechny cytokiny včetně IFN-γ signalizují po navázání na buněčné receptory. IFN-γ se váže na dva specifické receptory, receptor 1 a receptor 2, a právě dosud neznámou strukturu lidského receptoru 2 se podařilo vyřešit. Tato struktura odhalila důležité motivy stabilizující tuto molekulu. Obrázek 1 schematicky ukazuje hlavní řetězec receptoru 2 lidského IFN-γ (červeně) s indikací proteinového povrchu. Stabilizující motivy jsou zdůrazněny ve světle modrých kruzích.
Ke stažení
 článek ve formátu pdf [461,19 kB]
článek ve formátu pdf [461,19 kB]