Buněčné vypínače imunitní reakce
| 31. 1. 2022Přestože všechny buňky v našem těle obsahují stejnou genetickou informaci, je na základě této identické sekvence DNA vytvořeno množství funkčně i morfologicky naprosto rozdílných tkání. To, že neurony vypadají jinak než buňky jater, že buňky žaludku produkují trávicí enzymy, zatímco buňky sítnice oka tvoří světelné receptory a bílé krvinky zase protilátky, je dáno rozdílnou aktivací jednotlivých genů.
Instrukce, které geny mají být aktivovány, dostávají buňky převážně od ostatních buněk ve svém okolí, a to ve formě speciálních signálních proteinů. Pomocí těchto proteinů spolu buňky komunikují a předávají si informace například o dostupnosti živin, o poškození nebo o blížícím se nebezpečí. Navázání signálních proteinů na patřičné receptory spouští v buňkách kaskádu biochemických reakcí, vedoucích v konečném důsledku k zapnutí či vypnutí určitých genů. Komplexní charakteristiky, kterými jsou například tvar a funkce buňky, jsou výsledkem zpracování tisíců různých signálů, které na buňku současně působí, navzájem se ovlivňují, a vytvářejí tak jedinečnou kombinaci biochemických dějů řídících identitu našich buněk a správnou funkci orgánů.
Jedním z fyziologických procesů, pro který je zásadní správná regulace pomocí malých signálních proteinů, je produkce krevních buněk neboli hematopoéza. Při tomto procesu vzniká z hematopoetických kmenových buněk v kostní dřeni člověka každou sekundu ohromujících deset milionů nových krvinek. Signály, které si mezi sebou buňky předávají, přinášejí informaci o tom, jaké druhy krvinek a v jakém množství budou z kmenových buněk vznikat. Regulace počtu jednotlivých druhů krvinek je zásadní pro správné fungování našeho organismu a každé větší odchýlení má za následek poměrně vážné zdravotní komplikace, jako je například anémie, leukemie či poruchy srážlivosti krve.
Na druhou stranu ale musí být krvetvorba dostatečně plastická, aby se dokázala vypořádat se situacemi, které dočasnou změnu počtu krevních buněk vyžadují. Příkladem takové situace může být infekce, při níž se zvýší spotřeba buněk přirozeného imunitního systému, konkrétně tzv. granulocytů, které představují první linii obrany našeho organismu (Vesmír 95, 688, 2016/12). Během infekce jsou v našem těle vyplavovány signální proteiny, které vedou k zvýšení produkce granulocytů z hematopoetických kmenových buněk. Tyto nově vyprodukované, specializované krvinky se urychleně a ve velkých počtech přesunují do infikovaného místa, spouštějí zánětlivou reakci a eliminují patogeny. Obdržení a zpracování signálů o nebezpečí a zvýšené potřebě granulocytů ze strany hematopoetických kmenových buněk je tedy zásadní pro úspěšné odstranění infekce.
Jedna z buněčných signálních drah regulujících funkci kmenových buněk se nazývá Wnt – podle anglického názvu genu wingless. Tento gen byl prvně identifikován u octomilek, u kterých jeho mutace způsobuje ztrátu křídel. Jak už to ale v evoluci bývá, jiné organismy našly pro tuto dráhu také jiná využití – například regulaci krvetvorby.
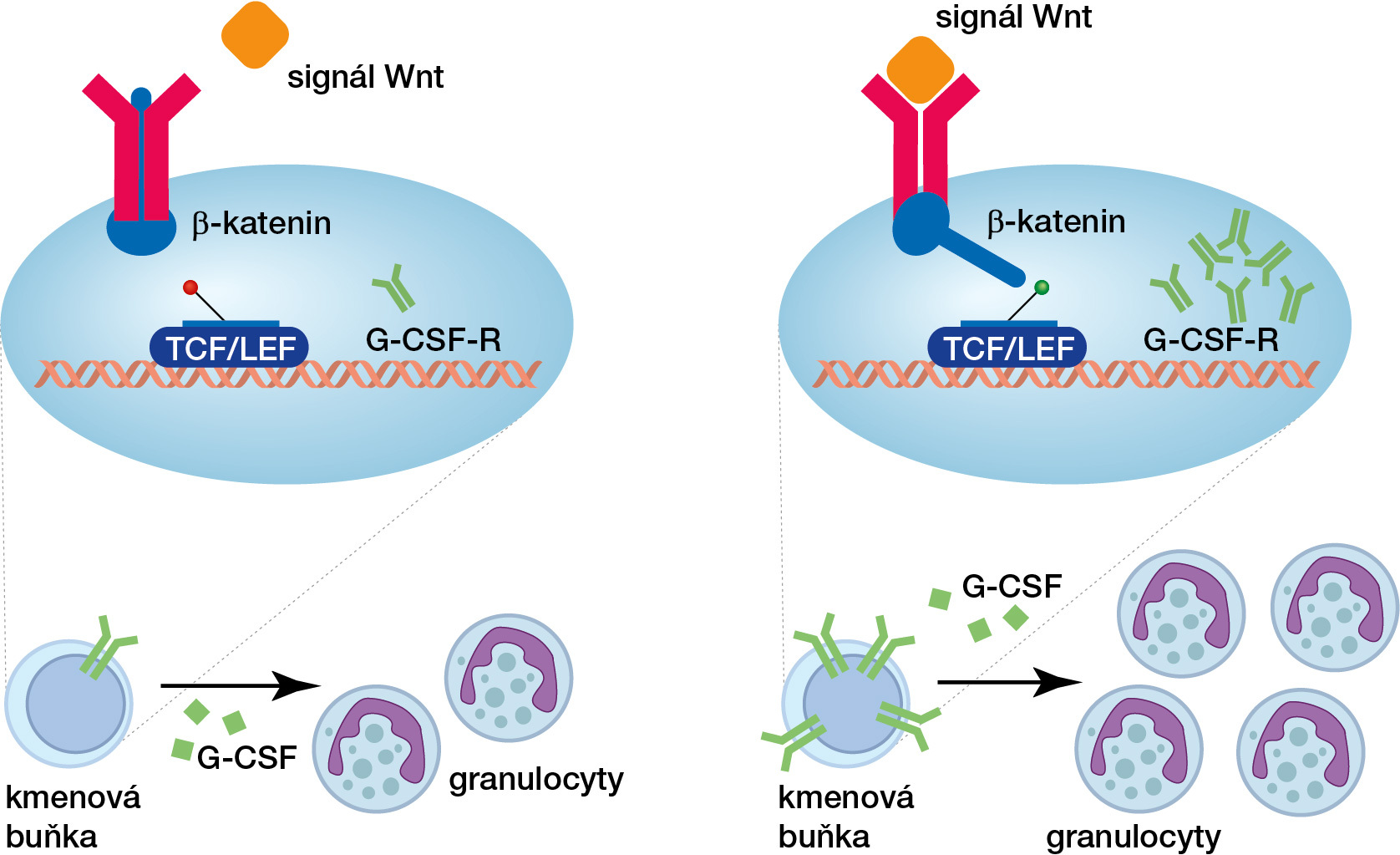
Signální dráha Wnt ovládá aktivitu cílových genů prostřednictvím proteinů TCF/LEF, které si můžeme představit jako molekulární vypínače sedící na patřičných místech DNA. Geny kontrolované těmito vypínači zůstávají neaktivní až do doby, kdy jsou TCF/LEF biochemicky zapnuty. Signál k zapnutí většinou poskytuje sousední buňka prostřednictvím malého proteinu Wnt. Buňka, která Wnt signál zachytí, začne rychle produkovat protein β-katenin, který se naváže na TCF/LEF, a tím ovládané geny zapne.
Abychom mohli úlohu této signální dráhy v krvetvorném systému studovat, museli jsme vytvořit zcela nový myší model. Pomocí genetického zásahu jsme v krevních buňkách upravili proteiny TCF/ LEF takovým způsobem, aby je β-katenin nemohl přepnout do aktivního modu.1) Analýzou krevních buněk takto upravených myší jsme zjistili, že jejich hematopoetické kmenové buňky produkují podstatně méně granulocytů. Podobné onemocnění, charakteristické sníženými počty granulocytů, se vyskytuje i u lidí. Jedná se o tzv. neutropenii a pacienti, kteří tímto onemocněním trpí, mají značně sníženou obranyschopnost a trpí často se opakujícími, obtížně léčitelnými infekcemi. Tuto sníženou obranyschopnost jsme pozorovali i u našich experimentálních myší – infekce, které myši normálně dokážou relativně dobře snášet, byly pro naše experimentální myši fatální.
Následná analýza ukázala, že jedním z genů, který je prostřednictvím vypínačů TCF/ LEF a β-kateninu za normálních podmínek aktivován, je receptor pro malý signální protein G-CSF, jenž hematopoetickým kmenovým buňkám dává velmi silný impulz k tvorbě granulocytů. V průběhu vážných mikrobiálních infekcí je náš krevní systém molekulou G-CSF doslova zaplavený. Kmenové buňky, které na svém povrchu nemají tento receptor, jako např. kmenové buňky myší s nefunkční dráhou Wnt, pak logicky nemohou na přítomnost G-CSF adekvátně reagovat a zprostředkovat tak organismu dostatečnou imunitní ochranu v podobě dostatečného počtu granulocytů. Přijetí, správné zpracování signálu Wnt a zapnutí vypínačů TCF/LEF umožňuje kmenovým buňkám sestavení receptoru pro signální molekulu G-CSF. Buňky s takto vystaveným receptorem jsou připraveny a čekají na případnou stimulaci, značící ohrožení organismu a nutnost jednat – tedy produkovat nové granulocyty.
Výsledky našeho výzkumu představují malou ukázku toho, jak důležitá je mezibuněčná komunikace a jak jednotlivé signály a jejich vzájemné kombinace v populacích tak vzácných, jako jsou kmenové buňky kostní dřeně, dokážou ovlivnit sílu imunitní odpovědi a obranyschopnost celého organismu.
Poděkování: Autoři článku a jejich práce jsou financováni Grantovou agenturou České republiky (GA ČR 17-02177S) a Ústavem molekulární genetiky AV ČR (RVO 68378050).
Poznámky
1) Danek P. et al.: Blood, 2020, DOI: 10.1182/blood.2019004664.
Ke stažení
 článek ve formátu pdf [302,29 kB]
článek ve formátu pdf [302,29 kB]