100 let s inzulinem
Je 11. ledna 1922 a čtrnáctiletý Leonard Thompson leží v těžkém stavu s diabetem v torontské nemocnici. Čekala by ho jistá smrt, kdyby… Kdyby mu lékaři jako prvnímu pacientovi na světě nepodali hormon získaný z pankreatického extraktu – inzulin. Determinující a hvězdná chvíle diabetologie slaví sté výročí.
Tímto úspěchem vyvrcholilo dlouhé a náročné hledání účinné látky, která by mohla zvrátit nepříznivý průběh do té doby smrtelného onemocnění, dnes označovaného jako diabetes mellitus 1. typu.
Diabetes mellitus je syndrom charakterizovaný chronickým vzestupem hladiny krevního cukru, glykemií. Ten je spojen s vylučováním glukózy do moči, vyšším objemem moči (polyurií), dehydratací a poruchami vnitřního prostředí. Vede ke ztrátě tělesné hmotnosti a může skončit smrtí.
Traduje se, že poprvé bylo onemocnění s příznaky diabetu popsáno již před 3500 roky v Ebersově papyru, nalezeném v thébské nekropoli nedaleko Luxoru. Pravděpodobně ve stejné době ale už onemocnění znali lékaři orientu. Ve starověké Indii bylo známo v 5. století př. n. l. jako madhumea, tedy medová moč lákající mravence. Pojmenování diabetes zavedl Araeteus z Kapadocie (81–138 n. l.), popisoval ho i jiný významný starověký lékař Galénos.
Samotná etymologie slova diabetes, pocházející z řeckého διαβήτης (výlevka, sifon), vychází z představy, že se tělesná substance rozpouští ve vodu a tato životadárná tekutina opouští tělo, které se tak ztrácí skrze sebe samého. Ve starověké Číně popsal Čang Čung-ťing (asi 160–219) polyurii, polydipsii (nadměrnou žízeň) a ztrátu hmotnosti jako zvláštní chorobu. Sladkou moč pozoroval Čchen Čchuan v 7. století.
Středověkých evropských zpráv o diabetu je minimálně. V 11. století však perský lékař Ibn Síná (Avicenna, 980–1037) ve svém díle Kánon medicíny popisuje diabetes a zmiňuje gangrénu a sexuální dysfunkci s ním spojenou. Židovsko-hispánský filosof, právník a lékař z Córdoby Moše ben Majmon (Maimonides, 1138–1204) uvádí přesnější popis diabetu včetně acidózy. Až ve čtyřicátých letech 17. století popsal Thomas Willis, lékařský polyhistor tehdejší politicky bouřlivé anglické doby, sladkou chuť moči u některých pacientů s polyurií. Snad již on nazval tento typ diabetu mellitus, tedy medový.
V roce 1685 provedl Švýcar Johannes Conrad Brunner sérii pokusů, ve kterých odstranil psům slinivku břišní (pankreas). Dobře si všiml polyurie, polydipsie i tělesného chátrání, tedy dobře známých příznaků diabetu, oba stavy však spolu nespojil. V té době mu ještě chybělo širší předporozumění vztahu mezi slinivkou a regulací hladiny cukru, o kterém se začalo diskutovat až v 19. století. V polovině 18. století nalezl v moči diabetických pacientů cukr Mathew Dobson. Tak byl přesněji popsán významný příznak diabetu.
Pochopení významu slinivky
Zakladatel moderní experimentální fyziologie Claude Bernard poznal v polovině 19. století význam jaterního glykogenu (glykogenní substance) a jeho roli v udržení glykemie na lačno. Popsal také v experimentu vliv slinivky na trávení. Bernard se však domníval, že příčina diabetu leží v autonomním nervovém systému. Jeho úvahy vycházely z pokusů na zvířatech, při nichž in vivo stimulací 4. komory mozkové (fakticky ale lézí nervus vagus, tedy parasympatikolýzou) vyvolával vzestup glykemie, kterou následně snižoval míšní lézí nad odstupy sympatických nervů.
O dvě desetiletí později, v roce 1869, popsal Paul Langerhans ve své doktorské práci, že ve žlázovém epitelu slinivky břišní se vyskytují i zcela jiné struktury, které popsal jako ostrůvky. Netušil, jaký dosah jeho nález má. Po promoci pracoval v berlínském patologickém ústavu pod vedením svého učitele, legendy patologie 19. století Rudolfa Virchowa. Bohužel se, tak jako mnoho jiných patologů, nakazil tuberkulózou, pročež se odebral na Madeiru s nadějí, že mu tamní klima v léčení pomůže.
Étienne Lancereaux, francouzský lékař působící v Paříži, později jmenovaný prezidentem Národní lékařské akademie, byl první, kdo ve svých úvahách propojil slinivku břišní a diabetes. Teprve on v roce 1880 poprvé popsal dva základní klinické obrazy diabetu: le diabete maigre (hubený), který se při autopsii vyznačuje atrofickou slinivkou, a le diabete gras (tučný), který má naopak slinivku intaktní a také má mnohem lepší prognózu. Tyto obrazy odpovídají v dnešní klasifikaci diabetu prvního a druhého typu. Sám uzavíral, že diabetes není choroba, ale syndrom charakterizovaný přítomností glukózy v moči (glykosurií). Lancereauxovým žákem byl Nicolae Paulescu, o kterém ještě uslyšíme.
Zásadním přelomem v porozumění vzniku diabetu 1. typu, ke kterému došlo devět let po Lancereauxeově popisu, se stala pankreatektomie (odstranění slinivky) u psa, kterou provedli v roce 1889 ve fyziologickém ústavu lékařské fakulty Univerzity ve Strasburku Oskar Minkowski a Joseph von Mehring. Původně se pro odstranění pankreatu rozhodli proto, že chtěli studovat jeho důsledky pro trávení a vstřebávání. Pankreas je totiž zdrojem trávicí šťávy obsahující významné enzymy podmiňující trávení sacharidů, lipidů i proteinů. Po provedení pankreatektomie experimentální pes projevoval známky polyurie, únavy, apatie a posléze byla v jeho moči nalezena glukóza. Tím se prokázalo, že slinivka je důležitá pro udržování hladiny glukózy v krvi a že porucha její funkce vede k diabetu.
Následovalo období hledání způsobu, jak ze slinivky získat látku regulující hladinu glukózy v krvi. K tomu významně přispěl pokus ruského fyziologa Leonida V. Soboleva, publikovaný v roce 1901. Sobolev se rozhodl u pokusných psů podvázat pankreatický vývod (ductus pancreaticus). To se mu zdařilo a sledování pokusných psů ukázalo, že k diabetu nedošlo. To byl zásadní důkaz, že faktor ovlivňující hladinu glukózy v těle musí být vylučován endokrinně. Tento princip byl tehdy již dobře znám – postuloval ho Addison v polovině 19. století.
Jak extrahovat účinnou látku?
Sobolevovo zjištění odstartovalo řadu pokusů účinnou látku získat. Psi, u kterých byl vznik diabetu navozen odnětím pankreatu (pankreatektomií), dostávali krev získanou z žíly odvádějící krev ze slinivky do portální žíly a jater (vena pancreaticoduodenalis) psů zdravých. Taková krev zvýšenou glykemii skutečně poněkud snižovala. Jiné pokusy vedly k použití extrakce varem či kyselými roztoky. Těmito postupy se bohužel účinná látka nezískala. Není divu: tehdy se totiž nevědělo, že hormon má proteinovou strukturu. Pankreas obsahuje velké množství proteáz, které proteiny po aktivaci destruují. Strukturu proteinů poškozovala i vysoká teplota používaná při extrakci či příliš nízké pH extrakčního roztoku.
V roce 1909 Belgičan Jean de Meyer poprvé užil termín inzulin, který se však rozšířil až o dekádu později. Nejdále v pokusech na psech došli německý lékař Georg Ludwig Zuelzer v roce 1906, americký biochemik Israel Kleiner, který v roce 1919 prokázal, že pankreatický extrakt vede k hypoglykemii, a také rumunský fyziolog Nicolae Paulescu. Paulescu byl slibným Lancereauxovým žákem v Paříži, kde vystudoval a nastoupil na pozici chirurgického asistenta v nemocnici Notre-Dame du Perpétuel-Secours. Později se vrátil do rodné Bukurešti, kde přijal místo profesora medicíny a vedoucího ústavu fyziologie na tamní univerzitě. V roce 1916 popsal účinek vodních extraktů bovinního pankreatu. Brzy poté byl však povolán do armády.
Během války se medicína orientovala především na léčbu traumat a infekcí. Po válce se Paulescu opět snažil získat ze slinivky extrakt, což se mu podařilo díky tomu, že experimentálnímu psovi podvázal pankreatický vývod, ve žláze došlo k atrofii a Paulescu atrofický pankreas vyjmul a extrahoval z něj účinnou látku. Extraktem dovedl významně snížit glykemii u jiných diabetických psů. Svůj objev publikoval v létě roku 1921 ve významném francouzsky psaném fyziologickém časopise. Jak sám v článku uvádí, jeho extrakt (pojmenovaný pancrein) nebyl v době publikace vhodný k podání lidem, protože už u psů vyvolával toxické účinky.
V Kanadě měl mezitím dost času na úvahy o tom, jak získat inzulin ze slinivky, Frederick Banting (obr. 1), devětadvacetiletý lékař a navrátilec ze světové války. Jeho původní cíl stát se kvalifikovaným ortopedem se nenaplnil, proto pracoval jako všeobecný praktik a také vyučoval na Lékařské fakultě ve městě London v západním Ontariu. Při přípravě na výuku se mu na podzim 1920 dostal do ruky článek amerického chirurga Mosese Barrona, který popisoval atrofii pankreatu po blokádě pankreatického vývodu žlučovými kameny a navrhl možnost atrofie pankreatu po podvázání pankreatického vývodu. V noci poté, co článek četl, Bantinga napadlo, že atrofie zevně sekretorické části pankreatu navozená podvázáním pankreatických vývodů by mohla ušetřit vnitřně sekretorickou část a dovolit snadněji extrahovat hormon po pankreatektomii provedené o několik týdnů později.
Torontský úspěch
Na jaře 1921 Banting vyhledal přednostu fyziologického ústavu v Torontu Johna Macleoda s žádostí o poskytnutí místnosti, deseti psů a jednoho pomocníka z řad studentů medicíny. Přestože se Macleod zpočátku zdráhal, nakonec prostory a psy Bantingovi poskytl. Dodnes je záhadou, jak mohl Macleod nechat volnou ruku neznámému Bantingovi a uvěřit, že tento praktický lékař bude schopen toho, co se v posledních patnácti letech nepodařilo velkým lékařským osobnostem z celého světa.
Pomocníkem se Bantingovi stal jedenadvacetiletý Charles Best (obr. 1). Prvního psa operovali 16. května 1921, první pankreatektomii slinivky s atrofickou zevně sekretorickou částí provedli 27. července. Ze žlázy pomocí fyziologického roztoku získali extrakt, který u psa po pankreatektomii vedl k významnému poklesu glykemie.
Druhá polovina roku 1921 byla vyplněna pokusy zlepšovat efektivitu extrakce a podáváním extraktu psům s experimentálním diabetem. Důležitý posun přineslo použití extraktů z pankreatu čtyřměsíčních telecích plodů. Kvalitu extraktu významně ovlivnil chemik James Bertram Collip. Bez jeho přístupu k izolaci a purifikaci pomocí alkoholu a acetonu by standardizace dávky a bezpečné podání nebyly možné. Mimochodem byl to Collip, kdo definoval jednotku inzulinu, se kterou pracujeme dodnes. Jednotka, původně nazývaná „králičí jednotka“, byla definována jako jedna třetina množství inzulinu, které během pěti hodin vyvolalo u králíka o hmotnosti 2 kg hypoglykemické koma (pokles glykemie ze 116 na 45 mg/dl). Tato biologická zkouška se u každé várky inzulinu používala ještě dlouhou dobu i v průmyslové výrobě.
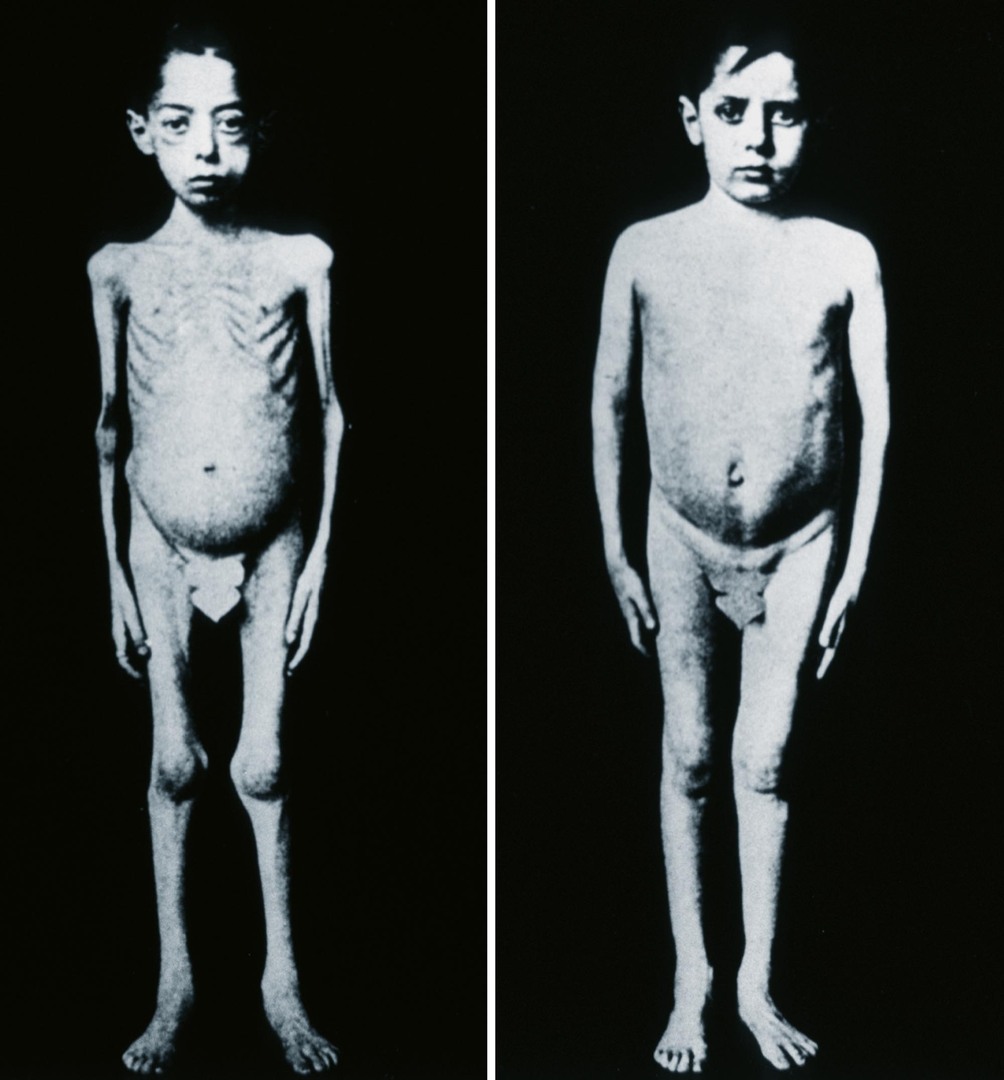
Legendární se stala fena Marjorie, která po odstranění pankreatu žila díky aplikaci těchto extraktů 70 dnů. Byl to zásadně důležitý krok k tomu, aby byl inzulin (původně týmem pojmenován jako Macleodovo sérum) 11. ledna 1922 podán prvnímu nemocnému, čtrnáctiletému Leonardu Thompsonovi (obr. 2), který se ocitl v těžké diabetické ketoacidóze. Leonard byl prvním člověkem zachráněným podáním inzulinu od jisté smrti. Žil pak ještě třináct let, a kdyby nezemřel na zápal plic, žil by zřejmě mnohem déle. Brzy poté byly inzulinem léčeny desítky (především dětských) pacientů s diabetem (obr. 3).
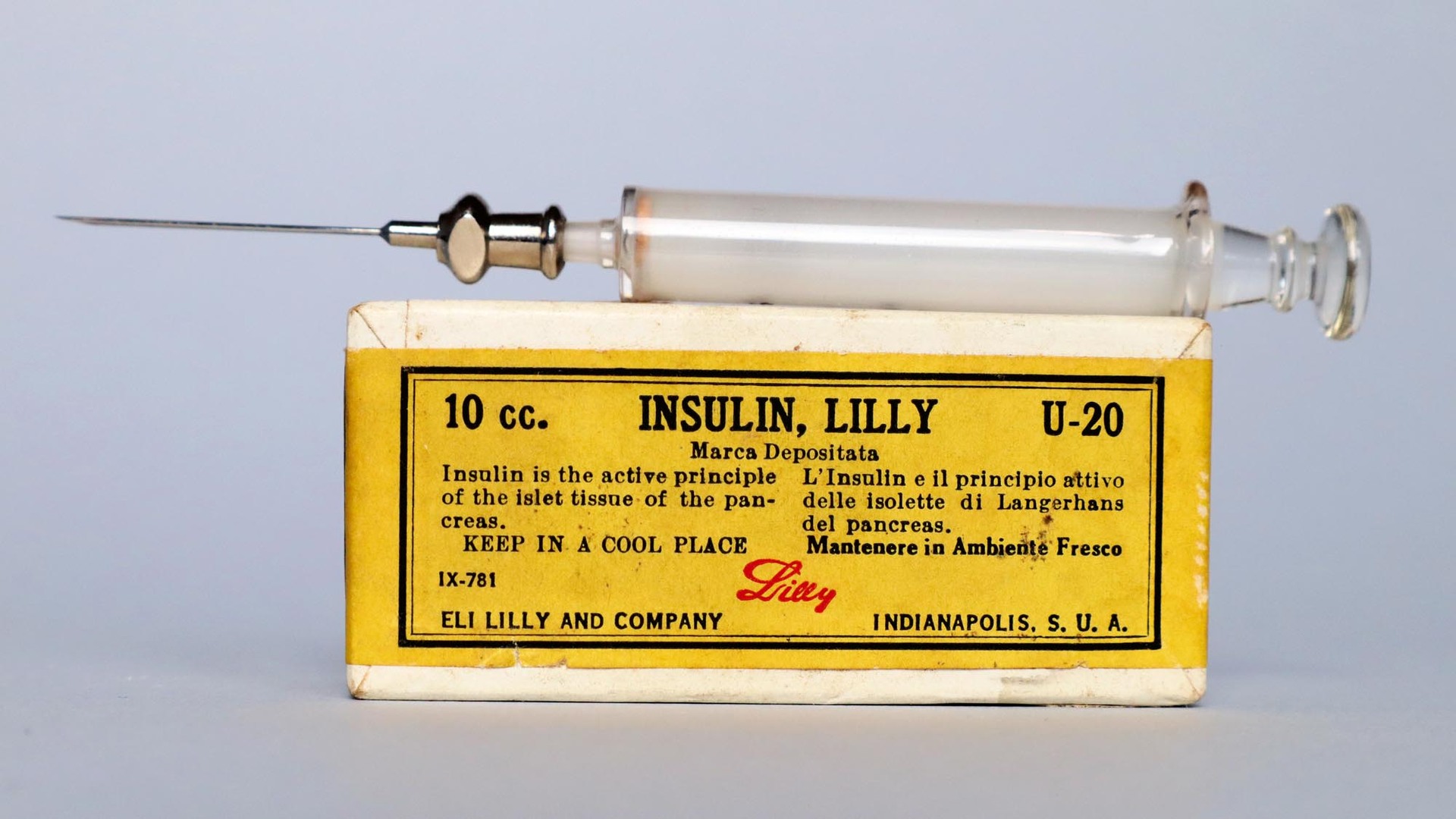
Krátce po úspěšném léčení prvního nemocného byla Torontská univerzita zavalena žádostmi nešťastných rodičů o poskytnutí látky, která brzy dostala jméno inzulin. Univerzita již na jaře 1922 prodala práva k výrobě inzulinu nejprve firmě Eli Lilly z Indianopolis, krátce nato i dánské firmě Novo a německé společnosti Hoechst. Proces purifikace spočívající v izoelektrické precipitaci a krystalizaci, který vyvinuli chemici Eli Lilly (zejména George Walden), byl průlomovým objevem na cestě k průmyslové produkci inzulinu. V roce 1923 byl inzulin již průmyslově vyráběn v Indianopolis, Kodani a Frankfurtu.
U nás byl inzulin poprvé aplikován MUDr. Červenkou a MUDr. Kleinem již v roce 1923 na 1. interní klinice Všeobecné nemocnice a Lékařské fakulty Karlovy univerzity. Inzulin tehdy přivezl pro pacienta z Paříže dr. Aleksandar Gjurič (pozdější profesor, v roce 1944 popravený nacisty) a u postele pacienta stáli mladý MUDr. Josef Charvát, budoucí zakladatel české endokrinologie,1) a medik Jiří Syllaba, budoucí zakladatel české diabetologie. Vilém Laufberger jako první v Československu připravil v roce 1924 purifikovaný inzulin.
Objev inzulinu měl pochopitelně spoustu ohlasů v denním i odborném tisku. Díky tomu se diabetici 1. typu na celém světě dozvěděli o naději, že se jejich život může významně prodloužit. Leonard Thomson by bez inzulinu žil snad další měsíce, možná jeden rok, velmi nepravděpodobně dva. Paul de Kruif, autor slavné knihy Bojovníci se smrtí, považoval v roce 1930 objev inzulinu za jeden ze tří vůbec největších objevů v oblasti medicíny. Není se co divit, že Banting a Macleod byli již v roce 1923 vyznamenáni Nobelovou cenou. Na Besta se nedostalo, byl medik, a Collip inzulin sice vyčistil, ale nebyl při původní koncepci. Banting a Macleod se však s nimi o finanční část odměny podělili.
Nobelova cena za objev inzulinu byla zpochybněna jak Paulescem, tak Zuelzerem, kteří si kladli nárok na prvenství objevu. Ale až lidé z týmu v Torontu dovedli metodu do formy vhodné k použití v humánní medicíně. Dost možná ale také díky vědomí, že toxické účinky inzulinu mohou být symptomy hypoglykemie a při svých pokusech se psy měli vždy připraveny sladkosti k podání.
Torontský příběh není příběhem jednoho průlomového objevu. Na jedné straně vypráví historii toho, jak úsilí řady výzkumných týmů z celého světa trvající celé dekády postupně připravilo podmínky, které takový objev umožnily. Na druhé straně je však také příběhem o tom, že vědeckého úspěchu mohou dosáhnout i začátečníci, kteří mají jasný nápad, víru v úspěch, schopnost tvrdě pracovat i spolupracovat s odborníky z jiných oborů (v tomto případě především s chemikem). K faktorům, které znamenaly úspěch, patří použití atrofované žlázy, průběžné měření glykemie u pokusných zvířat, použití nové, výrazně citlivější metody (stačilo pouhých 200 μl krve) umožňující častější měření, vědomí možného hypoglykemického komatu a jeho management (sladkosti připravené pro psy) a v neposlední řadě nová technika izolace a purifikace extraktu z fetálních telecích slinivek.
John Abel a E. M. K. Gelling se mezi roky 1924 a 1927 zabývali krystalizací nedávno objeveného inzulinu, stanovili jeho souhrnný vzorec a vypočetli jeho molekulovou hmotnost. Ti, kteří v dalších letech uvažovali o tom, jak inzulin dále zpracovávat, tedy jak ho izolovat, adjustovat a podávat, vyšli právě z jejich prací. Inzulin bylo nutné objevit a víme, že bez Bantinga a Besta, Macleoda a Collipa by to nešlo, ale poté bylo do mozaiky třeba přidat mnoho dalších kamínků.
Kolik je inzulinu v plazmě?
V roce 1958 v nemocnici pro veterány v newyorské čtvrti Bronx publikovali dva tamější pracovníci, Solomon Berson a Rosalyn Yalowová, princip radioimunoeseje pro inzulin, který se tak stal první molekulou stanovenou pomocí tohoto nového principu. Právě díky této metodě, později často nahrazené imunoesejemi, můžeme stanovit hladinu inzulinu či části jeho molekuly (C-peptidu) v plazmě. To je důležité za nejrůznějších okolností jak ve zdraví – po konzumaci jídla, po hormonální stimulaci či během těhotenství, tak při různých onemocněních, jakými jsou například trauma, sepse či nádorové choroby. Nejen to, tato metoda dovoluje nyní stanovit tisíce látek – hormony, cytokiny, hladiny léků a dalších látek důležitých pro klinickou medicínu i pro výzkum.
Možnost stanovit koncentraci inzulinu, jeho změny v reakci na dynamické podmínky a dlouhodobé intervence představovala významný posun a faktický počátek moderní fyziologie v diabetologii. Napříště tak bylo možné podávat inzulin s ohledem na jeho fyziologickou sekreci.
Od třicátých let se významně rozvinul výzkum týkající se Langerhansových ostrůvků pankreatu a beta buněk v těchto ostrůvcích. Z mnoha těch, kteří se tímto výzkumem zabývali, jmenujeme jen Skota Robertsona Ogilvieho, který zjistil, že ostrůvky jsou v pankreatu umístěny v celé žláze, nejvíce však na přechodu hlavy a těla, a v celém těle pankreatu. Je jich 800 000 až 1,5 milionu a váží 1 až 2 gramy. Je smutnou připomínkou, že Ogilvie zemřel na infarkt myokardu v Luhačovicích, brzy ráno před slavnostní přednáškou, ke které byl pozván na 1. československé diabetologické dny v květnu 1965.
Díky možnosti stanovit hladinu inzulinu pomoci radioimunoeseje bylo již brzy zjištěno, že ti, které dnes klasifikujeme jako diabetiky 1. typu, již od počátku onemocnění mají minimální nebo nulové hladiny plazmatického inzulinu. Otázkou bylo, jaká je podstata procesu, který vede k poškození a zničení beta buněk. Díky objevům, které v letech 1974–1988 učinil italský imunolog Gian Franco Bottazzo, působící v Londýně, víme, že se jedná o autoimunní zánět, specifický pro beta buňky, který je trochu nepřesně nazýván inzulitidou.
Regulace sekrece
Základy našeho poznání regulace sekrece inzulinu položil již Claude Bernard v polovině 19. století. V pokusech na zvířatech ukázal, že orálně podaná glukóza nevyvolá stejný vzestup glykemie, jako když je podána intravenózně. Sám si však tento efekt vysvětloval tím, že se glukóza před vstupem do systémové cirkulace metabolizuje v játrech (tzv. efekt prvního průchodu; first-pass efekt). V té době ještě nemohl pochopit dosah těchto pozorování.
To bylo možné až s poznáním funkce hormonů. Roku 1902 byl popsán sekretin, duodenální faktor odpovědný za stimulaci uvolňování pankreatické šťávy do střeva. Byla to první molekula, kterou r. 1905 Ernest Starling a William Bayliss pojmenovali nadřazeným pojmem hormon (z řec. óρμá ω, probouzet k aktivitě). Záhy poté se v odborných kruzích začaly množit úvahy o možném hormonu regulujícím uvolňování antidiabetické substance, která tehdy ještě neměla jméno.
Ale až v roce 1932 belgický fyziolog a lékař Jean La Barre použil termín inkretin pro popis dosud neznámého faktoru, který by mohl regulovat sekreci inzulinu. Vycházel z pokusů na zvířatech, kterým podával extrakt duodenální sliznice, a pozoroval pokles glykemie. Pokud zvířeti před podáním odstranil slinivku, hypoglykemizující účinky nepozoroval. Prakticky současně prováděl ve Vídni obdobné pokusy také Hans Heller. Oba napadlo, že by tento faktor mohl sehrát svou roli v léčbě cukrovky.
Další pátrání po inkretinu pak na dlouhou dobu usnulo, dílem nedokonalostí metod k dalšímu zkoumání, dílem nešťastného popření jeho existence známou chicagskou školou gastrointestinální endrokrinologie (Andrew Conway Ivy, objevitel cholecystokininu), která nebyla schopna dřívější pozorování zopakovat.
Potvrzení tohoto konceptu muselo počkat až do šedesátých let, kdy se objevila možnost stanovit koncentraci inzulinu v plazmě (viz výše). Následovala série pokusů několika předních týmů v Londýně (Neil McIntyre) a Denveru (Harold Elrick), které prokázaly výrazně vyšší odpověď inzulinu na orálně podanou glukózu než na stejnou dávku podanou intravenózně. Tyto pokusy potvrdily tzv. inkretinový efekt a oživily zájem o hormony působící na inzulin jako potenciální léčebné cíle.
Prvním popsaným inkretinem se stal počátkem sedmdesátých let GIP. Tato zkratka původně znamenala „gastrický inhibiční polypeptid“, protože mezi jeho první popsané účinky patřilo snížení kyselé sekrece žaludku. Za jeho objevem stojí tým vědců ze Stockholmu vedený Johnem Brownem. Společně s Johnem Dupré následně prokázali, že GIP vykazuje také významné účinky na snížení krevního cukru, ale pouze za hyperglykemie. Proto byl GIP přejmenován podle svého účinku na glukóza- dependentní inzulinotropní polypeptid (tj. stále pod zkratkou GIP) a byla postulována jeho funkce v regulaci sekrece inzulinu po jídle, kdy je vysoká koncentrace glukózy v krvi.
V roce 1983 skupina Graema Bella identifikovala GLP-1 a GLP-2 jako štěpné produkty proglukagonu a v roce 1987 byl prokázán inkretinový účinek GLP-2. Přibližně ve stejné době Michael A. Nauck prokázal, že u pacientů s diabetem druhého typu (tedy diabetem, jehož příčina je v poruše funkce inzulinu v cílových tkáních, nikoli v jeho absolutním nedostatku) dochází k poruše první fáze sekrece inzulinu – fáze, která je závislá na účinku inkretinů a předchází druhé fázi závislé na přísunu živin, zejména glukózy. Tyto poznatky následně dláždily cestu k celé skupině nových léčiv, která vycházejí z nahrazování funkce inkretinového systému. To jsme ale už poněkud odbočili.
Cesta k fyziologické náhradě
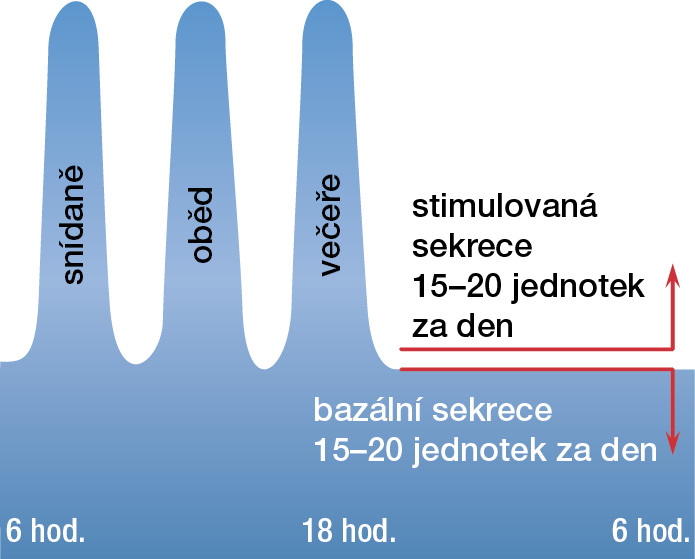
Inzulin u zdravého člověka vyplavují beta buňky v tzv. bazální sekreci, která poměrně málo kolísá během dne a odpovídá potřebám tkání. Beta buňky kromě bazální sekrece ve zvýšené míře vyplavují inzulin v odpovědi na přísun živin v potravě, zejména sacharidů. Tento typ sekrece se nazývá stimulovaná, nebo také postprandiální (obr. 5). Snaha o vývoj preparátů a později technologií, které by co nejlépe umožnily kopírovat fyziologickou sekreci inzulinu, pokračuje do dnešních dnů. V průběhu dne se může měnit fyziologicky citlivost k inzulinu, například v časně ranních hodinách je nejmenší. Patologicky klesá citlivost k inzulinu při obezitě a při řadě různých onemocnění, například infekci či těžkých úrazech. Snížená citlivost k inzulinu patří také k diabetu 2. typu.
První klinicky používané inzulinové preparáty (nazývané též solubilní nebo Toronto) účinkovaly 4–6 hodin. Od počátku léčby tedy musel být preparát podáván až v šesti denních dávkách tak, aby bylo dosaženo optimálního poklesu ranní glykosurie a ketonurie (tedy přítomnosti glukózy a ketolátek v moči, známek nedostatečného účinku inzulinu). Opakované injekce inzulinu sice zachraňovaly život, ale představovaly značnou zátěž, a proto byla již v průběhu dvacátých let vyvíjena snaha o přípravu preparátu se zlepšenými farmakodynamickými a farmakokinetickými vlastnostmi.
Hans Christian Hagedorn, jeden ze zakladatelů firmy Novo Nordisk v Dánsku, která získala práva k výrobě inzulinu, v roce 1936 zjistil, že vazba inzulinu na zásaditý protein (v jeho případě protamin z rybího mlíčí) zpomaluje vyplavování monomerů inzulinu z podkožního depa, a prodlužuje tedy jeho účinek. Obdobného efektu dosáhli také na Torontské univerzitě přidáváním zinku. Na trh se preparát s klinickým účinkem 4–12 hodin dostal ale až v roce 1946 jako inzulin NPH (neutral protamin Hagedorn). Jeho zavedení umožnilo pacientům s diabetem aplikovat inzulin večer před spaním bez nutnosti další noční aplikace. Ale nejen to. Získáním preparátu s delším poločasem účinku se otevřela cesta ke kombinaci inzulinů s různou dobou účinku, a tedy k postupnému posunu paradigmatu léčby směrem k napodobení fyziologické sekrece.
K průmyslové výrobě inzulinu se od počátku využívaly jateční slinivky hovězího a vepřového původu. V jednom kilogramu hovězí slinivky může být kolem dvou tisíc králičích jednotek inzulinu, což znamená, že například firma Eli Lilly k uspokojení potřeb rostoucího amerického trhu spotřebovala již ve dvacátých letech 56 milionů kusů dobytka ročně. S rostoucím trhem však přestávala tato kapacita stačit. Živočišné inzuliny se navíc potýkaly s problémy spojenými s nečistotou a relativně vysokou antigenicitou. Ta byla zřejmě spojena se zbytkovým množstvím proinzulinu a projevovala se lokálními toxickými reakcemi, lipodystrofií (poruchou metabolismu a rozložení tukové tkáně), tvorbou cirkulujících protilátek a rozvojem necitlivosti na inzulin. Tyto problémy z velké části vyřešila efektivní purifikace na přelomu šedesátých a sedmdesátých let. Optimalizace léčebného profilu inzulinu, dosažená různými technologickými úpravami, však v padesátých a šedesátých letech narazila na své limity.
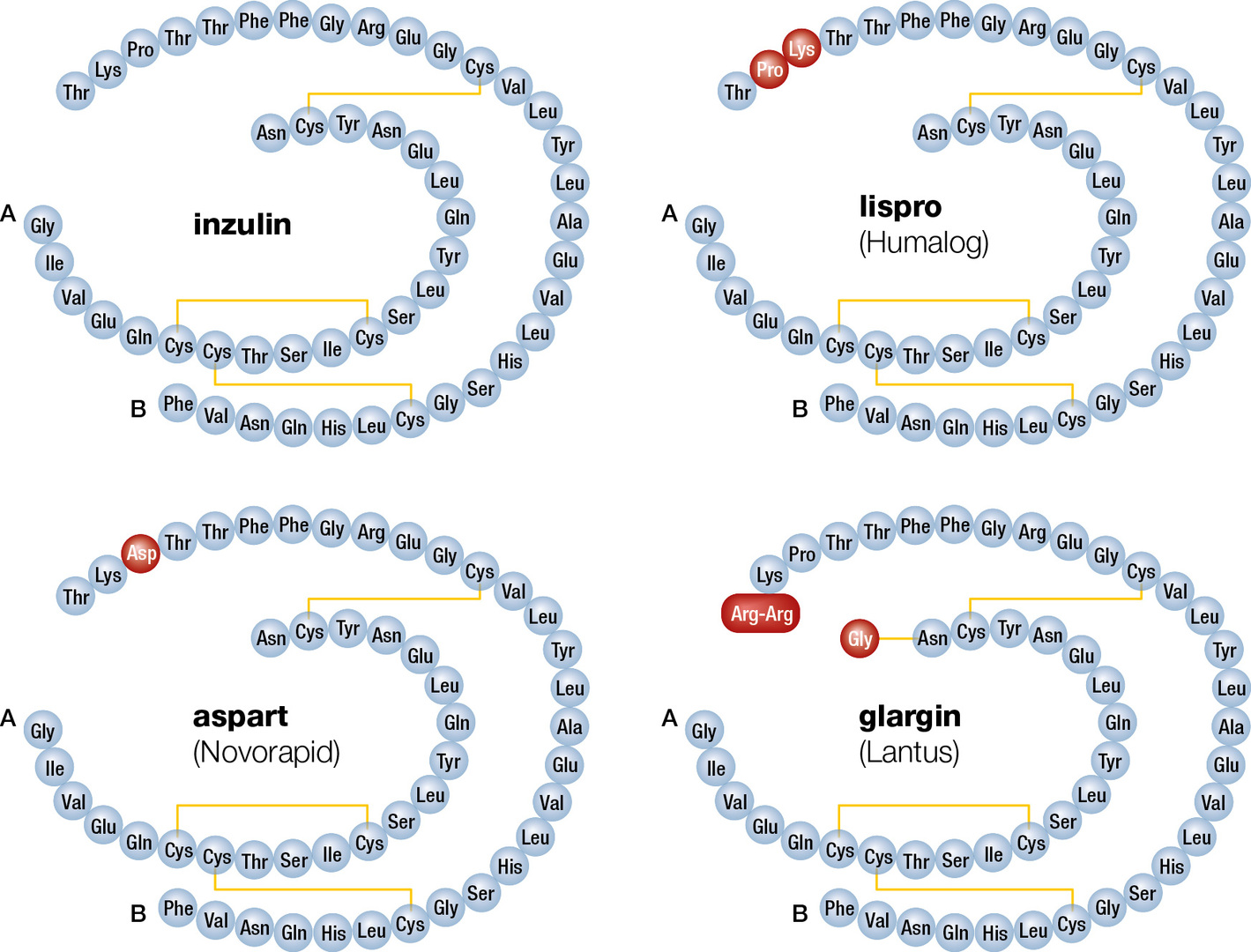
Již od padesátých let proto probíhal intenzivní výzkum směrem k vývoji inzulinu syntetického. Ke kvalitativnímu posunu ale nemohlo dojít dříve, než byla známa struktura inzulinu a dostupné možnosti rekombinantních technologií díky objevům, u kterých stál Frederick Sanger. Tento strukturální chemik z Cambridge popsal v roce 1951 strukturu beta řetězce inzulinu, v roce 1953 strukturu alfa řetězce a následně v roce 1955 publikoval strukturu celé molekuly inzulinu (obr. 4). Inzulin se tak stal prvním proteinem se známou strukturou. V roce 1958 Sanger získal Nobelovu cenu za chemii právě za tyto objevy. Dorothy Mary Crowfootová Hodgkinová, také z Cambridge, se zabývala rentgenovou analýzou a sekundární a terciární strukturou proteinů, a navrhla mimo jiné i prostorovou strukturu inzulinu. Také díky tomu dostala Nobelovu cenu za chemii.
Frederick Sanger patří mezi několik vědců, kteří byli vyznamenáni Nobelovou cenou dvakrát. Tu druhou získal za popis sekvence bází nukleových kyselin v roce 1982, spolu s Walterem Gilbertem. Další část této ceny byla v roce 1982 udělena Paulu Bergovi za jeho základní studie týkající se biochemie nukleových kyselin se zvláštním zřetelem na rekombinantní DNA (Vesmír 100, 314, 2021/5). Právě technika využívající rekombinantní DNA umožnila počátkem osmdesátých let výrobu humánních inzulinů.
První uměle syntetizované molekuly inzulinu spatřily světlo světa v roce 1963, resp. 1965 v Německu (Helmut Zahn), USA (Panayotis Katsoyannis) a v čínské Šanghaji (Wang Jing-laj).
Metody genetického inženýrství v průběhu sedmdesátých let umožnily začlenit DNA do dědičné informace bakterie E. coli. Množením bakterií s rekombinantní DNA a následnou extrakcí inzulinu byl v roce 1979 získáván čistý inzulin, 100% homologní s inzulinem lidským. V roce 1982 ho firma Eli Lilly jako první dostala na trh, brzy následována firmami Novo Nordisk a Hoechst. Tento humánní rekombinantní inzulin z trhu velmi rychle vytlačil starší inzuliny zvířecího původu. Technologie vycházející z rekombinantní DNA postupně umožnily výrobu desítek různých proteinů pro lékařské použití. Tato technologie tak představuje jeden z významných předělů v možnostech moderní terapie.
Dalším významným posunem směrem k fyziologii byl vývoj inzulinových analog. Pohnutkou pro vývoj nových inzulinů byla snaha o získání preparátů s kratším poločasem účinku, který by lépe kopíroval fyziologickou postprandiální sekreci (uvolňování inzulinu po jídle) a nezvyšoval svým prodlouženým účinkem riziko hypoglykemie mezi jídly. Současně existovala poptávka po preparátu, který by působil dlouhodobě, ideálně celých 24 hodin bez výkyvů představujících riziko kolísání glykemií, zejména hypoglykemie v noci, a napodobil tak bazální sekreci.
Tato poptávka byla uspokojena až vývojem preparátů se změněnou sekvencí aminokyselin v primární struktuře polypeptidu inzulinu, která umožnila zlepšení farmakokinetického profilu. První z těchto preparátů, ultrarychle působící inzulin lispro, má v řetězci B prohozeno pořadí lysinu a prolinu (obr. 4). Díky tomu se jeho molekula méně polymerizuje, a naopak rychleji disociuje na monomery. Inzulin lispro tedy vykazuje rychlejší nástup a rychlejší pokles hladin, což v důsledku znamená snížení glykemického vzestupu po jídle. Proto se ultrarychle působící inzuliny používají k náhradě inzulinu vyplavovaného z beta buněk po jídle, tedy tzv. stimulované sekrece. Lispro se k pacientům dostal v roce 1996 a následovala ho další ultrarychlá analoga (aspart, glulisin). K náhradě inzulinu uvolňovaného dlouhodobě, tedy také tzv. bazálního inzulinu, se používají inzuliny s délkou účinku 24– 36 hodin, mezi první patřil inzulin glargin, k dalším kupříkladu degludek.
Uvedení inzulinových analog na trh se potkalo s výstupy prospektivní kohortové klinické studie DCCT (Diabetes control and complications trial) v roce 1993. Ta jasně prokázala, že těsná kompenzace diabetu, tedy udržení glykemie co nejvíce v normálním rozmezí, je spojena se snížením rizika komplikací diabetu.
Toto poznání dále akcelerovalo snahy o nastavení režimu podávání inzulinu co nejblíže jeho fyziologické sekreci. Standardem péče o pacienty se velmi rychle stal tzv. intenzifikovaný režim podávání inzulinu, který spočívá v podávání bazálního inzulinu jednou denně, zpravidla před večerním ulehnutím do postele, a v podávání bolusů (jednorázových dávek) ultrarychlého inzulinu před jídly a eventuálně ke korekci vyšší glykemie. Tento režim se také nazývá bazál-bolus.
Snahy o fyziologickou substituci však začaly již počátkem osmdesátých let, zejména ve Steno Memorial Center v Dánsku a ve výzkumném diabetologickém ústavu v Karlsburgu v tehdejším východním Německu. Z Karlsburgu byla tato metoda přenesena v letech 1982–1983 nejprve do pražského IKEM a odtud rozšířena do celé ČSR. V roce 1989 bylo již intenzifikovanými inzulinovými režimy typu bazál-bolus léčeno 90 % všech českých nemocných diabetem 1. typu.
Technické prostředky
Protože je inzulin protein, musí se podávat injekčně, zpravidla do podkoží paží, břicha nebo stehen. Až do osmdesátých let se podával injekčními stříkačkami, které bylo nutné každodenně vyvařovat. Významným pokrokem bylo nejprve zavedení jednorázových stříkaček, v průběhu osmdesátých let byly zavedeny dávkovače s možností nastavení dávky inzulinu. Současně se zlepšovala kvalita jehel umožňujících vpich s minimální bolestivostí.
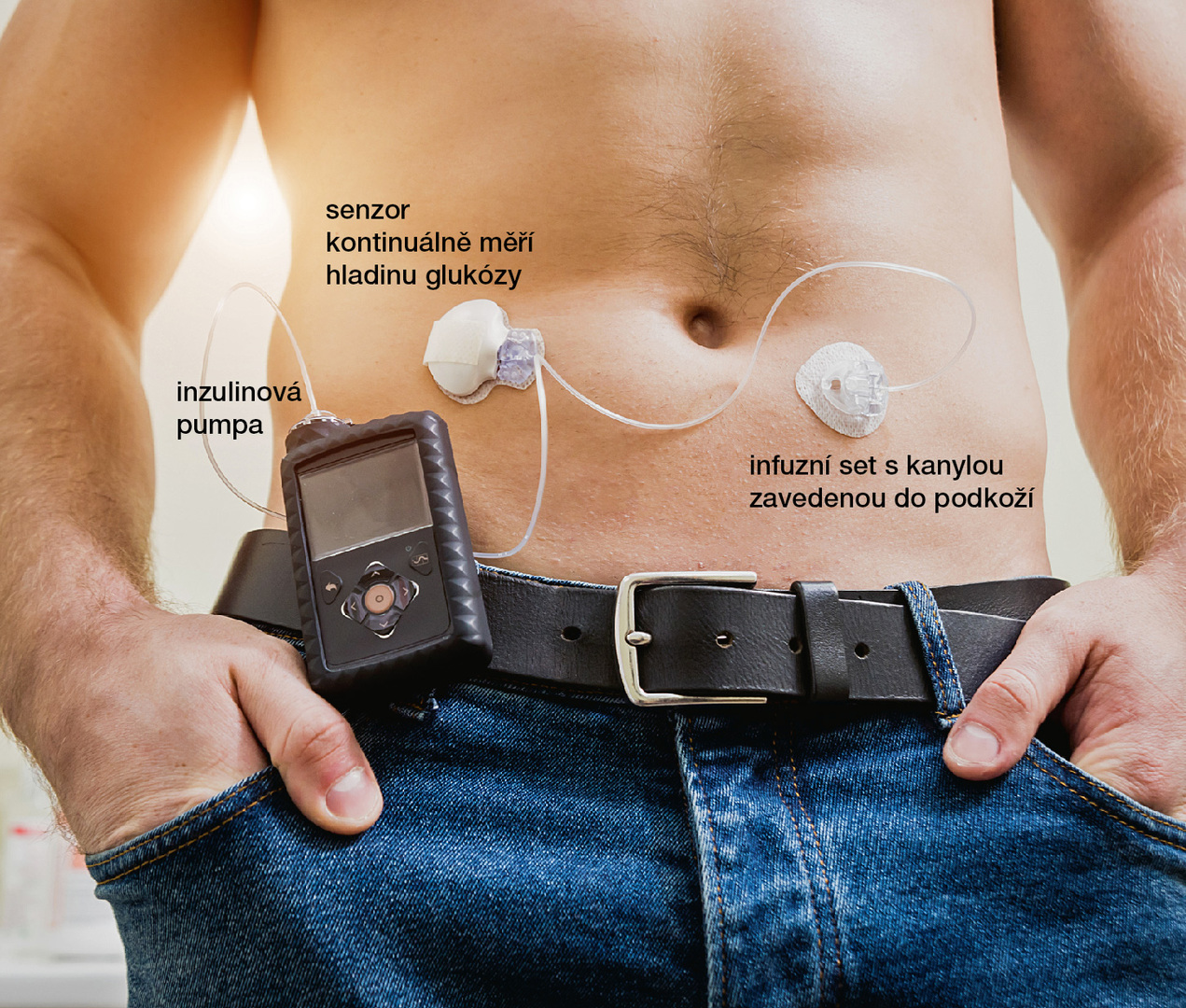
Posledním kvalitativním posunem v léčbě inzulinem jsou inzulinové pumpy, v praxi používané také od osmdesátých let minulého století a neustále zlepšované. Pumpa je schopna dávkovat roztok inzulinu kontinuálně velmi nízkými průtoky. Je spojena setem s kanylou zavedenou do podkoží. Inzulin je tedy podáván kontinuálně variabilní rychlostí. Nastavení různých rychlostí průtoku, tedy různých dávek bazálního inzulinu, posouvá možnosti přiblížit se individuálním potřebám a fyziologii podávání inzulinu. Inzulinová pumpa v kombinaci s kontinuálním glukózovým senzorem směřuje v poslední dekádě k ještě vyšší míře autonomie (obr. 7). Přes vypínání dodávky inzulinu při prudkém poklesu glykemie až po uzavřený okruh dodávky inzulinu, kdy se integrovaný systém umělé inteligence postupně učí, jak reaguje pacientova glykemie v různých situacích, a automatizuje dodávku inzulinu tak, aby byla glykemie udržena v cílovém rozmezí.
S novými inzulinovými analogy a technologií kontinuálního podávání inzulinu podkožní pumpou bylo tedy dosaženo teoretického optima v možnostech zlepšení kontroly hladin krevního cukru.
Podstatné limity v napodobení fyziologie sekrece ale stále zůstávají. Za normálních okolností je inzulin vyplavován z beta buněk do portální cirkulace a prvním orgánem, ve kterém inzulin podstatným způsobem účinkuje a je také konzumován, jsou tedy játra. Do periferního oběhu se dostává pouze část vlastního inzulinu. Naopak při podání inzulinu do podkoží je třeba relativně vyšších dávek k dosažení stejného účinku. To znamená, že hladiny inzulinu cirkulujícího v krvi jsou výrazně vyšší než u zdravých lidí. Dosavadní pokusy s podáváním inzulinu do portálního řečiště formou implantabilních peritoneálních pump však zatím nedosáhly kvality pro použití v klinické medicíně.
Transplantace
První pokus transplantovat slinivku proběhl na Mayo Clinic v USA v roce 1966. Metoda se rozvinula od poloviny sedmdesátých let. Od osmdesátých let se rozvíjí i v Česku v IKEM a od devadesátých let zde provádějí také transplantace izolovaných Langerhansových ostrůvků.
Slinivka je transplantována především diabetickým pacientům, kterým selhávají ledviny a potřebují jejich transplantaci. Obě transplantace tak mají společnou imunosupresi a řadu pacientů zbavily nutnosti aplikovat inzulin. Výjimečněji jsou slinivka nebo ostrůvky transplantovány izolovaně u nemocných s extrémně labilním diabetem.
Perspektivy
Jaké výzvy před námi v léčbě inzulinem stojí a jakým směrem se ubírá další výzkum a vývoj? Díky technologickému vývoji lze v budoucnu očekávat čím dál větší automatizaci a autonomii ve výpočtech a dodávkách inzulinu pomocí inzulinové pumpy. Také použití algoritmů strojového učení (umělé inteligence), miniaturizace zařízení nebo implantovatelné glukózové senzory budou drobnými krůčky posouvat technologie stále více do klinické praxe.
Trvalým limitem inzulinové léčby je nutnost injekčního podání. Další zkoumání směřuje k vývoji inzulinů, které by bylo možné podávat cestou pohodlnější pro pacienty – inhalačně, nasálně či ústy. První preparáty byly testovány již počátkem nového milénia, ale zatím stále zůstávají nedořešeny otázky efektivity, bezpečnosti a ceny. Stejným směrem se ubírá také vývoj preparátů, které by mohly zajistit udržení bazální dávky inzulinu po delší dobu a bylo by je možné aplikovat jednou týdně a nikoli denně.
Dalším problémem v léčbě je riziko hypoglykemie. Není nezanedbatelné a představuje vysoké psychosociální dopady pro pacienty a dopady ekonomické pro společnost. Hypoglykemie je dosud prakticky nevyhnutelnou odvrácenou stranou těsné kompenzace diabetu. K jejímu podstatnému snížení pomáhají nové typy inzulinových pump a jejich prediktivní algoritmy, avšak i to má svá omezení. Další cestou mohou být bihormonální pumpy dodávající současně také glukagon, který by hypoglykemie kontrareguloval. Překážkou všech technologických řešení zatím zůstává monitorování glykemie, které vychází z měření v podkoží, a jeví tedy nutně zpoždění oproti hladinám cukru v krvi. Zajímavým konceptem je také vývoj glukóza-senzitivních inzulinů, tedy preparátů, které by účinkovaly pouze za předpokladu normální či vyšší glykemie v krvi a při poklesu glykemie by účinek ztrácely.
Problém je také nadměrná nefyziologická inzulinizace periferních tkání. Jak již bylo zmíněno, je spojena se vstřebáváním inzulinu z podkožního depa primárně do systémové cirkulace. Tyto nefyziologicky vysoké hladiny mohou být spojeny s nárůstem hmotnosti. Proto byl navržen koncept hepatoselektivních inzulinů čili preparátů s preferenčním vychytáváním v játrech, které se pravděpodobně dostanou v následujících letech do klinického zkoušení a na trh.
Posledním, ale možná nejdůležitějším omezením v léčbě diabetu je paradoxně dostupnost léčby, zejména v chudších zemích. Připomeňme si na závěr Bantingova slova, která údajně pronesl, když (spolu s Bestem a Collipem) prodal patent na výrobu inzulinu Univerzitě v Torontu za symbolickou cenu jednoho dolaru: „Inzulin nepatří mně, patří světu.“
Dějiny objevu inzulinu a následující objevy jeho struktury, stanovení, fyziologického účinku, poruch sekrece a rozvoj metod jeho podávání jsou odrazem obrovského rozvoje vědy i technologie ve 20. století. V případě léčby diabetu jde jednoznačně o pozitivní stránky využití vědeckých poznatků k pokroku, který slouží celému lidstvu. Díky inzulinu se zásadně změnila zoufalá prognóza nemocných s diabetem 1. typu, kteří v současné době žijí často šedesát i více let po zjištění diagnózy. Souběžně s tím došlo k řadě objevů, které překračují vlastní diabetologii a jsou využívány v mnoha různých klinických i experimentálních oborech.
Úspěch i problém: z akutního onemocnění chronické
Paul Kimmelstiel, německý patolog, který od počátku třicátých let pracoval ve Spojených státech, a Clifford Wilson, britský lékař, v roce 1934 jako první popsali diabetickou glomerulosklerózu (ztlušťování a jizvení cévní stěny glomerulů v ledvinách). Jejich sdělení je také prvním patologicko-anatomickým popisem chronické komplikace diabetu a mimo jiné ukazuje na důležitou skutečnost, kterou diabetologie přinesla. Objev inzulinu totiž umožnil převést akutní smrtelné onemocnění do chronického stadia a z tisíců, později milionů pacientů udělat pacienty chronické. Dal tak naději pacientům s fatálními onemocněními, ale také otevřel problém, který se objevuje v medicíně u řady dalších diagnóz. Desetitisíce lidí v naší zemi v důsledku diabetu akutně neumírají, ale žijí s ním mnohá desetiletí, což s sebou vedle všech pozitivních aspektů nese značné náklady. Záchrana akutně těžce nemocných a převedení jejich nemocí na chronickou formu představuje obrovskou medicínskou, etickou, organizační i ekonomickou změnu. Diabetologie tak již před téměř sto lety otevřela problém, který přesahuje klinickou medicínu a dotýká se celé společnosti.
Poznámky
1) Vesmír v letech 1994–1995 přinášel ukázky z jeho deníků, které později vyšly i knižně.
Ke stažení
 článek ve formátu pdf [596,07 kB]
článek ve formátu pdf [596,07 kB]