K onkogenům se připojují onkometabolity
| 3. 10. 2013Nádorové buňky často obsahují mutace v charakteristických genech, které alespoň částečně odpovídají za vznik nádorového fenotypu. Mezi tyto takzvané onkogeny patří převážně geny pro proteiny účastnící se regulace růstu, diferenciace, buněčného cyklu či programované smrti. V posledních letech se ale výzkum nádorové biologie stále více zaměřuje na rozdíly mezi metabolickými drahami probíhajícími v nádorových a normálních buňkách.
Již od dvacátých let minulého století je známo, že alespoň část nádorů spoléhá při produkci ATP spíše na anaerobní glykolýzu než na aerobní metabolismus probíhající za účasti mitochondriálního dýchacího řetězce. Přesnější poznatky týkající se konkrétních změn v metabolických drahách a jejich vlivu na vznik a rozvoj nádorového bujení se však začaly objevovat až nedávno.
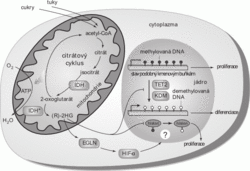 Jedním z metabolických enzymů, jehož mutace vedoucí ke změně reakčního mechanismu byla nalezena v několika druzích nádorových buněk, je izocitrátdehydrogenáza (IDH). V normálních buňkách tento enzym přeměňuje látku izocitrát na 2-oxoglutarát v rámci klíčové metabolické dráhy zvané Krebsův nebo též citrátový cyklus. Krebsův cyklus probíhá uvnitř mitochondrie a jeho základním účelem je oxidace acetylové skupiny navázané na nosič koenzym A na oxid uhličitý, přičemž elektrony uvolněné při této oxidaci jsou posléze v dýchacím řetězci přeneseny na kyslík. Energie přeměněná v tomto procesu pak může sloužit k tvorbě „univerzálního“ nosiče chemické energie, ATP. Krebsův cyklus hraje významnou roli při rozkladu i tvorbě cukrů, tuků i aminokyselin, stavebních kamenů bílkovin.
Jedním z metabolických enzymů, jehož mutace vedoucí ke změně reakčního mechanismu byla nalezena v několika druzích nádorových buněk, je izocitrátdehydrogenáza (IDH). V normálních buňkách tento enzym přeměňuje látku izocitrát na 2-oxoglutarát v rámci klíčové metabolické dráhy zvané Krebsův nebo též citrátový cyklus. Krebsův cyklus probíhá uvnitř mitochondrie a jeho základním účelem je oxidace acetylové skupiny navázané na nosič koenzym A na oxid uhličitý, přičemž elektrony uvolněné při této oxidaci jsou posléze v dýchacím řetězci přeneseny na kyslík. Energie přeměněná v tomto procesu pak může sloužit k tvorbě „univerzálního“ nosiče chemické energie, ATP. Krebsův cyklus hraje významnou roli při rozkladu i tvorbě cukrů, tuků i aminokyselin, stavebních kamenů bílkovin.
Některé nádorové buňky však obsahují mutovanou formu IDH, která spíše než výše popsanou reakci katalyzuje přeměnu 2-oxoglutarátu na jeho redukovanou formu 2-hydroxyglutarát. Význam této mutace na metabolismus nádorových buněk byl do značné míry objasněn v roce 2012.1) Jak tedy může přeměna přirozeného metabolitu na jeho minimálně odlišnou variantu pomáhat nádorovému bujení?
Zmíněné publikace ukazují, jak 2-hydroxyglutarát (2-HG) ovlivňuje v buňkách hned tři významné regulační systémy. Za prvé aktivuje skupinu enzymů (prolylhydroxylázy), které mimo jiné regulují množství proteinu HIF-1a, který může zpomalovat růst a dělení buněk v prostředí se sníženou koncentrací kyslíku. HIF-1a (hypoxia inducible factor 1 alfa) byl již v minulosti identifikován jako jeden z klíčových regulátorů přežívání a růstu nádorových buněk. Druhým popsaným účinkem 2-HG je stimulace přidávání methylových skupin na báze DNA, přičemž takto vzniklá „hypermethylace“ je charakteristickým nálezem u velmi zhoubného typu nádoru mozku, glioblastomu. Konečně třetím mechanismem, kterým abnormální odbočka z Krebsova cyklu směrem k 2-HG může ovlivnit normální vývoj buněk, je také inhibice odstraňování methylových skupin z proteinů zvaných histony. Histony jsou klíčovými regulátory struktury a funkce jaderné DNA a snížení jejich demethylace vede k poruše diferenciace (dozrávání) buněk. Právě porucha diferenciace je jednou z charakteristických vlastností mnoha typů zhoubných nádorů.
Vzhledem k vlivu, jaký produkce 2-HG má na růst a vývoj buněk, byla tato sloučenina na základě analogie s onkogeny nazvána onkometabolitem. Je stále více zřejmé, že nádorové bujení může být poháněno nejen změnami v regulačních mechanismech, ale také v drahách metabolismu živin. Také na tuto oblast nádorové biologie se začíná zaměřovat výzkum vedoucí k lepší diagnostice i léčbě rakoviny.
Upraveno podle Nature 496, 38–40, 2013.
Poznámky
1) Nature 483, 474–478, 479–483, 484–488, 2012/7390.
Ke stažení
 článek ve formátu pdf [282,18 kB]
článek ve formátu pdf [282,18 kB]
O autorovi
Jan Trnka


























