Antimikrobiální peptidy – terapeutika budoucnosti?
| 10. 2. 2011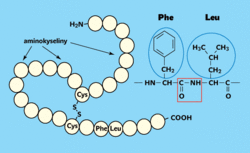 Při infekčních onemocněních jsme často spoléhali na antibiotika. Počáteční úspěchy při jejich aplikaci vzbudily klamný dojem, že lékaři mají infekční nemoci navždy pod kontrolou. Neuvážené používání antibiotik vedlo ke vzniku rezistentních kmenů patogenních bakterií. Infekční onemocnění se tak stávala obtížněji léčitelná a v současné době jsou na druhé příčce žebříčku úmrtnosti. Světová zdravotní organizace varuje, že vysoce rezistentní patogeny by mohly přivést svět zpět do předantibiotického období. Možnost objevení nových antibiotik je stále menší, neboť jejich výzkum není pro farmaceutické firmy rentabilní. Je proto důležité zrevidovat používání tradičních antibiotik, ale zároveň se věnovat výzkumu principiálně jiných antimikrobiálních látek s odlišným mechanismem zabíjení mikrobů. Jedním z možných a slibných kandidátů jsou antimikrobiální peptidy.
Při infekčních onemocněních jsme často spoléhali na antibiotika. Počáteční úspěchy při jejich aplikaci vzbudily klamný dojem, že lékaři mají infekční nemoci navždy pod kontrolou. Neuvážené používání antibiotik vedlo ke vzniku rezistentních kmenů patogenních bakterií. Infekční onemocnění se tak stávala obtížněji léčitelná a v současné době jsou na druhé příčce žebříčku úmrtnosti. Světová zdravotní organizace varuje, že vysoce rezistentní patogeny by mohly přivést svět zpět do předantibiotického období. Možnost objevení nových antibiotik je stále menší, neboť jejich výzkum není pro farmaceutické firmy rentabilní. Je proto důležité zrevidovat používání tradičních antibiotik, ale zároveň se věnovat výzkumu principiálně jiných antimikrobiálních látek s odlišným mechanismem zabíjení mikrobů. Jedním z možných a slibných kandidátů jsou antimikrobiální peptidy.
Peptidy – všemocné řetězce aminokyselin
Peptidy jsou polymerní organické sloučeniny složené ze dvou či více aminokyselin spojených do řetězců různých délek. Peptid s velkým obsahem aminokyselin nazýváme polypeptid. Dlouhé řetězce obsahující více než sto aminokyselin pak řadíme mezi proteiny (bílkoviny).
Peptidy mají v organismech velmi důležité regulační funkce, např. peptidové hormony (inzulin, oxytocin, růstový hormon). Mají i řadu užitečných praktických vlastností, např. sladidlo aspartam či některá peptidová antibiotika (penicilin).
Antimikrobiální peptidy
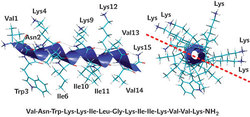
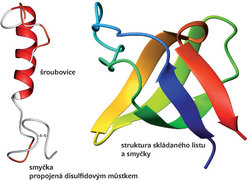 jsou v přírodě všudypřítomné jako součást vrozené imunity všech organismů. První antimikrobiální peptid cecropin byl izolován v roce 1980 z hemolymfy kukly amerického martináče Hyalophora cecropia. Dnes je již registrováno asi tisíc antimikrobiálních peptidů. Obvykle jde o peptidy složené z 10 až 50 aminokyselin, které jsou složeny převážně z bazických (lysin, arginin) a hydrofobních aminokyselin. Nejhojnější jsou lineární antimikrobiální peptidy se šroubovicovou strukturou. Pro jiné je typický motiv skládaného listu nebo peptidový řetězec vytvářející smyčku, popř. kombinace těchto struktur (obr. 2). Většina těchto peptidů zaujme některou z výše uvedených struktur až při kontaktu s membránou bakterií či jiných buněk. Pro lineární antimikrobiální peptidy se šroubovicovou strukturou je typické, že na jedné straně ze šroubovice do prostoru vyčnívají hydrofobní postranní řetězce aminokyselin a na protilehlé hydrofilní řetězce, včetně kladně nabitých postranních řetězců lysinu či argininu (obr. 3).
jsou v přírodě všudypřítomné jako součást vrozené imunity všech organismů. První antimikrobiální peptid cecropin byl izolován v roce 1980 z hemolymfy kukly amerického martináče Hyalophora cecropia. Dnes je již registrováno asi tisíc antimikrobiálních peptidů. Obvykle jde o peptidy složené z 10 až 50 aminokyselin, které jsou složeny převážně z bazických (lysin, arginin) a hydrofobních aminokyselin. Nejhojnější jsou lineární antimikrobiální peptidy se šroubovicovou strukturou. Pro jiné je typický motiv skládaného listu nebo peptidový řetězec vytvářející smyčku, popř. kombinace těchto struktur (obr. 2). Většina těchto peptidů zaujme některou z výše uvedených struktur až při kontaktu s membránou bakterií či jiných buněk. Pro lineární antimikrobiální peptidy se šroubovicovou strukturou je typické, že na jedné straně ze šroubovice do prostoru vyčnívají hydrofobní postranní řetězce aminokyselin a na protilehlé hydrofilní řetězce, včetně kladně nabitých postranních řetězců lysinu či argininu (obr. 3).
Jak antimikrobiální peptidy zabíjejí?
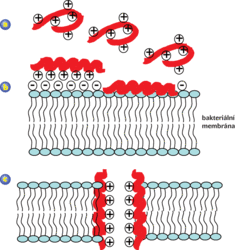
Jak je možné, že antimikrobiální peptidy ničí bakteriální buňky, a přitom nejsou toxické pro buňky hostitelských živočichů? Buněčné membrány bakterií jsou totiž složeny převážně z fosfolipidů (fosfatidyglycerolu, kardiolipinu), jejichž fosfátové skupiny membránové dvouvrstvy jsou záporně nabité. Zde dochází k interakcím s kladně nabitým antimikrobiálním peptidem (obr. 4). Membrány živočišné buňky jsou složeny převážně z fosfolipidů neutrálního charakteru (fosfatidylcholinu, sfingomyelinu) a navíc obsahují cholesterol, který (do určité míry) chrání živočišnou buňku před účinkem antimikrobiálních peptidů. Ty především narušují bakteriální membrány tvorbou pórů, nebo způsobují rozpad membrány jiným mechanismem, následkem čehož dojde k úniku životně důležitého obsahu bakterie. Některé antimikrobiální peptidy pronikají dále do nitra bakterií, kde naruší metabolismus nebo poškodí cytoplazmatické komponenty.
Bohatým zdrojem antimikrobiálních peptidů je třeba žabí kůže,
kde jsou produkovány a skladovány v granulích serózních žláz. Podrážděním je obsah žláz vyloučen na povrch kůže, kde antimikrobiální peptidy představují prvotní obrannou linii proti bakteriím, plísním a virům. Magaininy (dva peptidy složené z 23 aminokyselin) byly izolovány z kůže žáby drápatky vodní (Xenopus laevis), bombininy z kůže kuňky (rod Bombina), temporiny ze skokana (Rana temporaria) a dermaseptiny z rosničkovité žáby listovnice (rod Phyllomedusa).
Proč je hmyz k infekci tak odolný?
 Imunitní systém hmyzu a dalších bezobratlých se od imunitního systému obratlovců liší. Hmyz na rozdíl od obratlovců nemá lymfocyty. Součástí buněčné imunity hmyzu jsou hemocyty produkované hemopoetickými tkáněmi a vylučované do hemolymfy (analogie krve savců), kde volně cirkulují a mají rovněž schopnost fagocytovat mikroorganismy. Hmyz na rozdíl od savců neprodukuje imunoglobuliny (protilátky). Dominantní úlohu v humorální imunitě hmyzu hrají antimikrobiální peptidy. Po styku s infekcí jsou tyto peptidy syntetizovány v tukovém tělese (obdoba našich jater) a v některých dalších orgánech. Poté jsou vyplaveny do hemolymfy. Jsou to například již zmíněné cecropiny. Defensiny hmyzu mají odlišné prostorové uspořádaní než defensiny obratlovců, ale jejich řetězec je také propojen třemi disulfidovými můstky. Drosocin izolovaný ze zástupců řádu blanokřídlých, motýlů, ploštic a dvoukřídlých, pyrrhocoricin z ruměnice pospolné (Pyrrhocoris apterus) a apidaecin ze včely medonosné patří mezi antimikrobiální peptidy bohaté na aminokyselinu prolin. Diptericiny izolované z much jsou větší peptidy mající sekvenci bohatou na prolin a glycin. Kromě výše zmíněných antimikrobiálních peptidů identifikovaných v hemolymfě hmyzu věnovali vědci značnou pozornost též výzkumu
Imunitní systém hmyzu a dalších bezobratlých se od imunitního systému obratlovců liší. Hmyz na rozdíl od obratlovců nemá lymfocyty. Součástí buněčné imunity hmyzu jsou hemocyty produkované hemopoetickými tkáněmi a vylučované do hemolymfy (analogie krve savců), kde volně cirkulují a mají rovněž schopnost fagocytovat mikroorganismy. Hmyz na rozdíl od savců neprodukuje imunoglobuliny (protilátky). Dominantní úlohu v humorální imunitě hmyzu hrají antimikrobiální peptidy. Po styku s infekcí jsou tyto peptidy syntetizovány v tukovém tělese (obdoba našich jater) a v některých dalších orgánech. Poté jsou vyplaveny do hemolymfy. Jsou to například již zmíněné cecropiny. Defensiny hmyzu mají odlišné prostorové uspořádaní než defensiny obratlovců, ale jejich řetězec je také propojen třemi disulfidovými můstky. Drosocin izolovaný ze zástupců řádu blanokřídlých, motýlů, ploštic a dvoukřídlých, pyrrhocoricin z ruměnice pospolné (Pyrrhocoris apterus) a apidaecin ze včely medonosné patří mezi antimikrobiální peptidy bohaté na aminokyselinu prolin. Diptericiny izolované z much jsou větší peptidy mající sekvenci bohatou na prolin a glycin. Kromě výše zmíněných antimikrobiálních peptidů identifikovaných v hemolymfě hmyzu věnovali vědci značnou pozornost též výzkumu
antimikrobiálních peptidů z jedu
 blanokřídlého hmyzu. Ten obsahuje směs látek – aminokyseliny, biogenní aminy, enzymy a různě dlouhé peptidy. Neurotoxický peptid apamin a hemolytický peptid melitin byly izolovány z jedu včely medonosné. Z jedu mravenců podčeledi Ponerinae byla izolována směs několika ponericinů. Ponericiny zřejmě slouží k ochraně před mikroorganismy zavlečenými do mravenčí kolonie s rozkládající se potravou. V jedu vos čeledi Vespidae se našly mastoparany, lineární tetradekapeptidy, způsobující rozpad žírných buněk a mající též toxický účinek (viz Vesmír 83, 392, 2004/7). Některé mastoparany ale vykazují značný antimikrobiální účinek in vitro, který spočívá v tom, že ve styku s bakteriální membránou vytvářejí šroubovicovou strukturu s postranními řetězci hydrofobních a hydrofilních aminokyselin vyčnívajících na protilehlé strany šroubovice, jak je znázorněno na obr. 3. V ÚOCHB AV ČR jsme zjistili, že řada nových peptidů s ještě vyšším antimikrobiálním účinkem je obsažena v jedu některých divokých včel. Jde též o kratší lineární šroubovicové peptidy s prostorovou strukturou podobnou mastoparanům, což je struktura typická i pro další antimikrobiální peptidy tohoto typu (obr. 3).
blanokřídlého hmyzu. Ten obsahuje směs látek – aminokyseliny, biogenní aminy, enzymy a různě dlouhé peptidy. Neurotoxický peptid apamin a hemolytický peptid melitin byly izolovány z jedu včely medonosné. Z jedu mravenců podčeledi Ponerinae byla izolována směs několika ponericinů. Ponericiny zřejmě slouží k ochraně před mikroorganismy zavlečenými do mravenčí kolonie s rozkládající se potravou. V jedu vos čeledi Vespidae se našly mastoparany, lineární tetradekapeptidy, způsobující rozpad žírných buněk a mající též toxický účinek (viz Vesmír 83, 392, 2004/7). Některé mastoparany ale vykazují značný antimikrobiální účinek in vitro, který spočívá v tom, že ve styku s bakteriální membránou vytvářejí šroubovicovou strukturu s postranními řetězci hydrofobních a hydrofilních aminokyselin vyčnívajících na protilehlé strany šroubovice, jak je znázorněno na obr. 3. V ÚOCHB AV ČR jsme zjistili, že řada nových peptidů s ještě vyšším antimikrobiálním účinkem je obsažena v jedu některých divokých včel. Jde též o kratší lineární šroubovicové peptidy s prostorovou strukturou podobnou mastoparanům, což je struktura typická i pro další antimikrobiální peptidy tohoto typu (obr. 3).
Objevit a prozkoumat nový antimikrobiální peptid není jednoduché
Entomologové nachytají včelky a určí jejich druhovou příslušnost. Poté vypreparují několik jedových váčků, ty se extrahují a složky extraktu se rozdělí na chromatografické koloně metodou vysokoúčinné kapalinové chromatografie. Mikrobiologický test odhalí přítomnost hledaného antimikrobiálního peptidu v oddělené složce. V tomto stupni máme prakticky „neviditelné“ množství aktivního peptidu. Stanovením jeho molekulové hmotnosti pomocí hmotové spektrometrie odhadneme počet aminokyselin v molekule peptidu a jejich pořadí určíme metodou automatického Edmanova odbourávaní. Tím však pouze získáme sekvenci peptidu, zatímco jsme spotřebovali veškerý materiál. Zde začíná práce chemiků syntetiků, kteří na základě stanovené sekvence připraví peptid v množství několika desítek miligramů. To je již dostatečné množství materiálu pro další studie mikrobiologů a biochemiků, kteří vyzkoušejí účinek peptidu proti několika kmenům bakterií. Zjistí, zda není peptid toxický, a zároveň otestují jeho účinek na některé plísně nebo rakovinné buňky in vitro. Fyzikální chemici pak dokážou metodami nukleární magnetické rezonance a měřením spekter cirkulárního dichroismu stanovit jeho prostorovou strukturu. Je logické, že si přejeme nalézt v přírodě peptid s co nejvyšší antimikrobiální aktivitou a zároveň s nízkou toxicitou. Většinou však příroda není tak vstřícná, a tak nezbývá než pokusit se její výrobek poněkud vylepšit. Chemickou syntézou připravíme řadu analogů přírodního peptidu a někdy se opravdu podaří vytvořit i takový, který má k naší spokojenosti výrazně vylepšené vlastnosti. K tomu všemu je ovšem zapotřebí velmi drahého přístrojového vybavení v řádu i desítek milionů korun, spousta chemikálií, času, trpělivosti a hlavně velké zaujetí pro to, co děláme.
Mají antimikrobiální peptidy vyhlídky na využití v praxi?
Antimikrobiální peptidy účinkují i proti patogenním kmenům bakterií rezistentním k běžně dostupným antibiotikům, např. proti postrachu všech nemocnic zlatému stafylokokovi (Staphylococcus aureus) rezistentnímu na methicilin, ale též proti kvasinkovým a virovým onemocněním. Antimikrobiální peptidy mohou být využity především pro topické aplikace (syndrom diabetické nohy, bércové vředy, akné, infekce dutiny ústní, infekce vagíny, oční choroby), ale i systémové aplikace, třeba při léčení pacientů s cystickou fibrózou. Uvažuje se též o jejich využití pro stimulaci vrozené imunity a pro potlačení septického šoku neutralizací bakteriálních endotoxinů. Některé antimikrobiální peptidy již procházejí první či druhou fází klinických zkoušek. Jako příklad uveďme Pexiganan, analog již zmíněného magaininu, který měl být využit pro léčbu syndromu diabetické nohy. I když úspěšně prošel druhou fází klinického testování, americký Úřad pro potraviny a léky jej bohužel ve třetí fázi testů pro klinické využití neschválil.
Poznámka: Antimikrobiální projekt je podpořen grantem 203/08/0536 od Grantové agentury České republiky a vědeckým projektem Z40550506 domovského ústavu.
Aminokyseliny jsou základními stavebními kameny peptidů i bílkovin. Jsou to sloučeniny, které obsahují ve své molekule karboxylovou skupinu (—COOH) a aminoskupinu (H2N—). Molekuly aminokyselin jsou v řetězcích vzájemně propojeny peptidovými vazbami. Při spojení molekul reaguje karboxylová skupina jedné aminokyseliny s aminoskupinou druhé aminokyseliny (obr. 1). V přírodě se vyskytují převážně ribozomální peptidy. To jsou peptidy tvořené různými kombinacemi dvaceti existujících proteinogenních (kódových) α-aminokyselin obecného vzorce H2N—CH(R)—COOH. R je postranní řetězec, podle kterého se aminokyseliny odlišují. Podle struktury tohoto postranního řetězce se aminokyseliny dají třídit třeba na hydrofilní (serin, threonin, lysin, arginin…) a hydrofobní (valin, leucin, isoleucin, fenylalanin…). Aminokyselina cystein zprostředkuje v peptidech a bílkovinách propojení řetězců disulfidovými můstky (obr. 1).
Příklady dalších antimikrobiálních peptidů
Z lidských antimikrobiálních peptidů jsou nejprobádanější defensiny, cathelicidin a histatiny. Defensiny byly izolovány z granulí cirkulujících neutrofilů (určitého typu bílých krvinek), z buněk tenkého střeva, z hemofiltrátu pacientů podstupujících dialyzační léčbu a také z kůže pacientů trpících lupénkou. Cathelicidin se vyskytuje v mnoha typech leukocytů, v buňkách kůže a gastrointestinálního a respiračního ústrojí. Kromě antibakteriálních vlastností také stimuluje tvorbu cév v poraněné tkáni nebo obnovení epitelu v hojící se kůži. Je chemotaktický (přitahuje bílé krvinky do místa poranění), chrání proti endotoxickému šoku a má protinádorovou aktivitu. Histatiny jsou obsaženy ve slinách, kde hrají výraznou úlohu při udržování zdravého stavu ústní dutiny.
Ke stažení
 článek ve formátu pdf [793,88 kB]
článek ve formátu pdf [793,88 kB]
O autorovi
Václav Čeřovský


























