V jaké buňce vzniká nádor?
| 3. 11. 2011Přesná definice buňky odpovědné za vznik jednotlivých nádorů zaměstnává desetitisíce vědců. Nádorové buňky ve svém genomu vesměs nesou mutace, které v okolní normálně se vyvíjející tkáni chybějí (somatické mutace). Část těchto mutací můžeme ale podědit po svých předcích (zárodečné mutace), takové pak bývají přítomny ve všech buňkách našeho těla. I když všechny tělní buňky nesou příslušnou mutaci, ke vzniku nádoru dochází jen v některých typech buněk. Například u nositelek zárodečných mutací genů BRCA1 nebo BRCA2 dochází k velmi častému výskytu nádorů prsu, ale výskyt nádorů ostatních tělních tkání se u těchto žen podobá situaci u těch, které mají oba zmíněné geny v nemutované formě. Identifikaci buňky, ze které nádor vznikl, komplikuje značná proměnlivost vzhledu a vlastností nádorových buněk a časté vmíšení buněk jiného původu mezi buňky nádorové.
Částečnou odpověď na dotaz z titulku poskytlo tkáňově specifické umlčení (knock-out) jednotlivých genů zodpovídajících za nádorové bujení. Na myších modelech lze navodit umlčení či změněnou expresi příslušného genu jen v přesně definovaných typech buněk a zjistit, zda takto omezená změna genotypu vede ke vzniku nádoru. Jenže jak už jsme i zde na stránkách Vesmíru psali (Vesmír 89, 347, 2010/6), někdy bývá vyžadována přítomnost mutací hned v několika typech navzájem kooperujících buněk.
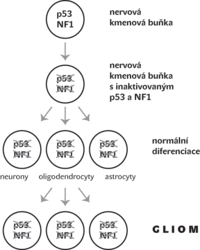
Jiný velmi obtížně odhalitelný mechanismus zahrnuje vznik mutace v kmenové nebo progenitorové buňce, která ale dává bez problémů vznik svému běžnému více diferencovanému potomstvu. Teprve mutací postižené tkáňově diferencované buňky jsou nádorově transformovány a dávají vznik nádoru (viz obr.). Při takovémto vývoji se za buňky dávající vznik nádoru považuje až diferencované potomstvo buněk kmenových, byť i ony nesly identickou mutaci.
 Tým Hui Zonga z Oregonské univerzity nyní přišel v časopise Cell s novým přístupem identifikujícím buňku dávající vznik nádoru. Využili metody zvané mozaiková analýza s dvojitými markery, která byla pro výzkum na obratlovcích přizpůsobena teprve před šesti lety. Tato metoda genetického inženýrství se podobá již dlouho známé metodě genového knock-outu (detailněji viz Vesmír 87, 196, 2008/3). Rozdíl spočívá v tom, že zatímco klasický knock-out zasáhne všechny buňky daného jedince a dědí se z jedné generace myší na druhou, mozaikový knock-out zasáhne jen malé skupinky buněk a můžeme s jeho užitím úspěšně napodobovat vznik somatických mutací, které bývají typickou příčinou vzniku zhoubného bujení.
Tým Hui Zonga z Oregonské univerzity nyní přišel v časopise Cell s novým přístupem identifikujícím buňku dávající vznik nádoru. Využili metody zvané mozaiková analýza s dvojitými markery, která byla pro výzkum na obratlovcích přizpůsobena teprve před šesti lety. Tato metoda genetického inženýrství se podobá již dlouho známé metodě genového knock-outu (detailněji viz Vesmír 87, 196, 2008/3). Rozdíl spočívá v tom, že zatímco klasický knock-out zasáhne všechny buňky daného jedince a dědí se z jedné generace myší na druhou, mozaikový knock-out zasáhne jen malé skupinky buněk a můžeme s jeho užitím úspěšně napodobovat vznik somatických mutací, které bývají typickou příčinou vzniku zhoubného bujení.
Zong se svými kolegy na pokusných myších provedl mozaikovou analýzu pro modelaci vzniku maligního gliomu, smrtelného nádorového onemocnění mozku, jehož původ byl dosud předmětem kontroverzí. Do nervových kmenových buněk pokusných myší vnesli mozaikově mutace genů pro proteiny p53 a NF1. Obě tyto molekuly jsou známými supresory zhoubného bujení, jejichž inaktivace je běžně detekována právě v lidských i myších gliomech. Teprve Zong a jeho kolegové ukázali, že za vznik gliomů jsou zodpovědné mutace těchto molekul v prekurzorech oligodendrocytů (buňky, jejichž výběžky tvoří myelinové pochvy neuronů), ne však v ostatních buněčných liniích vyvíjejících se z nervových kmenových buněk. Zong tedy elegantně ukázal, že mutace sice může být přítomna v nervové kmenové buňce, ta ale dává bez problémů vznik svému běžnému diferencovanějšímu potomstvu. Teprve mutovaná subpopulace dceřiných buněk (oligodendrocytů) dává vznik nádoru.
Podobné poznatky jsou klíčové při vývoji léčebných postupů pro příslušný typ nádorů, protože umožňují cílit prevenci a léčbu na přesněji definované populace buněk a omezit tak nežádoucí vedlejší účinky. (Cell 146, 209–221, 2011)
Ke stažení
 článek ve formátu pdf [352,86 kB]
článek ve formátu pdf [352,86 kB]

























