Zelený fluorescenční protein
| 9. 4. 2009 Během 20. století se díky mnoha revolučním metodickým objevům v biologii a chemii podařilo odpovědět na podstatné otázky fungování organismů. Čeho se ale po dlouhou dobu nedostávalo, byl způsob, který by umožňoval v živých buňkách (a ještě lépe v celých mnohobuněčných organismech) studovat s dostatečným rozlišením dynamické procesy v konkrétních strukturách.
Během 20. století se díky mnoha revolučním metodickým objevům v biologii a chemii podařilo odpovědět na podstatné otázky fungování organismů. Čeho se ale po dlouhou dobu nedostávalo, byl způsob, který by umožňoval v živých buňkách (a ještě lépe v celých mnohobuněčných organismech) studovat s dostatečným rozlišením dynamické procesy v konkrétních strukturách.  Většina znalostí o fungování a struktuře buněk byla získána až po jejich fixaci (pro účely mikroskopie) nebo homogenizaci (v biochemii). Až do objevu zeleného fluorescenčního proteinu nebylo možné si na buňku „posvítit“ zaživa a pozorovat jednotlivé buněčné struktury v jejich přirozeném uspořádání, aniž se do experimentálního systému zanášely další změny (artefakty). Naštěstí byl v pravý čas objeven zelený fluorescenční protein, který lze vnést do všech možných buněk a organismů. Je možné jej připojit k nejrůznějším proteinům, a tak je fluorescenčně označit bez nutnosti dalších spolupůsobících látek, neboť jeho absorpční a emisní centrum vzniká spontánní reakcí tří aminokyselin – serinu, tyrosinu a glycinu – které jsou součástí jeho struktury.
Většina znalostí o fungování a struktuře buněk byla získána až po jejich fixaci (pro účely mikroskopie) nebo homogenizaci (v biochemii). Až do objevu zeleného fluorescenčního proteinu nebylo možné si na buňku „posvítit“ zaživa a pozorovat jednotlivé buněčné struktury v jejich přirozeném uspořádání, aniž se do experimentálního systému zanášely další změny (artefakty). Naštěstí byl v pravý čas objeven zelený fluorescenční protein, který lze vnést do všech možných buněk a organismů. Je možné jej připojit k nejrůznějším proteinům, a tak je fluorescenčně označit bez nutnosti dalších spolupůsobících látek, neboť jeho absorpční a emisní centrum vzniká spontánní reakcí tří aminokyselin – serinu, tyrosinu a glycinu – které jsou součástí jeho struktury.
Zelený fluorescenční protein získal své jméno v roce 1971, 1) ale Osamu Shimomura ho objevil již v roce 1962. Jde o poměrně malý protein složený z 238 aminokyselin, přičemž tři z nich 2) spontánně za přístupu kyslíku vytvářejí fluorescenční chromofor p-hydroxybenzylideneimidazilonin. Ten má dominantní absorpční maximum při 400 nm 3) a emisní maximum při 505 nm.
 Zelený fluorescenční protein má velice zajímavou strukturu – tzv. beta-barel složený z 11 vláken beta-skládaných listů s jednou alfa-šroubovicí zanořenou do nitra „soudku“. Chromofor je součástí této šroubovice a je umístěn přibližně uprostřed molekuly. Sekvence tří aminokyselin, které tvoří chromofor, není v denaturovaném (rozvolněném) proteinu ničím zajímavá – ale pokud se zelený fluorescenční protein sbalí do „soudku“, prudké zakřivení vyvolá chemickou reakci. Takto modifikovaný zelený fluorescenční protein nefluoreskuje. Proto je nutná přítomnost molekulárního kyslíku, v jehož přítomnosti nastává další chemická reakce, pomocí níž vzniká plně fluorescenční protein.
Zelený fluorescenční protein má velice zajímavou strukturu – tzv. beta-barel složený z 11 vláken beta-skládaných listů s jednou alfa-šroubovicí zanořenou do nitra „soudku“. Chromofor je součástí této šroubovice a je umístěn přibližně uprostřed molekuly. Sekvence tří aminokyselin, které tvoří chromofor, není v denaturovaném (rozvolněném) proteinu ničím zajímavá – ale pokud se zelený fluorescenční protein sbalí do „soudku“, prudké zakřivení vyvolá chemickou reakci. Takto modifikovaný zelený fluorescenční protein nefluoreskuje. Proto je nutná přítomnost molekulárního kyslíku, v jehož přítomnosti nastává další chemická reakce, pomocí níž vzniká plně fluorescenční protein.
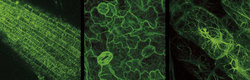 Pokud vneseme genovou sekvenci kódující zelený fluorescenční protein do zvolené buňky a necháme protein syntetizovat, za přístupu kyslíku se stane fluoroforem a většinou v buněčné fyziologii nezpůsobí žádné změny. To nám umožňuje připojit zelený fluorescenční protein k téměř libovolným proteinům, v buňce je „rozsvítit“ a pozorovat pod mikroskopem.
Pokud vneseme genovou sekvenci kódující zelený fluorescenční protein do zvolené buňky a necháme protein syntetizovat, za přístupu kyslíku se stane fluoroforem a většinou v buněčné fyziologii nezpůsobí žádné změny. To nám umožňuje připojit zelený fluorescenční protein k téměř libovolným proteinům, v buňce je „rozsvítit“ a pozorovat pod mikroskopem.
Objev zeleného proteinu (zásluha Osama Shimomury)
To, že medúza Aequorea victoria patří mezi organismy emitující světlo (bioluminiscenční), bylo známo od roku 1955. 4) V roce 1960 se k týmu Franka Johnsona z Princetonské univerzity připojil Osamu Shimomura. K své práci získal dostatečné množství experimentálních medúz odlovených z Tichého oceánu, a experimenty mohly začít. 5)Pro získání 150 mg aequorinu bylo nezbytné nachytat a zpracovat 50 000 (2,5 tuny) medúz. Každý den se podařilo získat 2000–3000 jedinců…
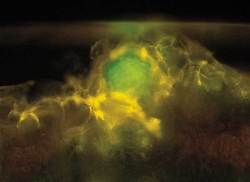 Jako první byl objeven protein odpovědný za bioluminiscenci. Ukázalo se, že aktivní bioluminiscenční složkou je protein aequorin, který emituje v přítomnosti kladně nabitých vápníkových iontů modré světlo. Modrá barva emitovaného světla byla velkým překvapením, neboť studovaná medúzka svítí jasně zeleně! Vzápětí Shimomura izoloval další protein, tentokrát silně zeleně fluoreskující. Po změření jeho absorpčních a emisních charakteristik se nabízelo vysvětlení. Aequorin svítí modře a nově objevený protein toto světlo účinně absorbuje a vysvítí jej jako zelené. Ve skutečnosti aequorin neemituje světlo, ale nezářivým přenosem 6) předá energii zelenému fluorescenčnímu proteinu, který ji pak vyzáří ve formě zeleného světla. Hlavním experimentálním zájmem Shimomury bylo v té době studium aequorinu jako vápníkového senzoru v živých buňkách. Zároveň se snažil pochopit fluorescenční chování vyčištěného proteinu emitujícího zelené světlo. Podařilo se mu naštěpit jej proteázou papainem a izolovat peptid se stejným absorpčním spektrem, jaké měl původní protein. Studoval jeho strukturu a navrhl, že chromoforem odpovědným za zachycení modrého světla je p-hydroxybenzylideneimidazilon. Poté, co byla k dispozici primární struktura zeleného fluorescenčního proteinu (pořadí aminokyselin), bylo zřejmé, jakou cestou tato komplexní chemická struktura vzniká. Je pravděpodobné, že bez Shimomurovy pionýrské práce (s využitím klasických biochemických a spektroskopických metod) by se éra fluorescenčních proteinů výrazně oddálila, popřípadě by zelený fluorescenční protein zůstal tajemstvím ukrytým v Tichém oceánu.
Jako první byl objeven protein odpovědný za bioluminiscenci. Ukázalo se, že aktivní bioluminiscenční složkou je protein aequorin, který emituje v přítomnosti kladně nabitých vápníkových iontů modré světlo. Modrá barva emitovaného světla byla velkým překvapením, neboť studovaná medúzka svítí jasně zeleně! Vzápětí Shimomura izoloval další protein, tentokrát silně zeleně fluoreskující. Po změření jeho absorpčních a emisních charakteristik se nabízelo vysvětlení. Aequorin svítí modře a nově objevený protein toto světlo účinně absorbuje a vysvítí jej jako zelené. Ve skutečnosti aequorin neemituje světlo, ale nezářivým přenosem 6) předá energii zelenému fluorescenčnímu proteinu, který ji pak vyzáří ve formě zeleného světla. Hlavním experimentálním zájmem Shimomury bylo v té době studium aequorinu jako vápníkového senzoru v živých buňkách. Zároveň se snažil pochopit fluorescenční chování vyčištěného proteinu emitujícího zelené světlo. Podařilo se mu naštěpit jej proteázou papainem a izolovat peptid se stejným absorpčním spektrem, jaké měl původní protein. Studoval jeho strukturu a navrhl, že chromoforem odpovědným za zachycení modrého světla je p-hydroxybenzylideneimidazilon. Poté, co byla k dispozici primární struktura zeleného fluorescenčního proteinu (pořadí aminokyselin), bylo zřejmé, jakou cestou tato komplexní chemická struktura vzniká. Je pravděpodobné, že bez Shimomurovy pionýrské práce (s využitím klasických biochemických a spektroskopických metod) by se éra fluorescenčních proteinů výrazně oddálila, popřípadě by zelený fluorescenční protein zůstal tajemstvím ukrytým v Tichém oceánu.
„Zcizení“ fluorescenčního proteinu a využití jinde (role Martina Chalfieho)
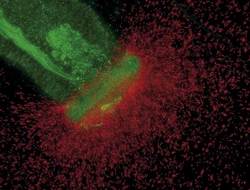 Klonovat a přečíst celý gen pro zelený fluorescenční protein se zdařilo Douglasi Prasherovi v roce 1992. V té době se všeobecně soudilo, že k vytvoření absorpčního centra (obrázek 1) bude potřeba enzymatický aparát mateřské medúzy. Proto nikdo neočekával, že by se zelený protein dal využít jako fluorescenční značka syntetizovaná v jiných organismech. Spontánní nekatalyzovaná transformace sekvence serin-tyrosin-glycin (která byla mezitím opakovaně potvrzena jako prekurzor chromoforové struktury) na p-hydroxybenzylideneimidazilonu se zdála být nereálná. Zde vstupuje na scénu Martin Chalfie, který strávil svůj postdoktorandský pobyt v laboratoři Sidneyho Brennera (laureáta Nobelovy ceny za fyziologii a medicínu z roku 2002) studiem vývoje neuronů v háďátku obecném (Caenorhabditis elegans). Když poprvé slyšel o zeleném fluorescenčním proteinu, nadchl se pro možnost syntetizovat v háďátku proteiny, které sám studoval s připojeným zeleným fluorescenčním proteinem jako fluorescenční značkou. Poté, co v roce 1992 přesídlil na Kolumbovu univerzitu, podařilo se mu získat od Prashera gen pro zelený fluorescenční protein.
Klonovat a přečíst celý gen pro zelený fluorescenční protein se zdařilo Douglasi Prasherovi v roce 1992. V té době se všeobecně soudilo, že k vytvoření absorpčního centra (obrázek 1) bude potřeba enzymatický aparát mateřské medúzy. Proto nikdo neočekával, že by se zelený protein dal využít jako fluorescenční značka syntetizovaná v jiných organismech. Spontánní nekatalyzovaná transformace sekvence serin-tyrosin-glycin (která byla mezitím opakovaně potvrzena jako prekurzor chromoforové struktury) na p-hydroxybenzylideneimidazilonu se zdála být nereálná. Zde vstupuje na scénu Martin Chalfie, který strávil svůj postdoktorandský pobyt v laboratoři Sidneyho Brennera (laureáta Nobelovy ceny za fyziologii a medicínu z roku 2002) studiem vývoje neuronů v háďátku obecném (Caenorhabditis elegans). Když poprvé slyšel o zeleném fluorescenčním proteinu, nadchl se pro možnost syntetizovat v háďátku proteiny, které sám studoval s připojeným zeleným fluorescenčním proteinem jako fluorescenční značkou. Poté, co v roce 1992 přesídlil na Kolumbovu univerzitu, podařilo se mu získat od Prashera gen pro zelený fluorescenční protein.
 Ještě tentýž rok syntetizoval (exprimoval) zelený fluorescenční protein v bakterii Escherichia coli. K velkému nadšení celého týmu tato bakterie s vneseným genem pro zelený fluorescenční protein po ozáření modrým světlem intenzivně zeleně fluoreskovala. Tak byla zodpovězena otázka, zda je možné fluorescenčně kompetentní zelený protein exprimovat i v jiných organismech než Aequoerea a zda komplexní struktura chromoforového centra může vzniknout spontánně bez přítomnosti specifických enzymů mateřského organismu. Své výsledky o expresi zeleného fluorescenčního proteinu v bakterii E. coli nebo v háďátku publikovali v únoru 1994 (Science 263, 802–805, 1994) a ještě téhož roku byl zelený fluorescenční protein exprimován v octomilce (Drosophila melanogaster), savčích buňkách a kvasinkách. Všude si zachoval fluorescenci, dokonce i tehdy, když byl připojen k jinému proteinu. Tak byla spuštěna lavina aplikací zeleného fluorescenčního proteinu v nejrůznějších systémech a hned v následujícím roce 1995 byla publikována spousta prací.
Ještě tentýž rok syntetizoval (exprimoval) zelený fluorescenční protein v bakterii Escherichia coli. K velkému nadšení celého týmu tato bakterie s vneseným genem pro zelený fluorescenční protein po ozáření modrým světlem intenzivně zeleně fluoreskovala. Tak byla zodpovězena otázka, zda je možné fluorescenčně kompetentní zelený protein exprimovat i v jiných organismech než Aequoerea a zda komplexní struktura chromoforového centra může vzniknout spontánně bez přítomnosti specifických enzymů mateřského organismu. Své výsledky o expresi zeleného fluorescenčního proteinu v bakterii E. coli nebo v háďátku publikovali v únoru 1994 (Science 263, 802–805, 1994) a ještě téhož roku byl zelený fluorescenční protein exprimován v octomilce (Drosophila melanogaster), savčích buňkách a kvasinkách. Všude si zachoval fluorescenci, dokonce i tehdy, když byl připojen k jinému proteinu. Tak byla spuštěna lavina aplikací zeleného fluorescenčního proteinu v nejrůznějších systémech a hned v následujícím roce 1995 byla publikována spousta prací.
Vylepšení jednoho fluorescenčního proteinu a objev dalších (na scénu vstupuje Roger Tsien)
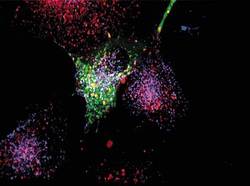 Průlomem pro pochopení vzniku chromoforového centra zeleného fluorescenčního proteinu byla jeho exprese v E. coli za anaerobních podmínek. Zelený protein pak nefluoreskuje, i když je jinak správně sbalen do „soudku“. Fluorescence se postupně objevovala po přidání kyslíku, a to i v buněčných lyzátech, kde neprobíhala nová proteosyntéza. Tsien a jeho kolegové tedy usoudili, že fluorescenční chromofor vzniká spontánně s využitím kyslíku jako jediného kofaktoru – a to až po sbalení proteinu po dokončeném překladu. Navrhli správné reakční schéma pro vytvoření absorpčního centra a připravili mutantní varianty fluorescenčního proteinu se zásadními efekty na absorpční charakteristiky. Ukázali tak na možnost vylepšovat tento protein tak, aby se změnila jeho absorpční a emisní maxima (získat jiný odstín fluorescence) a kvantový výtěžek (zářivost). Zpočátku bylo vnášení bodových mutací víceméně náhodné, nedal se odhadnout vliv na absorpční centrum. Průlomem v racionalizaci tohoto úsilí bylo v roce 1996 rozluštění trojrozměrné struktury tohoto proteinu, na němž se R. Tsien též podílel. Kromě „vylepšování“ zeleného proteinu se R. Tsien věnoval vývoji variant dalšího fluorescenčního proteinu, a to DsRed, který izoloval Konstatntin A. Lukyanov s kolegy v roce 1999. Tsien se spolupracovníky charakterizoval strukturu chromoforového centra DsRed a způsob jak přetvořit tetramerní molekulu v monomer využitelný jako fluorescenční značka. Poté se R. Tsienovi a jeho spolupracovníkům podařilo připravit velké množství variant fluorescenčních proteinů s rozdílnou svítivostí, fotostabilitou a odstínem vyzařované fluorescence. Zásadním způsobem tak obohatil instrumentárium moderní biologie. Kromě vývoje vylepšených variant fluorescenčních proteinů se R. Tsien se spolupracovníky věnuje vývoji senzorů pro detekci vápenatých iontů, jejichž koncentrace se při mnoha důležitých biologických dějích výrazně mění a je důležité ji měřit za podmínek in vivo.
Průlomem pro pochopení vzniku chromoforového centra zeleného fluorescenčního proteinu byla jeho exprese v E. coli za anaerobních podmínek. Zelený protein pak nefluoreskuje, i když je jinak správně sbalen do „soudku“. Fluorescence se postupně objevovala po přidání kyslíku, a to i v buněčných lyzátech, kde neprobíhala nová proteosyntéza. Tsien a jeho kolegové tedy usoudili, že fluorescenční chromofor vzniká spontánně s využitím kyslíku jako jediného kofaktoru – a to až po sbalení proteinu po dokončeném překladu. Navrhli správné reakční schéma pro vytvoření absorpčního centra a připravili mutantní varianty fluorescenčního proteinu se zásadními efekty na absorpční charakteristiky. Ukázali tak na možnost vylepšovat tento protein tak, aby se změnila jeho absorpční a emisní maxima (získat jiný odstín fluorescence) a kvantový výtěžek (zářivost). Zpočátku bylo vnášení bodových mutací víceméně náhodné, nedal se odhadnout vliv na absorpční centrum. Průlomem v racionalizaci tohoto úsilí bylo v roce 1996 rozluštění trojrozměrné struktury tohoto proteinu, na němž se R. Tsien též podílel. Kromě „vylepšování“ zeleného proteinu se R. Tsien věnoval vývoji variant dalšího fluorescenčního proteinu, a to DsRed, který izoloval Konstatntin A. Lukyanov s kolegy v roce 1999. Tsien se spolupracovníky charakterizoval strukturu chromoforového centra DsRed a způsob jak přetvořit tetramerní molekulu v monomer využitelný jako fluorescenční značka. Poté se R. Tsienovi a jeho spolupracovníkům podařilo připravit velké množství variant fluorescenčních proteinů s rozdílnou svítivostí, fotostabilitou a odstínem vyzařované fluorescence. Zásadním způsobem tak obohatil instrumentárium moderní biologie. Kromě vývoje vylepšených variant fluorescenčních proteinů se R. Tsien se spolupracovníky věnuje vývoji senzorů pro detekci vápenatých iontů, jejichž koncentrace se při mnoha důležitých biologických dějích výrazně mění a je důležité ji měřit za podmínek in vivo.
Aequorin – chudý příbuzný zeleného fluoroscenčního proteinu?
 Zdrojem modrého světla je pro medúzu Aequoria chemická reakce, při níž dochází po vazbě kladně nabitých vápníkových iontů k rozkladu aequorinu na apoaequorin, coenteleramid a oxid uhličitý. Apoaequorin je malý protein složený ze 189 aminokyselin. Má tu vlastnost, že může být za přítomnosti kyslíku, coelenterazinu a za snížené koncentrace kladně nabitých vápníkových iontů regenerován na aequorin. Coelenterazin je organická sloučenina využívaná podobně jako luciferin v řadě luminiscenčních systémů (Renilla, Oplophorus, Periphylla, Gaussia). Emise modrého světla probíhá ve fotocytech, specializovaných buňkách, které jsou schopny regulovat cytoplazmatickou koncentraci vápenatých iontů. Po snížení koncentrace vápenatých iontů vzniká zeleně fluoreskující meziprodukt, který je možné pomocí coelenterazinu regenerovat na aequorin. V současné době je tento systém stále více využíván jako citlivý senzor koncentrace vápenatých iontů, zdaleka však není a zřejmě nikdy nebude natolik rozšířený jako zelený fluorescenční protein. Těžko však vytvářet dalekosáhlé soudy. S rozvojem luminiscenční mikroskopie se otevírá stále více aplikací pro různé typy luciferáz – možná že ta z medúzy se ještě proslaví a Osamo
Zdrojem modrého světla je pro medúzu Aequoria chemická reakce, při níž dochází po vazbě kladně nabitých vápníkových iontů k rozkladu aequorinu na apoaequorin, coenteleramid a oxid uhličitý. Apoaequorin je malý protein složený ze 189 aminokyselin. Má tu vlastnost, že může být za přítomnosti kyslíku, coelenterazinu a za snížené koncentrace kladně nabitých vápníkových iontů regenerován na aequorin. Coelenterazin je organická sloučenina využívaná podobně jako luciferin v řadě luminiscenčních systémů (Renilla, Oplophorus, Periphylla, Gaussia). Emise modrého světla probíhá ve fotocytech, specializovaných buňkách, které jsou schopny regulovat cytoplazmatickou koncentraci vápenatých iontů. Po snížení koncentrace vápenatých iontů vzniká zeleně fluoreskující meziprodukt, který je možné pomocí coelenterazinu regenerovat na aequorin. V současné době je tento systém stále více využíván jako citlivý senzor koncentrace vápenatých iontů, zdaleka však není a zřejmě nikdy nebude natolik rozšířený jako zelený fluorescenční protein. Těžko však vytvářet dalekosáhlé soudy. S rozvojem luminiscenční mikroskopie se otevírá stále více aplikací pro různé typy luciferáz – možná že ta z medúzy se ještě proslaví a Osamo  Shimomura bude aspirovat na další významná ocenění. Buňky s vneseným genem pro aequorin mohou syntetizovat pouze apoprotein – apoaequorin, pro luminiscenční aktivitu je třeba přidat ještě coelenterazin, který je schopen vstupovat do buněk a zde se spojit s apoaequorinem. Aequorin má oproti jiným vápníkovým indikátorům řadu výhod – např. neuniká z buněk, neovlivňuje buněčné funkce ani embryonální vývoj. Navíc pro jeho zviditelnění není potřeba žádné excitační světlo. Jednou z nevýhod je, že se coenterazid spotřebovává a neustále se musí do živného média dodávat.
Shimomura bude aspirovat na další významná ocenění. Buňky s vneseným genem pro aequorin mohou syntetizovat pouze apoprotein – apoaequorin, pro luminiscenční aktivitu je třeba přidat ještě coelenterazin, který je schopen vstupovat do buněk a zde se spojit s apoaequorinem. Aequorin má oproti jiným vápníkovým indikátorům řadu výhod – např. neuniká z buněk, neovlivňuje buněčné funkce ani embryonální vývoj. Navíc pro jeho zviditelnění není potřeba žádné excitační světlo. Jednou z nevýhod je, že se coenterazid spotřebovává a neustále se musí do živného média dodávat.
Zelený fluorescenční protein ve Vesmíru
- Jaroslav Petr, Vesmír 87, 440, 2008/7
- Petr Smýkal, Vesmír 87, 230, 2008/4
- Ivan Raška, Vesmír 83, 581, 2004/10
- Jaromír Plášek, Vesmír 83, 586, 2004/10
- Jaromír Plášek, Vesmír 83, 146, 2004/3
- Jaromír Kutík, Vesmír 80, 657, 2001/11
- Zdeněk Šesták, Vesmír 77, 302, 1998/6
- Zdeněk Šesták, Vesmír 76, 717, 1997/12
Poznámky
OSAMU SHIMOMURA (*27. října 1928 ve Fukuchiyamě)
 Japonský organický chemik a mořský biolog. Přežil výbuch atomové bomby v Nagasaki, se svou rodinou žil 20 km od epicentra. Vystudoval místní farmaceutickou fakultu a jako první vědecké téma řešil mechanismus luminiscence korýše Vargula hilgendorfii. Jeho práce zaujala profesora Franka Johnsona z Princetonské univerzity, jemuž se podařilo získat Shimomuru v roce 1960 do svého týmu. Zde se začal věnovat medúze Aequorea victoria, která skrývala velice využitelné tajemství, jehož odhalení bylo po téměř 50 letech oceněno Nobelovou cenou.
Japonský organický chemik a mořský biolog. Přežil výbuch atomové bomby v Nagasaki, se svou rodinou žil 20 km od epicentra. Vystudoval místní farmaceutickou fakultu a jako první vědecké téma řešil mechanismus luminiscence korýše Vargula hilgendorfii. Jeho práce zaujala profesora Franka Johnsona z Princetonské univerzity, jemuž se podařilo získat Shimomuru v roce 1960 do svého týmu. Zde se začal věnovat medúze Aequorea victoria, která skrývala velice využitelné tajemství, jehož odhalení bylo po téměř 50 letech oceněno Nobelovou cenou.MARTIN CHALFIE (*1. února 1947 v Chicagu)
 Absolvoval biochemii na harvardově univerzitě. Mj. je skvělý plavec. Po absolutoriu vystřídal několik dočasných zaměstnání, například prodával oblečení v rodinné firmě, a poté nastoupil na postdoktorandský pobyt do laboratoře molekulární biologie Sydneyho Brennera v britské Cambridži, kde studoval hmatové neurony háďátka obecného (Caenorhabditis elegans). V roce 1982 přesídlil na Kolumbovu univerzitu v New Yorku, kde ve studiu C. elegans pokračoval. Jeho práce „Zelený fluorescenční protein jako marker genové exprese“ patří mezi 20 nejcitovanějších publikací z molekulární biologie a genetiky.
Absolvoval biochemii na harvardově univerzitě. Mj. je skvělý plavec. Po absolutoriu vystřídal několik dočasných zaměstnání, například prodával oblečení v rodinné firmě, a poté nastoupil na postdoktorandský pobyt do laboratoře molekulární biologie Sydneyho Brennera v britské Cambridži, kde studoval hmatové neurony háďátka obecného (Caenorhabditis elegans). V roce 1982 přesídlil na Kolumbovu univerzitu v New Yorku, kde ve studiu C. elegans pokračoval. Jeho práce „Zelený fluorescenční protein jako marker genové exprese“ patří mezi 20 nejcitovanějších publikací z molekulární biologie a genetiky.ROGER YONCHIEN TSIEN (*1. února 1952 v New Yorku)
 Americký biochemik, profesor na katedře chemie a biochemie Kalifornské univerzity v San Diegu. Je potomkem královské rodiny, která vládla v letech 907–960 malému pobřežnímu nezávislému království Wuyue, přesněji 34. vnukem krále Qian Liu. Pocházel z rodiny významných inženýrů, možná proto nazývá svou práci molekulárním inženýrstvím. Jako astmatické dítě trávil většinu času doma prováděním chemických experimentů. Roku 1972 absolvoval bakalářské studium na Harvardově univerzitě. Ve studiu pokračoval na cambridžské univerzitě, kde získal Ph.D. v oboru fyziologie. Od roku 1989 působí na Kalifornské univerzitě v San Diegu.
Americký biochemik, profesor na katedře chemie a biochemie Kalifornské univerzity v San Diegu. Je potomkem královské rodiny, která vládla v letech 907–960 malému pobřežnímu nezávislému království Wuyue, přesněji 34. vnukem krále Qian Liu. Pocházel z rodiny významných inženýrů, možná proto nazývá svou práci molekulárním inženýrstvím. Jako astmatické dítě trávil většinu času doma prováděním chemických experimentů. Roku 1972 absolvoval bakalářské studium na Harvardově univerzitě. Ve studiu pokračoval na cambridžské univerzitě, kde získal Ph.D. v oboru fyziologie. Od roku 1989 působí na Kalifornské univerzitě v San Diegu.Ke stažení
 článek ve formátu pdf [329,05 kB]
článek ve formátu pdf [329,05 kB]
O autorovi
Jan Černý
















