Krystalizace ve výrobě léků
V roce 1963 prohlásil Walter McCrone: „Každá molekula je potenciálně polymorfní, počet jejích polymorfů závisí pouze na množství peněz, času a energie investovaných do jejího výzkumu.“
V roce 1988 konstatoval John Maddox: „Je skandální, že teoretická fyzika stále neumí předpovědět krystalovou strukturu látky pouze z jejího vzorce.“
V roce 2003 napsal Jack Dunitz: „Ačkoliv se fyzici blíží formulování univerzální teorie všeho, stále postrádáme teorii krystalizace. Je snad tvorba krystalů komplikovanější než utváření vesmíru?“
Ačkoliv byly tyto výroky proneseny v rozmezí čtyřiceti let, jsou dosud platné.
Tajuplná krystalizace
Krystalizace je jedním z důležitých procesů v přírodě a člověk se s ní poprvé setkal asi při odpařování moří nebo při mrznutí vody. Později ji začali lidé využívat ve výrobě jako separační a čisticí proces. Krystaly vznikají nejčastěji z kapalné fáze postupy, které jsou založeny na vytvoření přesyceného, resp. přechlazeného roztoku. Nejde o samovolný děj, musí být něčím vyvolán. Dochází k procesu, při kterém se původně nahodile orientované molekuly skládají do vnitřně uspořádaných krystalů (supramolekul). Krystalizační proces zahrnuje dva hlavní kroky: vznik krystalizačních zárodků (nukleaci) a růst krystalů. Zárodky se mohou zvětšovat, ale i rozpadat a vznikat na jiném místě v roztoku. Pokud však dosáhnou kritické velikosti (nuklea), jsou schopny růst v druhé etapě krystalizace (již se nerozpadají). Teorie krystalizace celý proces dobře popisuje, ale stále není úplně jasné jak krystalizaci cíleně řídit. Tento nedostatek je zvláště tíživý při krystalizaci polymorfních farmaceutických substancí – a právě ty měl Jack Dunitz na mysli, když se zamýšlel nad komplikovaností krystalizace.
Teorie krystalizace celý proces dobře popisuje, ale stále není úplně jasné jak krystalizaci cíleně řídit. Tento nedostatek je zvláště tíživý při krystalizaci polymorfních farmaceutických substancí – a právě ty měl Jack Dunitz na mysli, když se zamýšlel nad komplikovaností krystalizace.
Léčivá látka spolu s přídavnými látkami tvoří tabletu. Jak se taková léčivá látka vyrábí? Většinou krystalizací. V roztoku je přítomna řada stavebních jednotek – molekuly, dimery, trimery – a všechny jsou obklopeny molekulami rozpouštědla. Při určitém přesycení roztoku nastává nukleace, tedy zrod molekulových agregátů. Způsob připojování dalších molekul k agregátu je stále stejný, jak to jednou začne, tak se buduje jedinečná trojrozměrná krystalová struktura (supramolekula). Další stavební jednotky (molekuly) k rostoucí krystalické fázi plavou v nahodilé orientaci, a ta si je musí nejdřív zorientovat, a potom navázat. Navíc musí rostoucí krystalická fáze rozpoznat dimer nebo trimer, který se do „skládanky“ nehodí (má „špatně“ spojené molekuly), a tyto stavební jednotky nesmí použít. Jakmile se krystalizace jednou rozběhne, je zvenčí těžko ovlivnitelná. A právě schopnost samouspořádání a odlišení toho, co se do „skládanky“ nehodí, je na krystalizaci fascinující. Růst krystalu se však může z nějakých důvodů (například z nedostatku stavebního materiálu) zastavit. Úkolem technologů je zajistit, aby krystalizaci léčivých látek nic nežádoucího nerušilo.
Polymorfizmus – problém ve výrobě léků
Cílenou krystalizaci léčivých látek (substancí) ve farmaceutické výrobě komplikuje polymorfizmus. V závislosti na krystalizačních podmínkách v prenukleačním stadiu může stavební jednotka (molekula) vykrystalovat v různých krystalových strukturách neboli polymorfech (z řeckého polys – mnohý, morfé – tvar). Vznik polymorfů můžeme ilustrovat na stavbě zdi (obrázek 1). Z „cihel“ jedné velikosti a tvaru (molekul jednoho druhu) můžeme postavit „zdi“ různého vzoru (polymorfy). Mezi farmaceutickými substancemi je polymorfizmus rozšířeným jevem (viz příklad na obrázek 2) a zdá se, že tvrzení W. McCroneho platí dokonale. Počty nově popsaných polymorfů a jejich solvátů (hydrátů) rostou úměrně tomu, jak velká pozornost je molekule věnována. Na druhé straně však u tak známé sloučeniny, jakou je sacharóza, nebyl dosud polymorfizmus pozorován, ač k tomu existuje dispozice (přítomnost skupin OH). Vysvětlení nám chybí.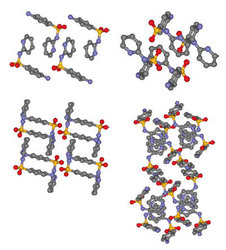 Podmínek, které ovlivňují cílenou krystalizaci, je řada (viz rámeček „Co ovlivňuje průběh krystalizace?“ 1 ). Některé jsou jen těžko postřehnutelné a ve výrobním měřítku by se těžko daly sledovat. Farmaceutická výroba se vyhýbá problémům tím, že používá očkovanou krystalizaci, to znamená, že se do roztoku přidává krystalizační očko požadovaného produktu. V průmyslové praxi to často znamená desítky kilogramů oček na jednu výrobní šarži. Očkovaná krystalizace vychází ze zkušenosti a nemusí být univerzálním řešením. I u technologie, jež byla dosud bezproblémová a vedla vždy k požadovanému polymorfu, může dojít k jevu, který Jack Dunitz spolu s Joelem Bernsteinem nazvali „ztracený polymorf“. Stává se, že se dlouho vyráběný polymorf najednou „pokazí“. Zřejmě se vytvoří mikroskopické zárodky (prenuklea) jiného, stabilnějšího polymorfu a dostanou se do krystalizačního zařízení, popřípadě jsou přítomny ve vzduchu, a tak nám může potom tvrdošíjně krystalizovat něco, co nechceme. Příkladem je výskyt nežádoucího (druhého) polymorfu ritonaviru (inhibitoru průběhu aidsu), který kontaminoval výrobu ve firmě Abbott Laboratories po dvou letech bezproblémové produkce.
Podmínek, které ovlivňují cílenou krystalizaci, je řada (viz rámeček „Co ovlivňuje průběh krystalizace?“ 1 ). Některé jsou jen těžko postřehnutelné a ve výrobním měřítku by se těžko daly sledovat. Farmaceutická výroba se vyhýbá problémům tím, že používá očkovanou krystalizaci, to znamená, že se do roztoku přidává krystalizační očko požadovaného produktu. V průmyslové praxi to často znamená desítky kilogramů oček na jednu výrobní šarži. Očkovaná krystalizace vychází ze zkušenosti a nemusí být univerzálním řešením. I u technologie, jež byla dosud bezproblémová a vedla vždy k požadovanému polymorfu, může dojít k jevu, který Jack Dunitz spolu s Joelem Bernsteinem nazvali „ztracený polymorf“. Stává se, že se dlouho vyráběný polymorf najednou „pokazí“. Zřejmě se vytvoří mikroskopické zárodky (prenuklea) jiného, stabilnějšího polymorfu a dostanou se do krystalizačního zařízení, popřípadě jsou přítomny ve vzduchu, a tak nám může potom tvrdošíjně krystalizovat něco, co nechceme. Příkladem je výskyt nežádoucího (druhého) polymorfu ritonaviru (inhibitoru průběhu aidsu), který kontaminoval výrobu ve firmě Abbott Laboratories po dvou letech bezproblémové produkce.
Mezi všemi polymorfy určité substance je za definovaných podmínek vždy jeden polymorf stabilní a ostatní nestabilní. K výrobě tablety se mohou hodit i ty nestabilní – například proto, že jsou rozpustnější. Výhody nestabilních polymorfů jsou však vykoupeny problémy s jejich krystalizací a kratší dobou použitelnosti (expirací). V každém případě musí farmaceutická výroba produkovat vysoce čistý polymorf a nesmí dopustit přechod mezi polymorfy v různých etapách farmaceutické výroby, popř. při skladování léčiva do jeho expirace. Energetický rozdíl mezi dvěma polymorfy může být někdy menší než 6 kJ/mol, takže přechod z jednoho na druhý může být snadný. Méně stabilní polymorfy vždy přecházejí na stabilnější, nikdy naopak. Polymorfní čistotu farmaceutických substancí přísně kontrolují státní regulační úřady (např. v USA všemocný Food and Drug Administration a u nás Státní ústav pro kontrolu léčiv).
Co by přinesla záměna polymorfů?
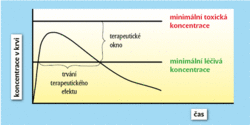
Po spolknutí se tableta v zažívacím traktu postupně rozpouští a molekuly léčivé látky po překonání střevní membrány vstupují do krevního oběhu, který je dovede k cílovým biologickým makromolekulám – receptorům. K nim se nedostanou všechny molekuly, řada se jich poztrácí nebo rozloží a pouze ty, které se navážou, ovlivní terapeuticky chemizmus buňky.Kromě molekulové struktury aktivní substance je však důležitá i její krystalová struktura (polymorf), která výrazně ovlivňuje rychlost rozpouštění léčiva v organizmu (obrázek 3). Různé polymorfy jedné aktivní substance (například polymorfy antibiotik premafloxacinu I a III či chloramfenikolu palmitátu A a B) se mohou lišit v rychlosti rozpouštění až o řád, takže se u méně rozpustného polymorfu nedosáhne ani minimální léčivé koncentrace. Pacient by užíval léčivo, které by mu nepomáhalo. I když u žádného léku nebyl naštěstí pozorován případ, kdy by záměna polymorfů poškodila pacientovo zdraví, jsou farmaceutické firmy a regulační úřady velmi opatrné. 1) Například zmíněný ritonavir musel být v roce 1999 přeformulován na kapalnou formu (Norvir®), protože problémy s jeho polymorfním chováním byly nezvládnutelné.
Polymorfizmus a farmaceutické firmy
 Polymorfizmus je problémem pouze pevných lékových forem, ovšem ty v produkci farmaceutických firem výrazně převažují (oproti kapalným formám mají mnoho výhod). Žádná farmaceutická firma si dnes nedovolí problém polymorfizmu ve svých lécích ignorovat.
Polymorfizmus je problémem pouze pevných lékových forem, ovšem ty v produkci farmaceutických firem výrazně převažují (oproti kapalným formám mají mnoho výhod). Žádná farmaceutická firma si dnes nedovolí problém polymorfizmu ve svých lécích ignorovat.
Farmaceutický průmysl je velmi bohatý, ročně se na světě prodá léků za 650 miliard amerických dolarů. Ovšem jen ty nejbohatší světové farmaceutické firmy, tzv. originátoři, si mohou dovolit vyvinout nové léčivo. Tento proces trvá okolo 8 let a je velmi drahý (stojí až 1 miliardu amerických dolarů). Kromě toho může být kdykoliv zastaven, ať už z důvodů vývojových, finančních nebo patentových. Celosvětově se za rok vyvine asi 30 nových aktivních substancí a toto číslo neustále klesá. Originátoři si své produkty chrání řadou důmyslných patentů. Teprve po skončení patentové ochrany mohou léčivo produkovat a prodávat generické firmy, které jsou finančně daleko slabší než originátoři, a proto raději podstupují menší riziko. Jejich produkt (generikum) však není pouhou kopií originálu, může být např. použit jiný polymorf. Generikum může být i progresivnější, protože během patentové ochrany byly odstraněny vady originálu. Když je generikum uvedeno na trh, cena originálu klesne. To se samozřejmě originátorům nelíbí a nejradši by při vývoji nové aktivní substance „zapatentovali“ všechny její polymorfy. 2) K tomu by se jim hodilo, kdyby uměli všechny potenciální polymorfy vypočítat a patentovat (viz konstatování Johna Maddoxe v úvodu), a tím generické firmy vyřadili z trhu. Krystalovou strukturu zatím umíme stanovit pouze experimentálně, měřením difrakce (ohybu) rentgenových paprsků na krystalu studované látky. Teoretická předpověď polymorfizmu ovšem dosud zůstává v rovině snů. Toho, kdo to dokáže, Nobelova cena nejspíš nemine.
Poznámky
CO OVLIVŇUJE PRŮBĚH KRYSTALIZACE?
Produkci zvoleného polymorfu ve farmaceutické výrobě a možné polymorfní přechody ovlivňují především tyto faktory:- teplota a tlak při krystalizaci,
- rychlost ochlazování nebo odpařování roztoku,
- stupeň přesycení roztoku,
- zvolené rozpouštědlo (srážedlo), resp. směs rozpouštědel,
- obsah vody ve finálním rozpouštědle,
- přítomnost nečistot a aditiv v roztoku,
- rychlost dosažení přesyceného roztoku,
- doba stání produktu v matečném roztoku,
- intenzita míchání roztoku,
- koncentrační a teplotní gradienty v roztoku,
- zvukové, ultrazvukové, mikrovlnné, laserové, akustické či jiné rázy.
Ke stažení
 článek v souboru pdf [281 kB]
článek v souboru pdf [281 kB]

























