Víc než pouhý mikroskop
 První prakticky použitelný konfokální mikroskop – mikroskop s dvojitým řádkováním, který vznikl s přispěním českých vědců M. Petráně a M. Hadravského koncem šedesátých let minulého století – byl založen na principu rotujícího Nipkowova kotouče se spirálou dírek. 2) Přibližně o deset let později se objevily laserové skenovací konfokální mikroskopy (zavedený akronym je LSCM), které se oproti mikroskopům s dvojitým řádkováním vyznačují vyšší intenzitou excitačního světla při práci ve fluorescenčním modu. Současná role LSCM je natolik dominantní, že si většina uživatelů pod konfokální mikroskopií představí již jen laserovou skenovací metodu. Vše, co předesílá název tohoto článku, se vlastně týká pouze druhé konfokální metody.
První prakticky použitelný konfokální mikroskop – mikroskop s dvojitým řádkováním, který vznikl s přispěním českých vědců M. Petráně a M. Hadravského koncem šedesátých let minulého století – byl založen na principu rotujícího Nipkowova kotouče se spirálou dírek. 2) Přibližně o deset let později se objevily laserové skenovací konfokální mikroskopy (zavedený akronym je LSCM), které se oproti mikroskopům s dvojitým řádkováním vyznačují vyšší intenzitou excitačního světla při práci ve fluorescenčním modu. Současná role LSCM je natolik dominantní, že si většina uživatelů pod konfokální mikroskopií představí již jen laserovou skenovací metodu. Vše, co předesílá název tohoto článku, se vlastně týká pouze druhé konfokální metody.
obraz stvořený počítačem
Konfokální mikroskopie spočívá v zobrazování pozorovaného objektu cestou postupného ozařování jeho jednotlivých bodů zaostřeným paprskem světla. V případě LSCM vytváří mikroskopický obraz objektu až řídící počítač, a to na základě intenzity fluorescence měřené bod po bodu, které postupně ozařuje zaostřený laserový paprsek. Konfokální 3) dírková clonka, která je před detektorem světelné intenzity přesně v místě, kde objektiv mikroskopu vytváří obraz ozářeného bodu objektu, potlačuje fluorescenci přicházející z míst ležích pod či nad ozářeným bodem. Konfokální mikroskopie proto skýtá obraz jen zaostřené roviny bez rozmazaného pozadí rovin okolních. Při postupném zaostřování do různých hloubek lze získat sérii optických řezů vzorkem, z nichž speciální (dnes však již nijak výjimečný) software dokáže vytvořit trojrozměrné obrazy; buď nabídne reálný prostorový vjem prostřednictvím stereoskopických párů, nebo umožní objektem „otáčet“ a dívat se na něj z různých stran (Vesmír 79, 137, 2000/3).Vyšší informační hodnota mikroskopických obrazů, která souvisela s potlačením neostrého pozadí, byla v prvních dvou dekádách konfokální mikroskopie mimořádně významným, ale i jediným přínosem. Při postupném snímání obrazu bod po bodu lze poměrně snadno zobrazit fluoreskující objekty současně v několika oddělených spektrálních oblastech. Toho dnes využívají vylepšené skenovací metody. Pomocí klasického mikroskopu s fotoaparátem nelze takové obrazy získat bez časových prodlev nutných pro výměnu barevných filtrů, přes něž objekt pozorujeme.
 V konfokálním mikroskopu stačí před konfokální clonkou rozdělit do několika svazků záření, které zachytil objektiv. Po účelně zvolené spektrální filtraci světla těchto svazků následuje měření světelné intenzity na několika detektorech s konfokálními clonkami (viz příklad v rámečku 1 ). 4) Významné je, že použitím několika spektrálně selektivních konfokálních detektorů současně se zcela zachovají prostorové vztahy spektrálně odlišných obrazů fluoreskujících objektů (během skenování totiž neustále detekujeme pouze záření, které přichází z místa, do něhož byl právě zaostřen excitační laserový paprsek). To klasická mikroskopie neumožňuje, protože vyžaduje mechanickou výměnu filtrů. Při současné detekci více spektrálních složek fluorescenčního obrazu se navíc vyhneme riziku artefaktů, které se mohou objevit při porovnávání dílčích spektrálních obrazů. 5) Všichni velcí výrobci mikroskopů (konkrétně Bio-Rad Cellscience Division, Carl Zeiss, Leica Microsystems, Nikon Corporation a Olympus Optical), ale i řada menších, proto nabízejí konfokální mikroskopy s vícesvazkovou detekcí.
V konfokálním mikroskopu stačí před konfokální clonkou rozdělit do několika svazků záření, které zachytil objektiv. Po účelně zvolené spektrální filtraci světla těchto svazků následuje měření světelné intenzity na několika detektorech s konfokálními clonkami (viz příklad v rámečku 1 ). 4) Významné je, že použitím několika spektrálně selektivních konfokálních detektorů současně se zcela zachovají prostorové vztahy spektrálně odlišných obrazů fluoreskujících objektů (během skenování totiž neustále detekujeme pouze záření, které přichází z místa, do něhož byl právě zaostřen excitační laserový paprsek). To klasická mikroskopie neumožňuje, protože vyžaduje mechanickou výměnu filtrů. Při současné detekci více spektrálních složek fluorescenčního obrazu se navíc vyhneme riziku artefaktů, které se mohou objevit při porovnávání dílčích spektrálních obrazů. 5) Všichni velcí výrobci mikroskopů (konkrétně Bio-Rad Cellscience Division, Carl Zeiss, Leica Microsystems, Nikon Corporation a Olympus Optical), ale i řada menších, proto nabízejí konfokální mikroskopy s vícesvazkovou detekcí.
Laserové skenovací konfokální mikroskopy a spektrální analýzy
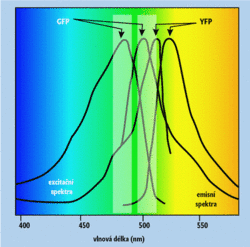
K čemu je dobrá mikroskopie kombinovaná se spektrální analýzou? Odpověď souvisí s rostoucí složitostí fluorescenčních metod, které se staly významným nástrojem experimentální buněčné biologie. 6) Jejich aplikace vycházejí z vícenásobného barvení buněk, při němž se stanovuje intenzita fluorescence několika různých barviv současně, často dokonce ve stejném místě. Jako příklad mohou posloužit studie nitrobuněčné lokalizace a dynamiky vybraných proteinů, označených některou ze spektrálních variant zeleného flurescenčního proteinu. 7) Jiným příkladem je vícebarevná fluorescenční analýza karyotypů, při níž se identifikace chromozomů opírá o relativní poměr intenzit fluorescence tří barviv (FITC, Cy3 a Cy5).Pro valnou část kombinací fluorescenčních barviv používaných při vícebarevném značení studovaných vzorků je typické, že se excitační a emisní spektra fluorescence jednotlivých barviv značně překrývají. Pak ani pomocí nejkvalitnějších optických filtrů nelze dosáhnout toho, aby se buněčné struktury obarvené konkrétním barvivem daly pozorovat bez rušivého vlivu fluorescence barviv ostatních (obrázek 1). Toto je zvlášť kritické, jestliže se míchají různá barviva i prostorově, například při stejném umístění dvou různých bílkovin obarvených zeleným (GFP) a žlutým (YFP) fluorescenčním proteinem. Nepříjemná je také autofluorescence značených buněk, velice častá a intenzivní zejména u buněk rostlinných. Při mikroskopické technice FRET 8) potřebujeme od sebe oddělit fluorescenci donorů a akceptorů, protože efektivní přenos excitační energie z donoru na akceptor je mírou jejich nanometrových vzdáleností.
 Všechny tyto případy lze řešit pomocí spektrálního zobrazování a následného spektrálního oddělení příspěvků jednotlivých fluoreskujících složek. Spektrálním zobrazováním se míní pořízení série obrazů při měnící se vlnové délce detekované fluorescence (.série). Pro každý obrazový element (pixel) takto získáme intenzitu fluorescence v podobě funkce vlnové délky (obrázek 2). Vlastní spektrální oddělení je poměrně jednoduchý algebraický úkol rovnající se stanovení koeficientů pro určení podílů spekter jednotlivých fluoreskujících složek ve spektru naměřeném při spektrálním zobrazení vzorku. Procedura ovšem vyžaduje znát předem čistá spektra všech sond a značek, kterými byl vzorek obarven (popřípadě také spektrum autofluorescence, kdyby přispívala k celkové fluorescenci vzorku). Výpočet se provádí pro každý pixel zvlášť, což nakonec vede k čistým obrazům rozložení jednotlivých fluoreskujících složek ve studovaných objektech. Pomocí současných multispektrálních konfokálních mikroskopů lze takto najednou zobrazit až osm fluorescenčních indikátorů. 9)
Všechny tyto případy lze řešit pomocí spektrálního zobrazování a následného spektrálního oddělení příspěvků jednotlivých fluoreskujících složek. Spektrálním zobrazováním se míní pořízení série obrazů při měnící se vlnové délce detekované fluorescence (.série). Pro každý obrazový element (pixel) takto získáme intenzitu fluorescence v podobě funkce vlnové délky (obrázek 2). Vlastní spektrální oddělení je poměrně jednoduchý algebraický úkol rovnající se stanovení koeficientů pro určení podílů spekter jednotlivých fluoreskujících složek ve spektru naměřeném při spektrálním zobrazení vzorku. Procedura ovšem vyžaduje znát předem čistá spektra všech sond a značek, kterými byl vzorek obarven (popřípadě také spektrum autofluorescence, kdyby přispívala k celkové fluorescenci vzorku). Výpočet se provádí pro každý pixel zvlášť, což nakonec vede k čistým obrazům rozložení jednotlivých fluoreskujících složek ve studovaných objektech. Pomocí současných multispektrálních konfokálních mikroskopů lze takto najednou zobrazit až osm fluorescenčních indikátorů. 9)
Moderní konfokální mikroskopy (a to nejen špičkové multispektrální přístroje, jimž je věnován článek) nabízejí také pokročilé metody zpracování obrazu, např. identifikaci fluoreskujících objektů spojenou s interaktivním měřením jejich objemu nebo plochy povrchu, měření vzdáleností v trojrozměrném prostoru nebo rekonstrukci drah pohybujících se objektů.
Sílící proud důmyslných metod
Vedle nesporného přínosu laserových skenovacích konfokálních mikroskopů v zobrazovací a analytické oblasti se tyto přístroje začínají uplatňovat také v experimentech, které vyžadují měnit řízeným způsobem intenzitu a rozsah skenování excitačního laserového paprsku. Příkladem takového použití je měření rychlosti difuze membránových a cytoplazmatických komponent metodou FRAP. 10) Objevil se již také mikroskop, který kombinuje různé typy excitačních laserů umožňujících fotochemickou stimulaci vzorku v definovaných místech a s definovaným předstihem před vlastním pozorováním následující odezvy vhodných fluorescenčních indikátorů. 11) Není vyloučeno, že podobná vylepšení konfokálních mikroskopů budou brzy pro experimentální buněčnou biologii stejným přínosem, jakým se stal samotný LSCM.Poznámky
KONFOKÁLNÍ MIKROSKOP S MŘÍŽKOVÝMI SPEKTROFOTOMETRY
Protože pozorování fluorescenčním konfokálním mikroskopem (obrázek 3) zpravidla souvisí s různými aplikacemi fluorescenčních sond a značek, které mají široká emisní spektra bez jemné struktury, jsou nároky na mezní spektrální rozlišovací schopnost těchto mikroskopů poměrně nízké (jen 2 nm). Spektrální rozlišovací schopnost optických mřížek roste s celkovým počtem jejich štěrbin (tj. paralelních mikroskopických vrypů v kovovém zrcadle), proto k dosažení potřebné rozlišovací schopnosti stačí optické mřížky malých rozměrů – dostatečně lehké na to, aby se mohly natáčet pomocí jednoduchých galvanometrických systémů, stejných, jaké slouží k natáčení skenovacích zrcadel. Galvanometricky natáčené mřížky umožňují rychlé přelaďování vybraných vlnových délek detekované fluorescence (až 100 nm/msec), přičemž výsledný spektrální rozsah detekované fluorescence je určen natočením mřížky a nastavením šířky výstupní štěrbiny spektrofotometru, které je řízeno počítačem.
Ke stažení
 článek v pdf souboru [286,29 kB]
článek v pdf souboru [286,29 kB]
O autorovi
Jaromír Plášek
















