Technologicky náročné tkáňové náhrady
Poškozené tkáně se sice obnovují, ale rozsáhlá regenerace tkání a orgánů je u člověka vyloučena. Proto lékaři hledají, jak poškozené tkáně nahradit. Z funkčního hlediska je nejvhodnější náhradou transplantát. Z chirurgického hlediska byly transplantace zvládnuty, přesto však jsou provázeny řadou biologických a etických problémů. Kromě jednovaječných dvojčat je každý člověk imunologicky suverénní genetickou jednotkou, která má své buněčné a tkáňové znaky. Imunitní systém příjemce na přítomnost štěpu reaguje zpravidla jako na cizorodou strukturu, již je třeba zničit. I když se pacient dočká transplantátu od dárce, jenž mu je imunologicky nejpodobnější, musí mu být po transplantaci farmakologicky snižována úroveň imunitní odpovědi. Tato léčba zvýší přežívání štěpu, může však vyvolat celkový pokles příjemcovy imunitní ochrany. Transplantátem mohou být přeneseny i původci různých onemocnění, nejčastěji viry. Dnes jsou dárci i jejich orgány a tkáně pečlivě vyšetřováni, nelze však vyloučit přenos neznámého původce onemocnění s dlouhou inkubační dobou. Vzhledem k tomu, že většina orgánových štěpů je přenášena z mrtvých dárců, hrají významnou roli i principy etické. Vhodných orgánů či tkání pro transplantace bude vždy nedostatek a tam, kde by to bylo možné, je výhodné nahradit štěp implantátem, tedy umělou náhradou. V klinické praxi se nejčastěji implantují umělé oční čočky a kyčelní klouby.
Biologická bezpečnost materiálů
Hlavním kritériem pro zavedení implantátu do praxe je jeho biologická bezpečnost. Stále se zpřísňují testy hodnotící bezpečnost materiálů, které přicházejí do styku s tkáněmi a krví pacientů. V Evropě byly tyto testy standardizovány a je patrná snaha sjednotit testování implantátů i s pravidly platnými v USA a Japonsku. Většina testů probíhá in vitro, tj. ve tkáňových kulturách, pokus na laboratorním zvířeti však není plně nahraditelný, neboť ve tkáňové kultuře zatím nelze vytvořit podmínky, které by napodobily organizmus jako celek. S rychlým rozvojem technologií in vitro počet použitých laboratorních zvířat klesá.Implantátové materiály (kovy, polymery, keramika) pochopitelně nesmějí být pro buňky jedovaté. Cytotoxicita se hodnotí v podmínkách tkáňových kultur. Ke kultivovaným buňkám se přidávají testované materiály či jejich výluhy. Toxické vlastnosti materiálů se zkoumají řadou vyšetření – od mikroskopického stanovení mrtvých a degenerovaných buněk až po popis jejich funkčního stavu.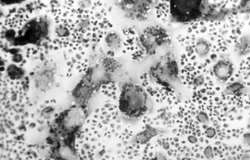
Testované vzorky nebo jejich extrakty a degradační produkty nesmějí ovlivňovat strukturu genetického materiálu (DNA), to by potom například v těhotenství mohly poškozovat embryo, nebo i vyvolat zhoubné bujení. Nejčastěji používaným testem je pokus na bakteriálních kulturách, kde náhlá změna jejich funkce je důsledkem nově vzniklé mutace podmíněné testovaným vzorkem. Tento test je vzhledem ke krátké generační době bakterií velmi výhodný a lze jím stanovit možný vliv i na vzdálenější potomstvo.
Ve tkáňových kulturách lze zjišťovat také vliv testovaného vzorku na funkci granulocytů, monocytů či lymfocytů. Sleduje se jejich přilnavost, rozprostření, výskyt aktivačních znaků či produkce prozánětlivých cytokinů. U materiálů na náhrady, které přijdou do kontaktu s krví (chlopně, cévní protézy, části „umělého srdce“), se navíc in vitro studuje adheze krevních destiček, produkce destičkových faktorů a vznik sraženin.
Po implantaci vzorku pokusnému zvířeti se histologicky hodnotí, jak tělo zvířete implantát snáší, jaký je stupeň zánětlivé odpovědi, opouzdření implantátu, vznik nádorů, popřípadě sraženin a vmetků. Histologicky se hodnotí také struktura životně důležitých orgánů (jako jsou játra, ledviny, slezina, srdce, plíce, mozek), které by mohly být poškozeny substancemi vylouženými z vlastního vzorku či produktem jeho biologické degradace. Kromě toho je funkce těchto orgánů zjišťována i biochemicky – ze vzorků séra.
Příjemcův imunitní systém
Imunitní rozpoznání syntetických netoxických materiálů je méně dramatické než transplantační reakce. Jeho intenzita většinou s časovým odstupem po implantaci klesá. Donedávna se tomuto jevu nevěnovala větší pozornost, v poslední době se však začaly stále častěji objevovat příznaky projevů autoimunity u pacientek, kterým byly implantovány silikonové prsní implantáty. Vysvětlení tohoto jevu na molekulární úrovni je zatím problematické, zdá se však, že souvisí s chronickým drážděním imunitního systému. I když projev autoimunity u pacientek s implantátem řada specialistů zpochybňuje, vzbudil zájem o imunologii syntetických materiálů používaných v klinické praxi.Ihned po implantaci začnou na sebe vzájemně působit implantát s makromolekulami obsaženými v biologických tekutinách (komplement, fibronektin, vitronektin, imunoglobuliny, albumin...). Adsorpce bílkovin, z nichž mnohé jsou vysoce bioaktivní, je překvapivě rychlá. Složení takto vzniklého povrchového filmu je závislé na povrchových vlastnostech implantátu: morfologii povrchu, náboji a volné povrchové energii. Na povrchu hydrofobních materiálů se zachycuje více biologicky aktivních bílkovin (např. fibronektinu) než na povrchu materiálů hydrofilních. Vysoká volná povrchová energie hydrofobních povrchů však tyto bílkoviny denaturuje, čímž klesá jejich biologická aktivita a buňky je špatně rozpoznávají. Naproti tomu zadržení biologicky aktivních bílkovin na povrchu vysoce hydrofilním je nízké. Přilnavost leukocytů k těmto povrchům je rovněž minimální.
Dosud se nepodařilo připravit pro implantace imunologicky netečný materiál, fázi chronického zánětu však lze oslabit. Imunologické rozpoznání bakterií, které do organizmu pronikly, probíhá na dvou úrovních. Nejdříve jsou bakterie rozpoznány interakcí s biologicky aktivními molekulami, a potom pohlceny fagocytujícími buňkami a usmrceny. Pokud tato nespecifická fáze selže, jsou bakterie ničeny specifickými imunologickými mechanizmy (např. protilátkami). Je zajímavé, že nespecifický krok velmi často selhává u bakterií, které nesou na svém povrchu některého ze zástupců rodiny sialových kyselin. Není prokázáno, zda má tento účinek celá molekula některé ze sialových kyselin, nebo její část. Zdá se však, že významnou úlohu by mohla hrát karboxylová funkční skupina. Řada pokusů ve tkáňových kulturách i výsledky implantací pokusným zvířatům ukázaly, že polymery nesoucí na povrchu karboxylové skupiny jsou mnohem více imunologicky tolerovány než podobné polymery bez karboxylových skupin. Z polymeru připraveného na podkladě zmíněných principů jsme vyvinuli nový typ nitroočních čoček. Ty svým tvarem napodobují přirozenou lidskou oční čočku a implantují se do čočkového pouzdra zadní oční komory pacientům, jimž byla jejich vlastní čočka pro šedý zákal odstraněna. Po úspěšných zkouškách v králičím oku (obrázek) se tento implantát zkouší klinicky.
Tkáňové inženýrství
Posledních 10 let přineslo rozvoj buněčné a molekulární biologie i věd o materiálu. Strukturálně byla charakterizována řada receptorů odpovědných za interakci buněk s mezibuněčnou hmotou a u řady z nich byla definována jejich role při regulaci buněčných funkcí. Zdá se, že interakce buněk s mezibuněčnou hmotou se podílí jak na řízení růstu buněk, tak na aktivaci řady důležitých genů. Z biologického hlediska je tedy v mezibuněčné hmotě uložena informace, která může být populací buněk s příslušnými receptory čtena. Laboratorní rutinou se stává přenos genů, což mohou tkáňoví inženýři využít. Vznikla řada nových organických i anorganických materiálů, a nanotechnologie umožňují dále měnit jejich povrchové vlastnosti. Například lze připravit strukturovaný povrch, jehož mikrodomény se liší různou afinitou k biologicky aktivním molekulám. Z těchto poznatků a nových technologií vzešlo i tkáňové inženýrství (vzniklo na Harvardově univerzitě a na Massachusettské technice).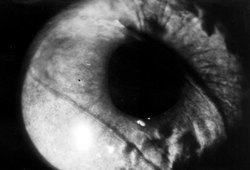
- Trojrozměrná síť („houba“) z vhodného polymerního materiálu (často degradabilního) se připraví ve tvaru chybějící tkáně (např. chrupavky ušního boltce). Na polymery tvořící tuto síť se zachytí molekuly, které jsou rozpoznávány receptory vhodných buněk. Z pacientova těla se odebere zdravý kousek tkáně, která má být rekonstruována. Buňky jsou separovány, namnoženy in vitro, a poté je jimi osídlena připravená polymerní síť. I když je tato technologie teprve v začátcích, je velmi perspektivní, neboť spojuje výhody transplantací a implantací. Tkáňové inženýrství připravilo řadu tkáňových náhrad, jako je chrupavka, vazivo, kost. Jejich nevýhodou je zatím vysoká cena.
- Duté orgány. Intenzivně se v laboratořích pracuje na náhradách jícnu, průdušnice, průdušek a močovodu (tyto orgány bývají často postiženy zhoubným bujením).
- Náhrada jater. Technologicky nejkomplikovanější náhradou je mimotělní podpůrný systém, který by dočasně nahrazoval funkci jater. Předběžné klinické výsledky s několika prototypy kolonizovanými lidskými (či zvířecími) jaterními buňkami ukázaly použitelnost této náhrady při léčbě pacientů s akutním jaterním selháním. Přístroj už několika lidem umožnil přežít kritické období do regenerace vlastních jater či nalezení vhodného dárcovského orgánu.
- Zásobárna růstových faktorů. Perspektivní se zdá být využití růstových faktorů, tj. proteinů, které podporují růst řady buněčných typů. Růstové faktory jsou v organizmu produkovány různými buňkami. Podílejí se na kontrole vývoje zárodku a mají nezastupitelnou roli při hojení ran. Podporují růst fibroblastů či osteoblastů, zlepšují přežívání neuronů apod. Jejich účinek může být závislý na druhu buňky. Pro některé z těchto faktorů je charakteristická interakce s mezibuněčnou hmotou, čímž vytvářejí jakási depa. Přitom si však ponechávají svou biologickou aktivitu. Připravuje se řada systémů, v nichž se růstové faktory zachytí do syntetické polymerní matrice či materiálu vytvořeného z hlavních složek mezibuněčné hmoty. Z těchto „skladišť“ by se růstové faktory postupně uvolňovaly a povzbuzovaly by hojení či regeneraci v pacientově těle. Překážkou širšího užití je vysoká cena růstových faktorů.
- Náhrady kůže. Obvykle se připraví kolagenní síť často s adsorbovanými glykosaminoglykany a substrát je osídlen lidskými fibroblasty. Povrch může být potom kolonizován lidskými keratinocyty. (Vzhledem k náročnosti přípravy se používají zejména buňky získané z předkožek novorozenců.) Náhrady tohoto typu jsou z imunologických důvodů dočasné a slouží ke krytí rozsáhlých defektů. Plní řadu funkcí kůže, a proto mohou těžce popáleným zachránit život. Použité buňky produkují růstové faktory a přispívají k hojení.
V naší skupině jsme připravili přenos kultivovaných keratinocytů na rány vzniklé například tepelným poškozením. Pacientovy kožní buňky jsou kultivovány na povrchu speciálního polymerního nosiče, a pak se i s nosičem přenesou na poškozenou plochu. Vlastní nosič je jakýmsi obvazem a podílí se na vytvoření příznivého mikroklimatu. Po obnovení epitelu se nosič z rány snadno odstraní (obrázek). 
Ochrana buněk v kapsli
V šedesátých letech na McGillově univerzitě v Montrealu vznikla koncepce imunitní ochrany prostřednictvím transplantovaných zvířecích buněk. Ty se uzavřou do polopropustného polymerního pouzdra – duté kapsle. Polymerní obal sice umožní definovaný průnik nízce a středně molekulárních látek do kuličky a ven, avšak ochrání tyto buňky před imunitním rozpoznáním a následnou destrukcí příjemcem. Systém by mohl být výhodný pro léčbu řady endokrinních chorob (např. cukrovky), vyvolaných nepřítomností některého hormonu. Teoreticky by zvířecí dárce poskytl buňky Langerhansových ostrůvků, které produkují inzulin. Zvířecí buňky uzavřené do pouzdra by mohly být po aplikaci lidskému příjemci použity pro léčbu diabetiků. Laboratorní experimenty s diabetickými psy prokázaly, že zvířata po dobu několikatýdenního experimentu nebyla závislá na inzulinu. Většina laboratoří používá na kapsle polyalginát z mořských řas. Tento polymer i jeho degradační produkty jsou bezpečné (netoxické), ale životnost pouzder je omezená. Vzhledem k tomu, že buňky uzavřené v kapsli by musely být opakovaně vpravovány do příjemcova organizmu, hrozí jeho postupná imunizace. Virologové použití zvířecích buněk pro tyto účely kritizují, obávají se přenosu zvířecích choroboplodných zárodků na člověka a toho, aby se mikroorganizmy (zejména viry) uvnitř lidského organizmu nestaly lidským patogenem. Místo zvířecích buněk se proto zvažuje použití lidských buněk z potracených zárodků.V Kanadě se nedávno pokusili vpravit (v kapsli) do organizmu mladé lidské svalové buňky s přeneseným genem, jehož produkt v organizmu chyběl. V omezeném klinickém experimentu tento postup testovali u novorozenců s vrozeným defektem enzymu adenosindeaminázy. Na hodnocení je dosud brzy, ale děti, které by byly odsouzeny k smrti v důsledku fatálního selhání imunity, již déle než rok kvalitně žijí! Stejně perspektivní se zdá být tento přístup i při léčbě těžkých neurodegenerativních onemocnění. 1)
Poznámky
OKOLNOSTI OVLIVŇUJÍCÍ ODPOVĚĎ ORGANIZMU NA IMPLANTÁT
- Povrch implantátu, resp. jeho fyzikálně-chemické vlastnosti. Prvními zánětlivými buňkami, které se na jeho povrchu usadí, bývají neutrofilní granulocyty (obrázek). Ty se podílejí zejména na odstraňování drobných částeček tkáně, které pocházejí z buněk poškozených chirurgickým výkonem. Tomuto období říkáme fáze akutního zánětu. V průběhu prvního poimplantačního týdne jsou neutrofilní granulocyty vystřídány makrofágy a zánět přechází do chronické fáze. Pokud jsou makrofágy aktivovány, vylučují řadu biologicky aktivních cytokinů, které chronický zánět posilují. Na povrchu materiálů s nízkou biokompatibilitou makrofágy fúzují do podoby monstrózních, velkých mnohojaderných buněk z cizích těles (obrázek). Kromě toho makrofágy povzbuzují vazivové buňky, které tvoří molekuly mezibuněčné hmoty a kolem implantátu vytvářejí pevný vazivový obal podobný jizvě. Buňky vazivového obalu obklopujícího implantát s nízkou mírou snášenlivosti se po čase mohou stát zhoubnými, což se naštěstí u člověka stává zcela výjimečně.
- Zručnost operatéra. Při výrazném zhmoždění okolních tkání se mění spektrum biologicky aktivních bílkovin v tkáňové tekutině a na povrchu implantátu se více zachycují bílkoviny, podporující vznik nežádoucího chronického zánětu.
Ke stažení
 Článek ve formátu PDF [326,12 kB]
Článek ve formátu PDF [326,12 kB]















