Vzpomínka na Linuse Paulinga
| 5. 1. 1995Nedlouho poThompsonově objevu elektronu (1897) byla patrná snaha vytvořit teorii chemické vazby založenou na elektronech. Nejdál dospěli G. N. Lewis (1916) a I. Langmuir (1919); přesto, že jejich představa kovalentní vazby, spojená sdvojicí elektronů (elektronový pár), je dosud dobře přijatelná, kopravdové fyzikální teorii měly jejich představy daleko. K převratu došlo uprostřed dvacátých let, kdy se skupina 25 až 30letých teoretických fyziků vGöttingenu dopracovala k teorii, jež dosud dokonale popisuje chování částic mikrosvěta, elektronů, atomových jader, jejich složek, jakož i atomů, molekul a pevné fáze. Jakkoli úspěšná byla klasická mechanika Newtonova při popisu pohybu vesmírných těles, a také makroskopických těles, jež nás obklopují, pokusy využít ji k popisu chování elementárních částic hmoty (ve smyslu uvedených částic) beznadějně selhaly.
Je dobře si uvědomit, že na začátku dvacátých let nevěřil v existenci atomů jako stavebních částic molekul mimo mnohé jiné ani nositel Nobelovy ceny za chemii, lipský profesor fyzikální chemie Wilhelm Ostwald. Jen o několik let později, na konci téhož desetiletí, ani ne třicetiletý americký chemik Linus Pauling, budoucí nositel Nobelovy ceny za chemii, nesnil, ale horlivě pracoval na tom, jak vlnovou mechaniku, nedávno v Göttingenu zrozenou, využít pro popis molekuly tak důležité, jako je benzen. Apodařilo se mu to jako téměř všechno, na co sáhl: uskutečňoval své sny s lehkostí.
Netajím se svým pocitem, že by Linus Pauling nebyl o mnoho menším chemikem a přírodovědcem, ani kdyby se tak pozoruhodně nezapletl do zrodu aplikací kvantové mechaniky na chemii. Díky tomu zapletení se však stal jedním z největších chemiků 20. století.
Příští řádky nejsou úvodem do mechaniky částic mikrosvěta, do kvantové mechaniky, nýbrž jsou pouhou vzpomínkou na dílo velmistra chemie L. Paulinga. Abych dokázal charakterizovat jeho přínos, musím začít ze života. Ústřední rovnice kvantové mechaniky, Schrödingerova rovnice, dovoluje výpočet elektronové a celkové energie atomů amolekul. Je znepokojivá tím, že obsahuje dvě neznámé; obě mají zásadní důležitost pro popis vlastností atomů a molekul: je to vlnová funkce (jež popisuje stav částice, tedy atomu či molekuly) a energie. Řešit řádně Schrödingerovu rovnici dokážeme jen u nejjednodušších modelových systémů a u vodíkového atomu. Výpočet je však přímočarý iusložitých systémů, pokud dokážeme pomocí fyzikální zkušenosti acitu navrhnout matematickou formu vlnové funkce pro studovaný systém. Ukazuje se, že to bez velké námahy dokážeme vždy. Existují dvě cesty, jak se ke vhodnému tvaru vlnové funkce dopracovat. Rozumí se, že v naší souvislosti jde o to, jak zkonstruovat vlnové funkce mnohaatomových molekul, které zajímají chemiky a biology. Postup, který se mně pro vytvoření vlnové funkce jeví přirozený, zavedli - jako druhou možnost - na konci dvacátých let Američan Robert S. Mulliken, Angličan John E. Lennard-Jones aNěmec Erich Hückel. (Ohistorii prvé možnosti bude řeč později.) Obratně využívají skutečnosti, že máme jednou provždy k dispozici vlnové funkce pro elektrony vatomech; každá z těchto vlnových funkcí elektronů umístěných na atomech, které vytvářejí studovanou molekulu, závisí na souřadnicích jediného elektronu. Takové vlnové funkci se říká orbital, přesněji atomový orbital (AO). Atomové orbitaly poslouží jako stavební kameny pro vytvoření vyššího typu vlnové funkce, která se rozprostírá přes celý skelet studované molekuly. O takovém orbitalu, molekulovém orbitalu (MO), se říká, že je delokalizován. Z matematického hlediska není těžké skloubit AO v MO: děje se to vytvořením tzv. lineární kombinace AO, aproto nepřekvapuje zkratka - velmi populární v teorii chemické vazby - MO-LCAO (C je od anglického combination). Avšak pozor, dosud nejsme u cíle. Orbital jak atomový, tak molekulový je jednoelektronovou funkcí, tedy funkcí, jejíž hodnota závisí na souřadnicích jedinéhoelektronu. Naším přáním je však teoreticky studovat molekuly, tedy mnohaelektronové útvary. Zkušenost přírodovědci napovídá, aby jednoelektronové molekulové orbitaly skloubil v mnohaelektronovou vlnovou funkci vynásobením potřebného počtu MO. Jinými slovy, aby vytvořil n-elektronovou vlnovou funkci ve formě produktové funkce. Tím máme v zásadě vyhráno. Pouze v zásadě, protože v naší produktové funkci zbývá určit číselné hodnoty konstant, jež v ní vystupují, a teprve potom budeme mít k dispozici vlnovou funkci (ve formě produktové funkce) pro zcela určitou (námi právě studovanou) molekulu. Jak toho dosáhnout? Hodnoty adjustovatelných konstant musíme zvolit tak, aby vypočítaná energie námi studovaného systému byla minimální. Variační počet vede přímočaře k cíli. A tak máme k dispozici vše, co jsme si přáli mít, vlnovou funkci ienergii zkoumanéhoatomu či molekuly. (Úmyslně jsem zamlčel, že navržené skloubení jednoelektronových orbitalů do mnohaelektronové produktové funkce není tím výsledkem, který by nás fyzikálně zcela uspokojil, avšak v kontextu této vzpomínky není účelné komplikovat historku.) Háček je vtom, že toto je náznak metody dnes ohromně rozšířené, nesmírně dobře exploatovatelné metody, která má i v budoucnosti velmi dobré vyhlídky na využití. Není to však metoda Paulingova, jenž pro své studie využil prvého kvantověmechanického studia molekuly vůbec - výpočtu molekuly vodíku, který provedli němečtí fyzici Walter H. Heitler a Fritz London. Ti už r. 1927, tedy rok pozavedení Schrödingerovy rovnice, ukázali, že její řešení pro molekulu vodíku H2 vede k disociační energii, jež je řádově správná. Vlnovou funkci molekuly vodíku vytvořili pozoruhodným, pro chemiky dobře přijatelným způsobem. Přijatelným proto, že jde o vyjadřování blízké tradičnímu v chemii. Konečná celková vlnová funkce molekuly vodíku se skládala ze tří dílčích funkcí, z nichž jedna (1) popisuje případ obou elektronů umístěných vorbitalu společném pro oba atomy a odpovídá kovalentní vazbě, druhá a třetí funkce (2, 3) představují iontové formy molekuly vodíku, odpovídají tedy orbitalu lokalizovanému na jednom zatomů vodíku.
Jde o kombinaci protonu (H+) s hydridovým aniontem (H-). Heitler a London tedy vytvořili celkovou vlnovou funkci molekuly vodíku jako superpozici funkcí pro jednu kovalentní strukturu a pro dvě iontové struktury. Byl to Linus Pauling, který tuto ideu začal tvůrčím způsobem rozvíjet. Uvedené mísení dílčích vlnových funkcí označil jako rezonanci. Je zřejmé, že u větších molekul počet dílčích funkcí uplatňovaných v rezonanci velmi rychle narůstá s velikostí molekuly. Tato idea je v pozadí dvou myšlenkových proudů. Prvý z nich se snaží rozšířit popsané ideje na větší molekuly (viz dále uvedenou ilustraci týkající se molekuly benzenu) a tu se hovoří o kvantověchemické metodě valenční vazby (VB, od valence bond) či valenčních struktur. Z hlediska široké chemické obce měl daleko větší odezvu avýznam druhý proud, který zavedl Pauling a šířil jej po léta spolu s G. W. Whelandem pod označením teorie rezonance. Pomocí řady empirických pravidel přispěla tato kvalitativní teorie k ohromné racionalizaci zobecnění nejen v organické, ale i v anorganické chemii. Sluší se zmínit, že tyto ideje, skloubené svlastními strukturními představami, byly námětem přednášek osmadvacetiletého Otty Wichterleho v kurzech pořádaných na začátku války u fy. Baťa ve Zlíně. Tento proud, teorie rezonance, měl i tragickou odnož: v padesátých letech politbyro v Moskvě označilo teorii rezonance za buržoazní pavědu. Mělo to tragické důsledky: ruské škole kvantové chemie byla zasazena rána, z níž se už nikdy nevzpamatovala, a hlavní představitelé této školy skončili ve vězeni, z něhož se už nikdy nevrátili.
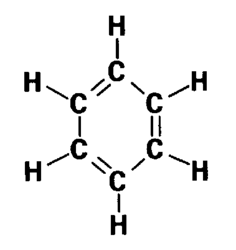
A nyní je třeba se na skok vrátit ke slíbené ilustraci týkající se benzenu, ilustraci opravdu populární. Benzen je planární uhlovodík osloženi C6H6, v jehož formální strukturní formuli se střídají jednoduché advojné vazby CC. Vlnová funkce pro popis p-elektronové části struktury benzenu se v jazyce teorie rezonance vyjadřuje jako hybrid dvou Kekulových (5a, 5b) a tří Dewarových struktur, či lépe, rezonančních mezných forem.
Všimněte si, prosím, že jsem těmto pěti mezním formám připsal jediné číslo a rozlišil jsem je toliko písmeny (viz obr. 2 v rámečku na protější straně). Tím zdůvodňuji, že všech pět struktur popisuje stav jediné reálné částice, tedy molekuly benzenu. To, že se soubor mezních forem podílí na vytvořeni architektury určité molekuly, lze také formálně zdůraznit oddělením mezných forem oboustrannou šipkou,<—>. A tak lze vyjádřit třeba rezonanci uaniontu karboxylové skupiny popisující mezné formy. 
Teprve superpozice mezných forem má partnera v realitě; čím více mezných forem vezmeme vúvahu, tím korektněji popíšeme realitu. Důrazné varování: je zcela falešné interpretovat rezonanci, jako by popisovala oscilaci struktury reálné molekuly. Tudíž symbol ↔ neměl a nemá naprosto nic společného se symbolem <=>, který značí rovnováhu mezi různými, reálně existujícími formami (strukturami) určité molekuly. Příkladů rovnováh je v chemii nespočetně. Tak např. kyanovodík může existovat v mezihvězdném prostoru jak ve formě právě zmíněné, HCN, tak ve formě izomerní, jako izokyanovodík, HNC, tedy: H—C≡N <=> H—N=C
Pro objasnění dodávám, že strukturu izokyanovodíku popisují dobře jeho mezomerní formy (7a, 7b). 
V historii chemie sehrála Paulingova teorie rezonance nevšedně velkou úlohu; dnes její role doznívá. Pokud jde o další vyhlídky s ní spřízněné kvantověchemické metody VB, nejsem optimistou; někteří teoretičtí chemici přispěli v posledních letech krenezanci teorie VB ati mají v její budoucnost větší důvěru. Moje skepse souvisí stím, že přechod k větším a velmi velkým molekulám je u metod MO nesrovnatelně snazší než u metody VB. To však s velikostí Paulinga nikterak nesouvisí.
 Velikost agenialita Paulingova měla mnoho rozměrů. Jeden z nich spatřuji vtom, že se stejnou lehkostí a přirozeností, s jakou začal využívat kvantovou mechaniku, vykládal studentům prvého ročníku chemie, proč poklesne kyselost vodného roztoku kyseliny octové pozvýšení koncentrace octanových iontů. V této souvislosti publikoval r. 1947 originální General Chemistry. Se stejnou naléhavostí studoval a hovořil o jednotlivých molekulách jako o pevné fázi a o krystalech. Otázky reaktivity malých molekul mu byly stejně blízké jako studium reaktivity obřích biomakromolekul v souvislosti s genetikou a chorobami metabolizmu. O fyziku, chemii a biologii se staral stejně vášnivě jako o základní problémy lidské existence a o zachování míru na zeměkouli. To byl Linus Pauling, muž, který se tak intenzivně zúčastňoval života téměř pocelé dvacáté století.
Velikost agenialita Paulingova měla mnoho rozměrů. Jeden z nich spatřuji vtom, že se stejnou lehkostí a přirozeností, s jakou začal využívat kvantovou mechaniku, vykládal studentům prvého ročníku chemie, proč poklesne kyselost vodného roztoku kyseliny octové pozvýšení koncentrace octanových iontů. V této souvislosti publikoval r. 1947 originální General Chemistry. Se stejnou naléhavostí studoval a hovořil o jednotlivých molekulách jako o pevné fázi a o krystalech. Otázky reaktivity malých molekul mu byly stejně blízké jako studium reaktivity obřích biomakromolekul v souvislosti s genetikou a chorobami metabolizmu. O fyziku, chemii a biologii se staral stejně vášnivě jako o základní problémy lidské existence a o zachování míru na zeměkouli. To byl Linus Pauling, muž, který se tak intenzivně zúčastňoval života téměř pocelé dvacáté století.