Funkční analýza genomu
Interference RNA umožňuje zkoumat funkci genů u biologicky, lékařsky nebo ekonomicky významných organizmů, u nichž genetická analýza dosud nebyla schůdná. Stále větší část veřejnosti se dozvídá o projektech sekvencování celých genomů různých bakterií, prvoků, rostlin a živočichů včetně člověka. Nesmírné technické i finanční náročnosti těchto projektů odpovídají velké cíle. Úplná znalost genetické informace nám totiž umožní lépe poznat a pochopit složité a dosud obtížně studovatelné procesy, například embryonální vývoj, fungování mozku či vznik rakoviny. Většině biologů včetně těch, kteří se na sekvencování podílejí, je zároveň jasné, že určení pořadí všech nukleotidů bude pouze výchozím krokem na dlouhé cestě. Již nyní je zřejmé, že využití informací obsažených v úctyhodné genetické knize, která je u člověka tvořena zápisem o třech miliardách „písmen“ (nukleotidů), bude záviset na naší schopnosti dešifrovat mechanizmy, jejichž prostřednictvím se z tohoto zápisu vše odvíjí.
Jedním z klíčových přístupů ke studiu komplexních mechanizmů je metoda knokautů. Na rozdíl od boxerského ringu zde nejde o umlčení protivníka, ale o umlčení jednoho či více genů ve studovaném jedinci. Díky genomovým projektům budeme během několika let znát sekvence všech genů modelových organizmů, ale nebudeme mnoho vědět o funkci jejich produktů, jimiž jsou většinou proteiny. Jestliže určitý cílový gen umlčíme tím, že ho přerušíme nebo jinak poškodíme, získáme tvora, který je normální až na jedinou vlastnost: chybí mu onen jediný protein. Každá, byť jen nepatrná změna ve vlastnostech daného jedince pak bude vodítkem k objasnění funkce, kterou chybějící protein v organizmu zastává. Jak je ale možné v genomu obsahujícím desetitisíce genů a nekódujících oblastí vypnout (popřípadě zapnout) konkrétní gen, aniž by nastala změna v ostatní genetické informaci? 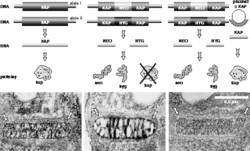
V 80. letech byla u myších buněk objevena schopnost (známá již dříve u prokaryont a kvasinek) včlenit cizorodou DNA na místo původního genu procesem homologní rekombinace. Na rozdíl od náhodné chemické nebo radiační mutageneze, běžně užívané například u octomilky, se tak otevřela možnost jak ze zhruba 50 000 myších genů vyřadit jeden jediný cílový gen, zatímco ostatní genetická výbava zůstane stejná jako u normální myšky. Stačí pak trocha vědeckého štěstí, aby se tato nepatrná změna genotypu projevila ve fenotypu neboli souboru vlastností pozměněného organizmu, a tím umožnila odhalit funkci chybějícího proteinu.
Jak se knokautují geny
Jeden z autorů se zabývá tvorbou knokautů u trypanozom, což jsou bičíkovci vyznačující se širokým spektrem jedinečných vlastností (např. Vesmír 73, 365, 1994/7 a Vesmír 75, 254, 1996/5). Díky mezinárodní spolupráci probíhají projekty sekvencování genomu původce africké spavé nemoci (Trypanosoma brucei) a jihoamerické Chagasovy choroby (T. cruzi) i dalších bičíkovců patogenních pro člověka (leishmanie, viz Vesmír 80, 209, 2001/4). Popišme si stručně přípravu knokautu na příkladu proteinu kap (kódovaného genem KAP), jenž se váže na mitochondriální DNA. Po určení pořadí nukleotidů byl gen KAP z trypanozomy zaklonován do plazmidu a poškozen vložením genu HYG, produkujícího protein hyg, který zajišťuje rezistenci buňky k antibiotiku hygromycinu (obrázek). Tento plazmidový konstrukt se namnoží v bakteriích a jeho vyčištěná DNA je prostřednictvím elektrického šoku vnesena do trypanozom. V naprosté většině buněk, do nichž cizorodá DNA pronikla, se bohužel nic nestane a dle očekávání ji buněčný aparát zničí. Zhruba v jedné buňce ze sto tisíc se však na vnesenou DNA navážou specializované bílkoviny, které jsou schopny provést homologní rekombinaci. V „babylonu“ sekvencí vyhledají hostitelskou obdobu vnesené DNA, srovnají oba úseky vedle sebe, vyštípnou z chromozomu vlastní gen KAP a vloží cizorodou molekulu na jeho místo. Nevšimnou si při tom, že vnesený gen KAP je nefunkční, jelikož byl přerušen genem HYG. Zatímco protein kap je vyřazen z provozu, přepisovaný protein hyg umožňuje trypanozomám přežít v médiu s antibiotikem (hygromycinem), které je pro normální nepozměněné buňky smrtelné.Protože jsou trypanozomy diploidní, je třeba vypnout i druhou alelu genu KAP, a to za pomoci dalšího selekčního markeru (genu NEO). Konečným důsledkem celého procesu je, že buňka bičíkovce ztratí schopnost produkovat protein kap. Na první pohled se absence proteinu kap nijak neprojevovala, avšak bližší analýza prokázala chyby ve sbalení mitochondriální DNA. Definitivním důkazem, že pozorované změny jsou v buňce opravdu způsobeny nepřítomností proteinu kap, je následné vnesení funkční verze genu KAP do knokautovaných buněk. Oprava pozměněného fenotypu zpět do původního stavu přesvědčí i přísnou redakční radu a popsaná funkce může být ke genu KAP pevně přiřazena. 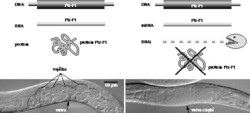
Homologní rekombinace však není univerzálním klíčem k funkční analýze genomů, protože se u většiny organizmů uplatňuje jen nepatrně. U klasických genetických modelů, jakými jsou octomilka Drosophila melanogaster nebo háďátko Caenorhabditis elegans, lze mutagenizovat pouze náhodně chemicky, radiací či prostřednictvím transpozonů, a jedinci s poškozením v daném genu se pak dle možností selektují. S výjimkou kvasinek, kde jsou knokauty rutinní záležitostí, však u těchto modelových organizmů bývá cesta k vyřazení specifického genu pracná, drahá a časově náročná. Na další omezení v použití metody homologní rekombinace narazíme u esenciálních genů, jejichž trvalým vyřazením z genomu způsobíme smrt organizmu dříve, než můžeme z fenotypu usoudit na roli genu v jeho životě. Lidé zabývající se funkční analýzou genomu tudíž usilují o nějaký metodický průlom, který by jejich oboru pomohl vpřed.
Interference RNA
K takovému průlomu došlo před třemi lety a, jak už se stává, docela nečekaným způsobem. K inaktivaci genů v buňkách živočichů i rostlin se již nějaký čas používala metoda známá jako antisense. Podle tehdejších představ byl daný gen umlčován tím, že se komplementární úsek RNA navázal na přirozenou kódující mRNA, takže vznikla dvouvláknová RNA, která nemohla být translatována do formy proteinu. Při práci s háďátkem však Andrew Fire a jeho kolegové zjistili, že injikování antisense RNA do gonád má na fenotyp potomstva často jen nepatrný účinek a že téhož účinku lze dosáhnout také injikováním sense, tedy kódujícího vlákna mRNA. To však bylo neslučitelné s modelem zablokované translace. Další pokusy již ukázaly, že zbraní, která geny účinně zbaví aktivity, je ve skutečnosti dvouvláknová RNA (dsRNA) a že některé předešlé úspěchy s antisense RNA byly způsobeny kontaminací preparátů doplňkovým vláknem. Čím pečlivěji byl totiž antisense řetězec připraven, tím hůře fungoval. Genově specifický účinek dsRNA byl u háďátka ověřen shodou fenotypů u injikovaných jedinců a genetických mutantů, kteří příslušný gen skutečně postrádali. Metoda vešla ve známost jako interference RNA neboli RNAi. O rok později se pomocí RNAi podařilo vyvolat specifické mutantní fenotypy u embryí octomilky a metoda se rozšířila na některé další živočišné i rostlinné modely.O RNAi zatím víme, že působí posttranskripčně a katalyticky, ale na úplné objasnění mechanizmu si budeme muset ještě počkat. Podle současného modelu se v buňce na dvouvláknovou RNA váže enzymatický komplex, který jedno z vláken naštěpí na krátké úseky. Tyto fragmenty jsou pak uvolněny a jejich místo zaujme sekvenčně shodné vlákno přirozené mRNA, které je vzápětí enzymem rovněž degradováno. Proces se může opakovat, dokud není degradována veškerá cílová mRNA, a tím znemožněna syntéza proteinu, tedy i funkce genu. Zdá se, že díky katalytické povaze RNAi stačí k umlčení genu jen několik molekul dsRNA, což činí tuto metodu velmi účinnou. Má ale RNAi také nějaký biologický smysl? Zatím převládá názor, že degradace dsRNA je evolučně prastarý mechanizmus, jímž se buňky brání před transpozony a viry.
Největším přínosem RNAi je možnost umlčet cílový gen pouze na základě znalosti jeho sekvence a rovněž možnost vypínat esenciální geny. Na rozdíl od dědičné ztráty takového genu, která často ukončí život jedince v zárodku a nedovolí nám odhalit význam genu pro jeho další vývoj, působí RNAi postupnou eliminaci cílového proteinu, a tím celou škálu fenotypů od mírných až po smrtelné. Jako příklad z naší laboratoře uvedeme RNAi pro jeden z evolučně nejstarších jaderných receptorů (Ftz-F1) u háďátka. Výskyt příslušné mRNA v embryu a gonádách larev i dospělců ukazoval na potřebu Ftz-F1 během embryonálního i pozdějšího vývoje. Mutanti s delecí genu Ftz-F1 však hynuli již během embryogeneze. RNAi nejen potvrdila tento časně letální fenotyp, ale u pozdních larev a dospělců rovněž odhalila defekty v diferenciaci gonád a vulvy (obrázek).
Ať už je původ RNAi jakýkoli, potenciál této metody pro funkční analýzu genomů nabízí mimořádné možnosti. Je však třeba poznamenat, že ani RNAi nebude metodou zcela univerzální, neboť například u rybky Danio (zebřička) se zdá být neúčinná.
Pro obecnou aplikaci RNAi bude nutné překonat metodické potíže, zejména vnášení dsRNA do buněk. Buňky háďátka přijímají dsRNA dodanou jak injikováním, tak krmením na kmeni bakterií Escherichia coli, které samy syntetizují rekombinantní dsRNA. Této téměř neuvěřitelné schopnosti se využívá k systematickému a rychlému testování funkce již kompletně sekvencovaného genomu háďátka, avšak zatím je to mezi modelovými organizmy výjimka. Nadějným přístupem, loni demonstrovaným u trypanozom a octomilky, je exprese dsRNA z transgenních vektorů in vivo. Tato metoda je sice závislá na naší schopnosti vnést do studovaného organizmu rekombinantní DNA, na druhou stranu však umožňuje řídit expresi dsRNA řadou triků a načasovat tím nástup RNAi do žádaných vývojových stadií. RNAi je oproti metodě homologní rekombinace mnohonásobně rychlejší, levnější, a tudíž veselejší a napínavější. Pokud se osvědčí u dalších genů a organizmů, stane se klíčovou metodou funkční analýzy genomu v postgenomické éře. 1)
Poznámky
Citát
z knihy Oty Gregora: Moje návraty aneb kudy jsem chodil, Galén, Praha 2000, s. 107
Věda je záležitostí levé hemisféry, tedy té, v níž jsou ukryty rozumové schopnosti a činnosti. Ale chcete-li cokoli z vědeckých poznatků sdělit veřejnosti, nemůžete se obejít bez emocí, tedy bez hemisféry pravé. Podle mého názoru je největším úspěchem vědy to, když si vědci správně kladou otázky. Největším problémem komunikace vědy s veřejností pak je správně interpretovat odpovědi. Lidé chtějí odpovědi pokud možno jednoduché a definitivní. Ale takový druh odpovědí věda nezná – každá odpověď hned plodí spoustu nových otázek. Nic není definitivní a ke všemu je zapotřebí notná dávka skepse, jak o tom zpívali už Voskovec a Werich: „Nikdy nic nikdo nemá míti za definitivní, neb nikdy nikdo neví, co se může státi.“ […] Podle mého názoru nejde o pravý dialog. Dialog znamená „dvoustranný provoz“. Ale rozmluva mezi vědeckým pracovníkem a laikem je něčím jiným. Důležitost populárně vědecké literatury spočívá v tom, že se člověk – laik doví, co se odehrává ve vědeckých laboratořích. Dostává tedy informace, a o to jde. Vždyť žijeme v informační společnosti. A právě takový druh informací může být účinnou protiváhou nekritického obdivu k pavědě, může seriózně zaplnit vakuum neinformovanosti. To pak může lidem pomoci...
Ke stažení
 Článek ve formátu PDF [265,45 kB]
Článek ve formátu PDF [265,45 kB]

























