Plod „opravuje“ matčino tělo
V tkáních žen, které daly život synům, byly nalezeny buňky nesoucí chromozom Y, a to v množství desítek až stovek na milion matčiných buněk. Další překvapení nastalo, když se přišlo na to, že tyto buňky produkují proteiny typické pro tkáň, v níž se usídlily.
Fetální buňky osidlují matčiny tkáně
Pozoruhodné výsledky zveřejnila skupina Diany W. Bianchi z Bostonu, která r. 2004 v červencovém čísle časopisu JAMA oznámila nález buněk fetálního původu v různých tkáních žen, které se v minulosti staly matkami synů. Tyto buňky lze snadno nalézt pomocí fluorescenční hybridizace in situ, při níž se na tkáňové řezy aplikují dvě DNA-sondy opatřené fluorescenční značkou (Vesmír 79, 563, 2000/10). Jedna značka pomůže najít chromozom X, druhá (jiné barvy) detekuje chromozom Y. Další imunohistochemická vyšetření za pomoci fluorescenčně označených protilátek podala jasný důkaz, že buňky nesoucí chromozom Y, tedy mužské, tvoří v matčině těle cytokeratiny (proteiny typické pro epitely), pokud se nalézají ve folikulech štítné žlázy, a proteiny typické pro jaterní buňky, pokud se staly součástí jater.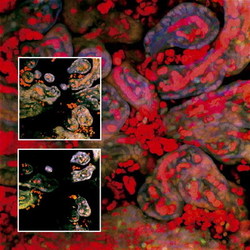 Jiná práce této skupiny prokázala potomky fetálních buněk v matčině těle ještě 27 let po porodu. Ukazuje se, že během těhotenství pronikají do matčina oběhu hemopoetické buňky, charakterizované přítomností proteinu CD34 na povrchu. Ty mají potenciál kmenových buněk – po usídlení v kostní dřeni rodičky mohou dávat vznik různým typům svých buněčných potomků. Významným faktorem přispívajícím k ustavení tohoto chimérizmu jsou podle výzkumné skupiny Diany W. Bianchi jak spontánní potraty, tak interrupce. Dnes se buněčný chimérizmus objevuje nejčastěji v jiné souvislosti – jako následek transplantací kostní dřeně. Buňky dárce kostní dřeně byly například nalezeny u transplantované pacientky, které umožnily kompletní regeneraci děložní sliznice (v tomto případě však nebylo zřejmé, zda došlo k fúzi kmenových buněk kostní dřeně dárce s již diferencovanými buňkami děložní sliznice, nebo ke kompletní přeměně kmenových buněk).
Jiná práce této skupiny prokázala potomky fetálních buněk v matčině těle ještě 27 let po porodu. Ukazuje se, že během těhotenství pronikají do matčina oběhu hemopoetické buňky, charakterizované přítomností proteinu CD34 na povrchu. Ty mají potenciál kmenových buněk – po usídlení v kostní dřeni rodičky mohou dávat vznik různým typům svých buněčných potomků. Významným faktorem přispívajícím k ustavení tohoto chimérizmu jsou podle výzkumné skupiny Diany W. Bianchi jak spontánní potraty, tak interrupce. Dnes se buněčný chimérizmus objevuje nejčastěji v jiné souvislosti – jako následek transplantací kostní dřeně. Buňky dárce kostní dřeně byly například nalezeny u transplantované pacientky, které umožnily kompletní regeneraci děložní sliznice (v tomto případě však nebylo zřejmé, zda došlo k fúzi kmenových buněk kostní dřeně dárce s již diferencovanými buňkami děložní sliznice, nebo ke kompletní přeměně kmenových buněk).
Fetální mikrochimérizmus – výhoda, či nevýhoda?
Všechny tyto objevy vyústily v akceptování jevu nazvaného fetální mikrochimérizmus a fetální buňky v matčiných tkáních jsou označovány jako „zakladatelské buňky související s těhotenstvím“ (pregnancy-associated progenitor cells). Důsledkem je diskuse spojená s plejádou spekulativních vysvětlení tohoto jevu. Na jedné straně stojí úvahy o významu těchto buněk při vzniku autoimunitních chorob mechanizmem reakce štěpu proti hostiteli, na druhé straně je jejich multipotentnost předurčuje k regeneračním rolím v širokém spektru tkání. V této souvislosti se přímo nabízí využít je terapeuticky jako embryonální kmenové buňky. Problémem však zůstává jejich izolace, kultivace, a především plné porozumění jejich fyziologické roli.Co s tím souvisí a co již dlouho známe
Skutečnost, že placentární bariéra není pro buňky plodu za všech okolností neprostupná, je známa dlouho. Obecně nejznámějším projevem je hemolytická anemie novorozenců (erytroblastosis fetalis), vznikající v důsledku odlišnosti matky a plodu v Rh-systému. Rh-negativní matka vytváří protilátky proti Rh-pozitivnímu plodu, přičemž tento proces je nastartován průnikem Rh-pozitivních fetálních erytroblastů do matčiny krve. Protilátky se v mateřském organizmu tvoří, jen když je fyzicky narušena placentární bariéra a do matčina oběhu pronikne více než jeden mililitr plodové krve. V takovém případě, jde-li o první těhotenství, začne žena vytvářet imunoglobuliny typu IgM, které nejsou schopny překonat placentární bariéru, protože jsou velké. To znamená, že nemohou vyvolat novorozeneckou anemii. Menší molekuly imunoglobulinů typu IgG, které placentární bariérou procházejí, se tvoří až v dalších těhotenstvích Rh-negativních matek nesoucích Rh-pozitivní plod. Moderními technikami se prokázalo, že se fetální erytroblasty vyskytují v malém množství v oběhu všech těhotných žen (asi jeden na milion až deset milionů matčiných jaderných buněk), což vedlo k rozvoji metod směřujících k neinvazivní prenatální diagnostice. Odběr choriových klků (v 9. až 10. týdnu těhotenství) či plodové vody (nejčastěji mezi 16. až 18. týdnem těhotenství) představuje pro matku zvýšené riziko potratu (1 : 100), jež je však ve srovnání s rizikem narození postiženého dítěte přijatelné. Kdyby bylo možno získat stejné výsledky analýzou pouhé periferní krve těhotné, riziko by bylo vyloučeno úplně.
Moderními technikami se prokázalo, že se fetální erytroblasty vyskytují v malém množství v oběhu všech těhotných žen (asi jeden na milion až deset milionů matčiných jaderných buněk), což vedlo k rozvoji metod směřujících k neinvazivní prenatální diagnostice. Odběr choriových klků (v 9. až 10. týdnu těhotenství) či plodové vody (nejčastěji mezi 16. až 18. týdnem těhotenství) představuje pro matku zvýšené riziko potratu (1 : 100), jež je však ve srovnání s rizikem narození postiženého dítěte přijatelné. Kdyby bylo možno získat stejné výsledky analýzou pouhé periferní krve těhotné, riziko by bylo vyloučeno úplně.
DNA plodu u matky a diagnostika
S objevem volné fetální DNA v oběhu matek, ke kterému došlo v Honkongu r. 1997, se vynořila nová perspektiva. Fetální DNA tvoří asi 3 % (v rané fázi těhotenství) až 6 % (v pozdní fázi) celkové volné DNA v krevní plazmě těhotné a lze ji poměrně snadno zjistit. Využívá se k tomu upravená metoda polymerázové řetězové reakce, která umožňuje sledovat v reálném čase vzrůstající množství svých produktů. Těmi jsou chytře vybrané úseky DNA, jež se syntetizují podle předloh z analyzovaného vzorku. Časový průběh reakce pak pomůže určit množství těchto předloh (Vesmír 77, 444, 1998/8).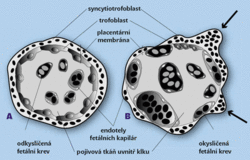 Taková analýza fetální DNA izolované z krve těhotné ženy se nabízí jako nový nástroj prenatální diagnostiky. Robbert J. P. Rijnders a jeho kolegové z Univerzity v Amsterdamu například tímto způsobem určili bezpečně pohlaví plodu již v 5. týdnu těhotenství. Do 10. týdnu těhotenství se jim na základě detekce DNA z chromozomu Y podařilo bezchybně zjistit pohlaví plodů u všech těhotných zahrnutých do studie. Včasné zjištění pohlaví plodu má v současné době neocenitelný význam pro prenatální diagnostiku v rodinách postižených některou z gonozomálně recesivních chorob, kdy jsou stejně jako například u hemofilie A postiženi jen muži. Zmíněná metoda, použitá holandským týmem k zjišťování pohlaví plodů, posloužila také při prenatální diagnostice v rodině s deficiencí 21-hydroxylázy. Jde o autozomálně recesivní chorobu, při níž jsou plody ženského pohlaví ohroženy vytvořením mužských znaků. Absence Y-chromozomálních sekvencí v matčině plazmě signalizuje v tomto případě nutnost zahájit terapii, aby se narodila zdravá holčička.
Taková analýza fetální DNA izolované z krve těhotné ženy se nabízí jako nový nástroj prenatální diagnostiky. Robbert J. P. Rijnders a jeho kolegové z Univerzity v Amsterdamu například tímto způsobem určili bezpečně pohlaví plodu již v 5. týdnu těhotenství. Do 10. týdnu těhotenství se jim na základě detekce DNA z chromozomu Y podařilo bezchybně zjistit pohlaví plodů u všech těhotných zahrnutých do studie. Včasné zjištění pohlaví plodu má v současné době neocenitelný význam pro prenatální diagnostiku v rodinách postižených některou z gonozomálně recesivních chorob, kdy jsou stejně jako například u hemofilie A postiženi jen muži. Zmíněná metoda, použitá holandským týmem k zjišťování pohlaví plodů, posloužila také při prenatální diagnostice v rodině s deficiencí 21-hydroxylázy. Jde o autozomálně recesivní chorobu, při níž jsou plody ženského pohlaví ohroženy vytvořením mužských znaků. Absence Y-chromozomálních sekvencí v matčině plazmě signalizuje v tomto případě nutnost zahájit terapii, aby se narodila zdravá holčička.
Jiné studie se pokusily pomocí koncentrace fetální DNA v mateřské plazmě určovat riziko narození aneuploidního novorozence, předčasného porodu či postižení matky preeklampsií. Zjistilo se, že koncentrace volné fetální DNA je vyšší u matek nesoucích plody postižené odchylkami v počtu chromozomů, z nichž nejznámější je Downův syndrom (s trizomií chromozomu 21). Také u těhotných ohrožených preeklampsií je vyšší hladina volné fetální DNA v plazmě. Preeklampsie se jako choroba spojená s těhotenstvím vyskytuje u 3–5 % těhotných žen. Charakterizuje ji vysoký krevní tlak a přítomnost bílkovin v moči, což vede k narušení normální funkce cévní výstelky, a poté k aktivaci koagulačního procesu a k trombózám. Vzhledem k závažnosti této choroby, která je nejčastější příčinou úmrtí těhotných na Západě, je její prevenci věnována velká pozornost.
Fetální DNA v krvi matky a choriové klky
Současné výsledky přesvědčivě dokazují, že zvýšené množství fetální DNA nepochází v tomto případě z fetálních erytroblastů, které pronikly do matčina oběhu. Sinuhe Hahn se spolupracovníky na Basilejské univerzitě prokázal, že množství fetálních erytroblastů a koncentrace volné fetální DNA v matčině oběhu spolu nesouvisejí. Za zdroj zvýšené koncentrace fetální DNA určil buňky syncytiotrofoblastu, které při placentaci (vytvoření pevného spojení plodové a mateřské části placenty) pronikají do matčina oběhu.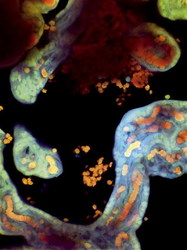 Zaměříme-li svoji pozornost na mikroskopickou stavbu placentární bariéry (obrázek 1, obrázek 2,obrázek 3), uvidíme, že je představována masou syncytio-trofoblastu a stěnou kapiláry v choriovém klku. Syncytiotrofoblast tvoří buňky plodu a na povrchu jednotlivých klků vybíhá v pupenovité výběžky s mnoha jádry. Právě tyto oblasti se mohou zejména během třetího trimestru uvolňovat z povrchu klků a přecházet do matčina oběhu. Činí-li plocha choriových klků omývaných mateřskou krví 14 m2, lze množství materiálu uvolněného denně ze syncytiotrofoblastu do mateřské krve udávat v gramech. Tato DNA je však v plazmě rychle odbourávána. Poločas její životnosti byl stanoven asi na 15 minut. K celkovému zvýšení koncentrace fetální DNA v oběhu těhotné mohou přispět dva děje: intenzivní „obrušování“ syncytiotrofoblastu a nedostatečné odbourávání volné DNA v oběhu. Je zajímavé, že na vzniku preeklampsie se zcela určitě podílejí otcovské geny plodu, neboť bylo prokázáno, že těhotenství s mužem, jehož předchozí partnerka onemocněla v důsledku těhotenství preeklampsií, riziko této choroby zvyšuje dvojnásobně.
Zaměříme-li svoji pozornost na mikroskopickou stavbu placentární bariéry (obrázek 1, obrázek 2,obrázek 3), uvidíme, že je představována masou syncytio-trofoblastu a stěnou kapiláry v choriovém klku. Syncytiotrofoblast tvoří buňky plodu a na povrchu jednotlivých klků vybíhá v pupenovité výběžky s mnoha jádry. Právě tyto oblasti se mohou zejména během třetího trimestru uvolňovat z povrchu klků a přecházet do matčina oběhu. Činí-li plocha choriových klků omývaných mateřskou krví 14 m2, lze množství materiálu uvolněného denně ze syncytiotrofoblastu do mateřské krve udávat v gramech. Tato DNA je však v plazmě rychle odbourávána. Poločas její životnosti byl stanoven asi na 15 minut. K celkovému zvýšení koncentrace fetální DNA v oběhu těhotné mohou přispět dva děje: intenzivní „obrušování“ syncytiotrofoblastu a nedostatečné odbourávání volné DNA v oběhu. Je zajímavé, že na vzniku preeklampsie se zcela určitě podílejí otcovské geny plodu, neboť bylo prokázáno, že těhotenství s mužem, jehož předchozí partnerka onemocněla v důsledku těhotenství preeklampsií, riziko této choroby zvyšuje dvojnásobně.
Apoptóza hraje roli při placentaci i při zrání erytroblastů
Během vývoje preeklampsie k intenzivnějšímu odlupování kousků syncytiotrofoblastu může přispívat také nedostatek kyslíku v tkáních. V důsledku hypoxie převládnou v syncytiotrofoblastu nekrotické procesy nad apoptotickými, které jsou zde fyziologické, a dokonce nutné pro vznik tkáně syncytia. Histologické výzkumy upozornily na důležitost apoptotických drah pro vznik syncytio-trofoblastu, jehož tvorba je iniciována regulačními mechanizmy, shodnými s těmi, které startují apoptózu (Vesmír 83, 468, 2004/8). Narušení těchto procesů v počátcích placentace může být také jedním z mechanizmů zvyšujících koncentraci fetální DNA v matčině oběhu, zejména před 20. týdnem těhotenství, kdy probíhá morfogeneze placenty.Analýza fetálních buněk izolovaných z mateřské krve odhalila rovněž jejich apoptotický charakter. Některé apoptotické dráhy jsou totiž nutné k přeměně erytroblastů na zralé červené krvinky (Vesmír 76, 273, 1997/5).
Embryo versus matka – věčný problém biologie
Poslední poznatky získané pomocí molekulárněgenetických technik nás nutí zamyslet se nad biologickým významem těhotenství pro budoucí zdravotní stav matky a přehodnotit převládající pohled na těhotenství jako na pouhý stav spojený s reprodukcí.Podpořeno grantem GA ČR číslo 203/03/1025.
SLOVNÍČEK
apoptóza – buněčná smrt, opravný mechanizmus, který při embryonálním vývoji odstraňuje nadbytečné buňky. Probíhá i v dospělém organizmu, kde ničí opotřebované, nefunkční nebo cizí (např. nádorové) buňky. Zvýšená indukce apoptózy může mít za následek některé degenerativní choroby (roztroušenou sklerózu, Parkinsonovu chorobu). Apoptóza je geneticky naprogramována. Zástava proteosyntézy ji inaktivuje.blastocysta – modifikovaná blastula vzniklá rýhováním vajíčka savců při jeho průchodu vejcovodem do dělohy. Je tvořena vnitřní buněčnou masou buněk (embryoblastem), z níž vzniká vlastní embryo, a vnější buněčnou vrstvou obsahující dutinu (trofoblastem). Z těchto buněk vznikají po zanoření do děložní sliznice zárodečné obaly, jež embryo vyživují a chrání.
eklampsie – nejtěžší forma těhotenské toxikózy, nejčastěji v posledních měsících těhotenství nebo při porodu. Hlavními příznaky jsou bleskový nástup záchvatu křečí a ztráta vědomí. K prvním příznakům patří zvýšení krevního tlaku, výskyt bílkovin v moči, otoky. Příčiny je třeba hledat ve špatné přizpůsobivosti těhotné na rostoucí změny látkové výměny nebo předchozí poškození orgánů (zvl. ledvinovým či jaterním onemocněním).
embryo – zárodek organizmu, který se vyvíjí z oplozené vaječné buňky; u člověka tak označujeme zárodek do 3. měsíce jeho vývoje (později jde o plod, fetus).
embryonální kmenové buňky – dají se získat z blastocysty embrya nebo z pupečníkové krve. Mohou z nich pravděpodobně vzniknout všechny typy buněk dospělého organizmu.
embryonální zárodečné buňky – získané z primordiálních zárodečných buněk embrya. Jsou pluripotentní, tj. mohou z nich vzniknout všechny buňky dospělého organizmu, lze je využít k léčbě Alzheimerovy či Parkinsonovy choroby, roztroušené sklerózy, poranění míchy, infarktu myokardu.
erytroblast – nezralé stadium červených krvinek (erytrocytů), ještě s jádrem.
erytroblastóza – přítomnost četných nezralých červených krvinek (erytroblastů) v krvi; u novorozenců je způsobeno neslučitelností Rh-faktoru (matka Rh-negativní, otec a dítě Rh-pozitivní); důsledkem je těžká anémie, žloutenka a edém.
gestózy (těhotenské toxikózy) – onemocnění vznikající v těhotenství. Příčinou je porucha látkové výměny organizmu matky, nikoliv jedovatá látka, jak se soudilo dříve. Rozlišují se časné a pozdní gestózy. Časné gestózy se projevují zvracením v průběhu prvního trimestru těhotenství (emesis gravidarum, hyperemesis gravidarum); pozdní gestózy – EPH gestóza, preeklampsie a eklampsie – vznikají v posledním trimestru.
hemopoetické kmenové buňky – diferencované buňky kostní dřeně, z nichž vznikají krvinky.
hybridizace DNA in situ – metoda umožňující vizualizaci specifických sekvencí DNA v metafázních chromozomech nebo v interfázních jádrech přímo na podložních sklíčkách pomocí hybridizačních sond označených radioizotopem či jiným způsobem, např. fluorochromem (fluorescenční hybridizace DNA in situ, FISH).
chorion – zevní zárodečná blána, plodový obal plazů, ptáků a savců. Kyslík a živiny přijímá z děložní stěny matky. S alantoidem vytvářejí základ placenty. Jde o zevní zárodečný obal, který vzniká ze stěny blastocysty. Zevní povrch chorionu pokrývají klky, které slouží k ukotvení v děložní sliznici. Také u člověka se chorion významně podílí na tvorbě placenty.
IgM (makroglobuliny) – imunoglobuliny třídy M. Objevují se v prvních dnech protilátkové imunitní odpovědi, později je nahradí IgG. Na rozdíl od IgG neprocházejí placentou, a mohou tudíž u novorozence signalizovat prenatální nebo perinatální nákazu.
imunofluorescenční metoda – způsob průkazu antigenu pomocí protilátky značené chemicky navázaným fluorescenčním barvivem. Pokud je ve vzorku hledaný antigen, protilátka se na něj naváže. V místech, kde se protilátka navázala, a kde je tudíž přítomen prokazovaný antigen), vidíme na temném pozadí svítící místa (fluorescenci).
kmenové buňky – mohou se dělit a vytvářet nové kmenové buňky nebo vyzrávat do různých buněčných typů. Dělí se na embryonální, adultní a embryonální zárodečné.
nekróza – smrt buňky, která nastává při nevratném přerušení toku látek a energie mezi buňkou a okolím nebo při vystavení letálním faktorům, které nejčastěji zasahují biomembrány či způsobí zástavu syntézy kyseliny adenozintrifosforečné.
placenta – lůžko, orgán, ve kterém se stýká chorion a alantois zárodku se stěnou matčiny dělohy. Kontakt matčina těla s plodem je tak zcela redukovaný a choriové klky plodu se doslova „koupou“ v matčině krvi. Po porodu plodu se lůžko z dělohy odlučuje a je vypuzeno.
plod (lat. fetus) – používá se pro jedince od 4. měsíce těhotenství (předtím embryo, zárodek), onemocnění a poruchy vývoje v této době se označují jako fetopatie.
polymerázová řetězová reakce (Polymerase Chain Reaction, PCR) – molekulárněgenetická metoda umožňující namnožit in vitro určité oblasti DNA (Vesmír 77, 444, 1998/8).
preeklampsie – nižší stupeň eklampsie, otoky, bolesti hlavy, bílkovina v moči.
rhesus faktor (Rh-faktor) – jedna z charakteristik krevních buněk (krevní skupiny), které byly poprvé popsány K. Landsteinerem a A. S. Wienerem (USA) r. 1940 u makaka réza (Macaca mulatta), a pak byly také nalezeny u člověka; přibližně 85 % Evropanů je Rh-pozitivních (Rh+), tzn. jejich krev obsahuje Rh-faktor, zbytek je Rh-negativní (Rh–). Děti ze spojení Rh+ muže s Rh– ženou se obtížně vyvíjejí a mohou být těžce poškozeny, jestliže organizmus matky během těhotenství vytváří protilátky proti Rh+ otce (v dětské krvi). Může dojít ke zničení červených krvinek (erytrocytů) dítěte, které se pak narodí mrtvé nebo těžce poškozené (erytroblastóza). Protilátky proti Rh+ v krvi v matčině organizmu přetrvávají, proto se nebezpečí od dítěte k dítěti zvyšuje, a tak se dnes do krve Rh-negativních matek vstřikuje speciální gammaglobulin anti-D, který tvorbě těchto protilátek brání. Aby se předešlo těžkým poškozením, provádí se někdy po narození kompletní výměna krve. U poškozeného dítěte musí být rychlá výměna krve s Rh– za Rh+ zavedena ještě do pupečníku.
Ke stažení
 článek ve formátu pdf [834,28 kB]
článek ve formátu pdf [834,28 kB]

























