O šíření signálů v živých organizmech
Víme již, že jednou ze základních podmínek pro vznik a šíření signálu formou akčního potenciálu je, aby membrána příslušné nervové struktury (neuronu, nervového vlákna aj.) byla vybavena určitým typem napěťově závislých iontových kanálů.
K čemu slouží napěťově závislé kanály v buňkách elektricky „němých“
Dokud elektrofyziologové tento elektrobiologický nástroj objevovali pravidelně ve všech druzích neuronů či nervových vláken, zdálo se být vše v pořádku. Zlom nastal v okamžiku, kdy někteří troufalí elektrofyziologové – nejprve z Univerzity v Yale, ale pak i z mnoha dalších pracovišť – počali tvrdit, že je objevili v membránách, o nichž se předpokládalo, že jsou absolutně neschopné jakéhokoliv elektrického projevu. Zvlášť překvapivé bylo, když se začaly objevovat zprávy o existenci těchto kanálů v buňkách gliových, o kterých se odjakživa tvrdilo, že jsou jen jakousi podpůrnou strukturou buňkám nervovým. Tyto kanály byly nejen napěťově závislé, ale i ostatní jejich vlastnosti se podezřele podobaly vlastnostem, které umožňují vznik akčního potenciálu v buňkách schopných reagovat na podráždění 1) . Znamená to, že i gliové buňky, dlouho pokládané za buňky elektricky „němé“, jsou přece jen schopny podráždění?První, kdo se odvážil položit tuto otázku zcela veřejně, byla anglická neurobioložka Joan Abbottová, která r. 1985 publikovala článek s provokativním názvem „Nejsou gliové buňky přece jen schopny podráždění?“ 2) Článek končí slovy: Možná, že gliové buňky se zdají být zticha jen proto, že nejsme dosud dostatečně chytří, abychom jejich rozhovor slyšeli. Od té doby uběhlo deset let a to je dlouho na to, abychom se mohli pokusit její předpovědi prověřit.
Odkud nejlépe začít? V první řadě je třeba říci, že existence napěťově závislých iontových kanálů schopných generovat akční potenciál byla od té doby mnohokrát potvrzena snad ve všech typech gliových buňek, tedy v buňkách, ve kterých tyto kanály zdánlivě „nemají co dělat“. Jejich elektrofyziologické parametry byly charakterizovány v gliových buňkách centrálního i periferního nervového systému. K čemu tam ale kanály vlastně jsou, o to se stále ještě vedou spory. Jsou totiž dvě možnosti: Buď tyto kanály v gliových buňkách plní jinou funkci, než je generování akčních potenciálů, nebo elektrické signály v gliových buňkách skutečně vznikají, ale my je nejsme schopni zaregistrovat. Pro druhou hypotézu mluví například fakt, že rozmístění napěťově závislých kanálů na buněčné membráně gliových buňek bývá silně nehomogenní. Na některých místech jich je možno nalézt hustý shluk, o kousek dál podstatně méně, popřípadě mohou zcela chybět. Je tedy docela dobře možné, že tyto buňky generují jakýsi lokální akční potenciál, ten se ale nemůže šířit, takže je téměř nemožné ho změřit.
O jedné z možných funkcí napěťově závislých iontových kanálů v gliových buňkách
Zkusme si nyní představit, co se děje kolem neuronu nebo nervového vlákna v okamžiku, kdy se právě přenáší nějaký signál, tedy v době, kdy těmito nervovými buňkami probíhají akční potenciály. Jak už víme, tyto vzruchy jsou generovány kratičkým otevřením sodíkových a hned po nich draslíkových kanálů, kterými vstupuje sodík do buňky a draslík vystupuje z buňky ven. Zvýší-li se nervová aktivita a tím i frekvence akčních potenciálů, začnou mít nervové buňky problémy s hromaděním draslíku v extracelulárním prostředí. A tady se ukázalo, jakými cennými spolupracovníky jsou právě gliové buňky, které jsou v těchto těžkých situacích schopny odčerpávat přebytečný draslík a plnit tak funkci dočasného draslíkového rezervoáru, čímž přispívají k udržení koncentrace draslíku kolem neuronů a nervových vláken na jakž takž přijatelných nízkých hodnotách.Mechanizmů zúčastňujících se draslíkové homeostázy je více, ale jedním z nich je aktivní pumpováni draslíku z extracelulárního prostředí do gliových buňek sodíko-draslíkovou pumpou. Jak se však gliová pumpa dozví, že venku je přebytek draslíku, který je potřeba co nejrychleji odčerpat? V podstatě rychle a jednoduše, protože jedno její čidlo je umístěno na vnější straně buněčné membrány. Je to vlastně jakýsi „plynový pedál“, který je právě na přítomnost draslíku citlivý. V tomto případě je to tedy spíše jakýsi „draslíkový pedál“: čím víc draslíku, tím vyššího výkonu pumpa dosáhne. Jenže ani při vysoké draslíkové koncentraci nedosáhne svého maximálního výkonu. K tomu, aby se její „motor“ roztočil „na plný plyn“, je potřeba přišlápnout ještě „sodíkový pedál“, který je však umístěn uvnitř buňky. A nyní se konečně dostáváme k roli napěťově závislého draslíkového kanálu. Klidový membránový potenciál je u gliových buňek téměř výlučně závislý na elektrochemickém gradientu draslíku. Nebudeme zde rozvíjet dlouhé teorie. Řekněme stručně, že i malá změna koncentrace draslíku ve vnějším prostředí způsobí relativně velkou změnu membránového potenciálu. Pozorný čtenář již jistě pochopil, takže si teď můžeme celý sled událostí zopakovat i s tím nedopovězeným koncem.
 Představme si, že nějaký vnější podnět „vzrušil“ určitou oblast neuronů ve vašem centrálním nervovém systému. Neurony generují akční potenciály o sto šest a v celé oblasti se akumuluje draslík vně buněk. V první fázi začíná gliovou pumpu aktivovat „draslíkový pedál“ a chvíli se mu daří oddálit kritický stav. Aktivita neuronů však neustává, draslík dále stoupá. Vlivem této vysoké draslíkové koncentrace se začíná snižovat membránový potenciál gliových buněk, otevírají se napěťově závislé sodíkové kanály, sodík vstupuje do buňky, „sešlapuje sodíkový pedál“, pumpa se konečně roztočí naplno a nebezpečí je zažehnáno. Tuto hypotézu nedávno navrhl Harald Sontheimer 3) na základě poměrně přesvědčivých experimentálních výsledků. Některé čtenáře možná zajímá, co by se mohlo stát, kdyby se tento regulační mechanizmus porouchal. Z mnoha možných důsledků je možno uvést například migrénu nebo vznik epileptického záchvatu (jsou to ovšem zatím jen málo prokázané hypotézy). Kdo někdy trpěl třeba jen obyčejnou migrénou, bude jistě souhlasit s názorem, že je lepší, funguje-li systém draslíkové regulace bez závad.
Představme si, že nějaký vnější podnět „vzrušil“ určitou oblast neuronů ve vašem centrálním nervovém systému. Neurony generují akční potenciály o sto šest a v celé oblasti se akumuluje draslík vně buněk. V první fázi začíná gliovou pumpu aktivovat „draslíkový pedál“ a chvíli se mu daří oddálit kritický stav. Aktivita neuronů však neustává, draslík dále stoupá. Vlivem této vysoké draslíkové koncentrace se začíná snižovat membránový potenciál gliových buněk, otevírají se napěťově závislé sodíkové kanály, sodík vstupuje do buňky, „sešlapuje sodíkový pedál“, pumpa se konečně roztočí naplno a nebezpečí je zažehnáno. Tuto hypotézu nedávno navrhl Harald Sontheimer 3) na základě poměrně přesvědčivých experimentálních výsledků. Některé čtenáře možná zajímá, co by se mohlo stát, kdyby se tento regulační mechanizmus porouchal. Z mnoha možných důsledků je možno uvést například migrénu nebo vznik epileptického záchvatu (jsou to ovšem zatím jen málo prokázané hypotézy). Kdo někdy trpěl třeba jen obyčejnou migrénou, bude jistě souhlasit s názorem, že je lepší, funguje-li systém draslíkové regulace bez závad.
Toto je jedna z možných funkcí napěťově závislých iontových kanálů v gliových buňkách. Odpověď na všechny otázky týkající se jejich existence v membránách buněk, které je zdánlivě nepotřebují, zatím nemáme. S jistotou však můžeme říci, že tam nejsou jen tak náhodou. Veliký architekt je tam umístil proto, že je tam z nějakého rozumného důvodu potřeboval mít.
Také neurotransmitery a receptory jsou v místech, kde bychom je nečekali
Záhadám a mysteriím ve vědě nikdy není konec – a to je jistě dobře, protože bádání a výzkumu se věnují lidé zvídaví, a čím větší hlavolam, tím více je přitahuje. Ta další hádanka, o které dnes chceme mluvit, se týká nervového zakončení, kde způsobí akční potenciál vyplavení neurotransmiteru do synaptické štěrbiny. Zatím ani není jasno (viz část 3.), zda se neurotransmiter vyplavuje přímo, nebo zda se vylévá do synaptické štěrbiny ze synaptických váčků neboli vezikul. Víme však, že na druhém břehu synaptické štěrbiny, tvořené membránou jiné buňky schopné reagovat podrážděním, jsou umístěny receptory, které netrpělivě čekají na „svůj“ neurotransmiter. Jakmile dojde k setkání a spojení neurotransmiteru s receptorem, spustí se celá kaskáda fyzikálně-chemických pochodů, ze kterých se zrodí odpověď na signál z „druhého břehu“.Dalo by se tedy předpokládat, že neurotransmitery budou vylučovány pouze v určitých místech, například v nervových zakončeních, a že pouze tam budeme nacházet odpovídající receptory. Dlouho tomu tak bylo, ale to asi jen proto, že nikoho nenapadlo hledat je jinde. Neurotransmitery i receptory nám však připravují podobná překvapení jako napěťově závislé iontové kanály. Objevují se totiž tam, kde by je nikdo nečekal. Nejprve bylo zjištěno, že během elektrické aktivity nervů se řada neurotransmiterů vylučuje nejen v nervovém zakončení, ale i podél celého nervového vlákna. Zpočátku byly tyto výsledky interpretovány jako přírodní omyl. Příroda má přece právo se splést a provést někdy někde něco docela zbytečného. Zbytečného, protože k čemu neurotransmiter, když se v okolí nevyskytuje jediný jeho receptor? Pak se ale pomalu začalo ukazovat, že se nemýlila příroda, nýbrž člověk. Receptory se totiž začaly nacházet na všemožných buňkách, mezi jinými i na buňkách gliových. A ne jeden tu a tam, ale všechny možné druhy, a v houfech! To však není všechno. Ukázalo se, že v gliových buňkách je řada neurotransmiterů a že i gliové buňky – stejně jako neurony a nervová vlákna – jsou schopny tyto neurotransmitery v určitých situacích vylučovat. Stručné shrnutí: nervové i gliové buňky obsahují neurotransmitery i příslušné receptory. Nervové i gliové buňky za určitých okolností neurotransmitery vylučují. Gliové buňky se nacházejí v nejintimnější blízkosti buněk nervových. I člověk s mizernou představivostí musí na základě těchto informací dojít k jednoduchému, ale jednoznačnému a logickému závěru: nervový systém si gliovými buňkami předává informace.
Gliové buňky odpovídají na signály vysílané nervovými buňkami
Nyní zbývá jen rozluštit obsah vysílaných signálů a zjistit, o čem si to vlastně potřebují tak nutně povídat. Hypotéz už bylo formulováno hodně, ale jen některé byly experimentálně potvrzeny. Jedna z těch lépe ověřených se týká regulace koncentrací různých látek v extracelulárním prostředí, např. draslíku, o které jsme již mluvili, ale i řady důležitých neuroaktivních látek. Jiným příkladem může být objemová regulace buněk i jejich extracelulárního prostředí a to vše zejména v podmínkách zvýšené nervové aktivity. Není bez zajímavosti, že jedním z pracovišť, kde bylo v tomto oboru dosaženo nejpozoruhodnějších výsledků, je Laboratoř buněčné neurofyziologie AV ČR, vedená Dr. Evou Sykovou (po Joan Abbottové je to již druhá významná žena v oboru; zdá se, že tento obor vděčí za svůj rozvoj více ženám než mužům).Mechanizmy, které jsou ve hře, vyžadují dokonalou souhru mezi všemi partnery, kteří v tomto složitém homeostatickém mechanizmu hrají hlavní role. A těmi hlavními partnery jsou právě nervové a gliové buňky. Není proto divu, že si mezi sebou vybudovaly promyšlený signální systém. Příklad dobře dokumentované a experimentálně podložené neuro-gliové signalizace, využívající známého neurotransmiteru glutamátu jako přenašeče signálu mezi nervovými buňkami a astrocyty (astrocyt je gliová buňka obklopující neurony v centrálním nervovém systému), popsala r. 1990 Ann Cornellová-Bellová, (další významná žena) se svými spolupracovníky 4) . Jejich výsledky vedly k rozpoznání zcela nového typu mezibuněčné signalizace, a to vápníkových vln šířících se jakýmisi téměř magickými pochody z buňky do buňky, ale o tom později.
Vraťme se nyní k nakousnutému tématu, týkajícímu se glutamátu a astrocytů. O tom, že v některých typech nervových zakončení hraje roli neurotransmiteru glutamát, se vědělo již dávno, a to, že nervová zakončení jsou obklopena astrocyty, také. A když se pak zjistilo, že na povrchu astrocytů jsou v hojném množství glutamátové receptory, byl celkem logický předpoklad, že glutamát vyloučený z nervového zakončení by nemusel být určen jen postsynaptické membráně, ale třeba také astrocytům. Tato hypotéza se zdá být celkem snadno testovatelná. Stačí si opatřit pár astrocytů, nechat na ně působit glutamát a pozorovat, zda se něco bude dít.
To se snadno řekne, ale hůř provádí, zvlášť když jde o buňky, které měří několik tisícin milimetru, a navíc ani nevíme, jakou odpověď od nich máme vlastně očekávat. Cornellová-Bellová usoudila, že glutamát by mohl ovlivňovat hladinu intracelulárního vápníku. Problém však byl v tom, že volného vápníku uvnitř buněk je neuvěřitelně málo, takže sledování jeho koncentračních změn bylo dlouho pokládáno za prakticky neproveditelné. Věda však v posledních letech natolik pokročila, že dnes už intracelulární vápník měřit umíme, a to dokonce s překvapivou přesností. Používá se k tomu různých látek, které mění své optické vlastnosti v závislosti na množství vápníku, s nímž je tato látka ve styku. 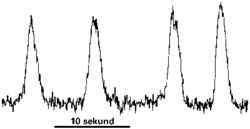 Pochopitelně, že napřed je třeba tuto látku nějak dopravit do buňky a donutit ji, aby tam zůstala, že měření probíhá pod speciálním mikroskopem, že experimentální měřicí a optické vybavení je neobyčejně složité a nákladné a že k interpretaci optických záznamů a k vyhodnocování výsledků je potřeba prvotřídní počítačové vybavení. Nic z toho neodradilo Cornellovou-Bellovou, která tuto metodu použila, a brzy se ukázalo, že její předpoklad byl správný. Téměř okamžitě po aplikaci glutamátu se koncentrace vápníku uvnitř astrocytu několikanásobně zvýšila. Ale to nebylo všechno. Po několika vteřinách se vápník z buňky jakoby vytratil a jeho koncentrace se vrátila zpět ke klidové hladině. A pak opět vyletěla téměř na pětinásobek, a opět klesla, opět se zvýšila, a tyto vápníkové oscilace pokračovaly, dokud byly astrocyty v kontaktu s glutamátem. To bylo první překvapení. To druhé spočívalo v tom, že vápníkové oscilace byly schopny se šířit z jedné buňky do druhé. Rychlost šíření byla kolem jednoho milimetru za minutu, což znamená, že přibližně každou vteřinu byla vápníkovou vlnou „zasažena“ nová buňka. Výsledky těchto pokusů mají ve skutečnosti větší důležitost, než by se mohlo zdát na první pohled. Vápníkové oscilace a jejich šíření od buňky k buňce jsou jednak zajímavým biofyzikálním úkazem, ale hlavně jsou signálem a nositelem informace. Jaké, jakým způsobem kódované a jakého obsahu, v tom zatím není zcela jasno, i když existuje řada více či méně věrohodných hypotéz. Poněkud ucelenější představa již existuje o mechanizmech vzniku vápníkových oscilací i o šíření vápníkové vlny. Ale o tom zase příště.
Pochopitelně, že napřed je třeba tuto látku nějak dopravit do buňky a donutit ji, aby tam zůstala, že měření probíhá pod speciálním mikroskopem, že experimentální měřicí a optické vybavení je neobyčejně složité a nákladné a že k interpretaci optických záznamů a k vyhodnocování výsledků je potřeba prvotřídní počítačové vybavení. Nic z toho neodradilo Cornellovou-Bellovou, která tuto metodu použila, a brzy se ukázalo, že její předpoklad byl správný. Téměř okamžitě po aplikaci glutamátu se koncentrace vápníku uvnitř astrocytu několikanásobně zvýšila. Ale to nebylo všechno. Po několika vteřinách se vápník z buňky jakoby vytratil a jeho koncentrace se vrátila zpět ke klidové hladině. A pak opět vyletěla téměř na pětinásobek, a opět klesla, opět se zvýšila, a tyto vápníkové oscilace pokračovaly, dokud byly astrocyty v kontaktu s glutamátem. To bylo první překvapení. To druhé spočívalo v tom, že vápníkové oscilace byly schopny se šířit z jedné buňky do druhé. Rychlost šíření byla kolem jednoho milimetru za minutu, což znamená, že přibližně každou vteřinu byla vápníkovou vlnou „zasažena“ nová buňka. Výsledky těchto pokusů mají ve skutečnosti větší důležitost, než by se mohlo zdát na první pohled. Vápníkové oscilace a jejich šíření od buňky k buňce jsou jednak zajímavým biofyzikálním úkazem, ale hlavně jsou signálem a nositelem informace. Jaké, jakým způsobem kódované a jakého obsahu, v tom zatím není zcela jasno, i když existuje řada více či méně věrohodných hypotéz. Poněkud ucelenější představa již existuje o mechanizmech vzniku vápníkových oscilací i o šíření vápníkové vlny. Ale o tom zase příště.

























