Úspěšnost léčby nádorových onemocnění cytostatiky
| 5. 4. 1994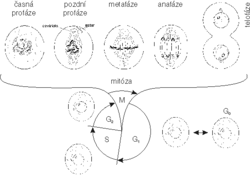 Nádorová onemocnění představují závažný celospolečenský problém. Účinná prevence jejich vzniku je značně nedokonalá a včasná diagnostika je stále spíše výjimkou. Tím většího významu nabývá léčba zhoubných nádorů. Ačkoliv dnes již dovedeme některá nádorová onemocnění vyléčit, nelze v širším měřítku považovat výsledky léčby za zcela uspokojivé. Je to způsobeno především povahou nádorového onemocnění. Jeho rozmanité formy jsou dány nejen předpokládaně rozdílnými etiologickými faktory, ale i značně různorodou patogenezí. Je tedy logické, že léčba tohoto typu onemocnění bude obtížná, tím spíše, že bez znalosti etiologie nemůže v současné době existovat léčba kauzální. Léčebné možnosti se dnes omezují hlavně na tři léčebné metody: Chirurgickou léčbu, léčbu zářením a medikamentózní léčbu cytostatiky neboli chemoterapii. Ve většině případů nestačí k úspěšnému léčení nebo vyléčení pouze jediná z uvedených metod. Větší naději na úspěch má zpravidla komplexní přístup vyjádřený jejich vzájemnou kombinací, neboť tyto základní metody protinádorové léčby se vhodně doplňují. Protinádorová chemoterapie, které chceme věnovat pozornost v tomto sdělení, je metodou nejmladší, neboť se v širším měřítku začala uplatňovat teprve v průběhu šedesátých let. V následujících desetiletích prodělala bouřlivý rozvoj a z původně doplňkové metody nabyla významu metody základní. Stala se ve své indikační oblasti rovnocennou chirurgické léčbě a radioterapii. Počáteční úspěchy chemoterapie vyvolaly vlnu nadšení, která byla postupně vystřídána skepsí plynoucí z poznání, že terapeutický účinek cytostatiky má své dosti úzce vymezené hranice. Nicméně v těchto mezích je i v dnešní době chemoterapie nenahraditelnou léčebnou metodou a u některých typů nádorových onemocnění si udržuje prioritní postavení. Pokusíme se shrnout, jakými mechanizmy omezuje chemoterapie nádorové bujení, jaká taktika jejího podání umožní optimální léčebný výsledek, jaký je její přínos v komplexní léčbě nádorů a zda existují předpoklady pro další posílení jejího významu.
Nádorová onemocnění představují závažný celospolečenský problém. Účinná prevence jejich vzniku je značně nedokonalá a včasná diagnostika je stále spíše výjimkou. Tím většího významu nabývá léčba zhoubných nádorů. Ačkoliv dnes již dovedeme některá nádorová onemocnění vyléčit, nelze v širším měřítku považovat výsledky léčby za zcela uspokojivé. Je to způsobeno především povahou nádorového onemocnění. Jeho rozmanité formy jsou dány nejen předpokládaně rozdílnými etiologickými faktory, ale i značně různorodou patogenezí. Je tedy logické, že léčba tohoto typu onemocnění bude obtížná, tím spíše, že bez znalosti etiologie nemůže v současné době existovat léčba kauzální. Léčebné možnosti se dnes omezují hlavně na tři léčebné metody: Chirurgickou léčbu, léčbu zářením a medikamentózní léčbu cytostatiky neboli chemoterapii. Ve většině případů nestačí k úspěšnému léčení nebo vyléčení pouze jediná z uvedených metod. Větší naději na úspěch má zpravidla komplexní přístup vyjádřený jejich vzájemnou kombinací, neboť tyto základní metody protinádorové léčby se vhodně doplňují. Protinádorová chemoterapie, které chceme věnovat pozornost v tomto sdělení, je metodou nejmladší, neboť se v širším měřítku začala uplatňovat teprve v průběhu šedesátých let. V následujících desetiletích prodělala bouřlivý rozvoj a z původně doplňkové metody nabyla významu metody základní. Stala se ve své indikační oblasti rovnocennou chirurgické léčbě a radioterapii. Počáteční úspěchy chemoterapie vyvolaly vlnu nadšení, která byla postupně vystřídána skepsí plynoucí z poznání, že terapeutický účinek cytostatiky má své dosti úzce vymezené hranice. Nicméně v těchto mezích je i v dnešní době chemoterapie nenahraditelnou léčebnou metodou a u některých typů nádorových onemocnění si udržuje prioritní postavení. Pokusíme se shrnout, jakými mechanizmy omezuje chemoterapie nádorové bujení, jaká taktika jejího podání umožní optimální léčebný výsledek, jaký je její přínos v komplexní léčbě nádorů a zda existují předpoklady pro další posílení jejího významu.
Mechanizmus protinádorového účinku cytostatik
Cílem cytostatické léčby je omezení nádorového růstu, jinými slovy omezení buněčné proliferace (bujení) nádoru. Buněčné dělení představuje soubor metabolických pochodů buňky, které jsou předpokladem pro rozdělení buňky mateřské na dvě buňky dceřiné. Uskutečňuje se v tzv. buněčných cyklech (obrázek). Buňka v dlouhodobě utlumené fázi G1 se nazývá buňka klidová (fáze G0) a taková buňka není zpravidla citlivá k účinku cytostatik, která naopak účinně inhibují (zastavují) ostatní fáze buněčného cyklu. Jejich cytotoxický účinek závisí na chemické povaze cytostatika a lze jej vyložit několika základními mechanizmy: Jsou to- porucha syntézy nukleových kyselin inhibicí různých klíčových enzymů metabolizmu,
- přímé poškození struktury již hotových nukleových kyselin,
- alterace (poškození) tzv. mikrotubulárního proteinu, jež má za následek abnormální průběh mitózy a její blokádu v metafázi.
- porucha syntézy proteinů (na ni je cytotoxický účinek vázán méně často).
Schematicky znázorňuje hlavní mechanizmy účinku obrázku.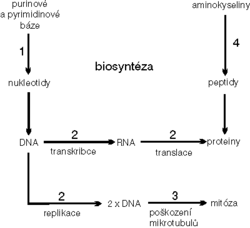
- ad 1) Látky inhibující biosyntézu nukleových kyselin se strukturálně podobají přirozeným metabolitům a označují se proto jako analoga nebo antimetabolity. Mohou blokovat dílčí reakce intermediálního metabolizmu nebo jsou nejprve samy metabolicky proměněny, aktivovány, zpravidla přeměnou na nukleotid, a v této formě včleněny do nukleových kyselin. Toto včlenění chybného metabolitu vede k syntéze falešné DNA, jejíž funkce (především replikace) jsou pak porušené. Podle substrátů, na jejichž úrovni antimetabolity působí, se rozeznává několik skupin. Jsou to analoga kyseliny listové (metotrexát), analoga purinů (merkaptopurin), analoga adeninu (2-deoxykoformycin) a analoga pyrimidinů (5-fluorouracil).
ad 2) Látky poškozující strukturu a funkci nukleových kyselin působí různými mechanizmy. Je to zejména tzv. alkylace, při níž se cytostatikum váže pevnou kovalentní vazbou na řetězce DNA a znemožní tak její replikaci. Tímto mechanizmem působí dusíkatý yperit a jeho četné deriváty (cyklofosfamid). Jinou možností je interkalace. Je to nekovalentní vazba cytostatika na DNA, při níž se molekula cytostatika zasune mezi dvojspirálu DNA, kde se váže vodíkovými můstky. Důsledek pro funkci DNA je stejný jako u alkylace. Tímto mechanizmem působí zejména antracykliny (doxorubicin). Třetí možností je přímé rozštěpení molekuly DNA cytostatikem. Pro podobnost s mechanizmem účinku ionizujícího záření se označuje tento mechanizmus jako radiomimetický účinek. Je charakteristický pro některá polypeptidová antibiotika (bleomycin).
ad 3) Látky poškozující dělicí vřeténko blokují dělení buňky v mitóze. Dělicí vřeténko zajišťuje při mitóze správnou migraci chromozomů k pólům dělící se buňky a jeho poškození denaturací nebo stabilizací mikrotubulárního proteinu zablokuje mitózu v metafázi. Blokádu mitózy působí zejména alkaloidy (vinblastin, vincristin).
ad 3) Látky inhibující proteosyntézu jsou většinou značně toxické a používají se v praxi omezeně. Osvědčila se hlavně L-asparagináza, enzym, který působí depleci aminokyseliny L-asparaginu jeho přeměnou na kyselinu asparagovou a amoniak. Nedostatek této aminokyseliny se pak projeví poruchou proteosyntézy v buňce.
ad 4) Větší počet cytostatik působí kombinací uvedených mechanizmů. Nejčastěji je to účinek alkylační a antimetabolický. U některých látek není dosud podstata cytotoxického působení objasněna.
Je zřejmé, že arzenál antiproliferačních (působících proti bujení) prostředků je značně bohatý a mohlo by proto být překvapující, proč se v klinické praxi nedaří těmito léky nádorové buňky zničit. To má však nejméně dva důvody. Jednak připomeňme, že cytostatika působí pouze na buňky proliferující, tj. buňky nacházející se v buněčném cyklu (nikoliv na buňky klidové). V rostoucím nádoru a ve značné míře v nádoru pokročilém přibývá buněk ve fázi G0, necitlivých k chemoterapii. Ještě pádnějším důvodem je neselektivní účinek cytostatik. Cytotoxický účinek se totiž týká všech bujících buněk, tedy i buněk normálních tkání. Nejživější proliferace u dospělého člověka se odehrává v kostní dřeni a v epitelu trávicí trubice. Je tedy zřejmé, že podání cytostatika ničí paralelně s proliferujícími buňkami nádoru i proliferující buňky normální. Z toho vyplývá značná toxicita chemoterapie a určité omezení ve využití jejího cytotoxického účinku na nádor. Tuto nevýhodu lze však při vhodně zvolené taktice podávání chemoterapie částečně překonat.
Optimální taktika cytostatické léčby
Je-li cílem cytostatické léčby vyplenění nádorové populace, pak je zřejmé, že jde o nesnadný úkol, a to nejen z důvodů uvedených v předchozím odstavci. V období diagnózy je totiž nádorová populace neobyčejně početná. Nejmenší nádor, který lze diagnostikovat, obsahuje přibližně 109, tj. miliardu nádorových buněk. Převážná většina nádorů je však diagnostikována v období, kdy velikost nádorové populace čítá zhruba 1012 i více buněk. Moderní chemoterapie využívající synergního nebo potenciačního účinku cytostatických kombinací, je sice schopná zničit 99 % proliferujících buněk, avšak s přihlédnutím k výchozímu počtu buněk v nádoru je taková redukce zcela nedostatečná. Úbytek populace o 99 % představuje totiž pouze pokles počtu buněk o 2 řády (log10). Při výchozím počtu 1012 se sníží počet buněk v populaci na 1010 (podobně jako by se při počtu 102 projevil 99% úbytek snížením na 100). Ani nadměrné zvýšení dávek cytostatika by nádorovou populaci nevyplenilo, ale mohlo by mít fatální důsledky pro normální proliferující (množící se) buňky. Lze totiž přežít pouze jejich úbytek o 3 řády, tj. o 99,9 %. Nádorová populace by se v takovém případě zmenšila z 1012 pouze na 109 buněk. Proto je nutné dosáhnout léčebného účinku jiným způsobem.V optimální léčebné taktice využíváme poznatků cytokinetických studií, které zjistily, že generační čas (buněčný cyklus) nádorových buněk je delší než generační čas buněk normálních. Předpokládejme, že k léčbě použijeme účinné kombinace cytostatik, která zničí 99 % dělících se buněk (nádorových i normálních). Byla-li výchozí četnost buněk nádoru 1012, klesne po léčbě na 1010 (tj. 10 miliard) nádorových buněk. Přesto je nutné léčbu přerušit a umožnit obnovu normálních buněčných populací. K té dojde (při kratším generačním čase normálních buněk) dříve než v populaci nádoru. Po regeneraci normálních buněk podáme další léčebný cyklus, při jehož zahájení nedosahuje nádorová populace výchozí četnosti a postupným opakováním léčebných cyklů s následnými přestávkami můžeme nádorové onemocnění buňky zcela eliminovat, jak ukazuje schematicky obrázek.
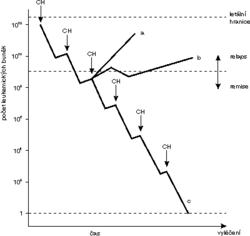 Zbývá vysvětlit, proč nelze zmíněnou léčebnou taktikou dosáhnout ve všech případech úplného vyléčení. Příčin je nepochybně řada. Předně nelze vždy důsledně opakovat cykly chemoterapie ve stanovených intervalech pro nesnášenlivost cytostatik nebo pro známky orgánové toxicity. Útlum krvetvorby vyvolaný chemoterapií se projeví snížením počtu bílých krvinek a krevních destiček, což vede ke zvýšenému počtu výskytu infekčních a krvácivých komplikací. Ty jsou pak překážkou další léčby. Účinnost léčby se může měnit i pro vznik rezistence na podávaná cytostatika. Nelze přehlížet ani tzv. přirozenou rezistenci nebo citlivost nádorů k chemoterapii, která vyplývá z biologických vlastností nádorů a liší se podle jejich histogeneze. Některé nádory (např. karcinom ledviny, karcinom pankreatu) jsou k chemoterapii téměř necitlivé, jindy je výborná citlivost zárukou jejich kurativního účinku, tj. úplného vyléčení nádoru (např. u choriokarcinomu, nádorů varlat, nádorů dětského věku).
Zbývá vysvětlit, proč nelze zmíněnou léčebnou taktikou dosáhnout ve všech případech úplného vyléčení. Příčin je nepochybně řada. Předně nelze vždy důsledně opakovat cykly chemoterapie ve stanovených intervalech pro nesnášenlivost cytostatik nebo pro známky orgánové toxicity. Útlum krvetvorby vyvolaný chemoterapií se projeví snížením počtu bílých krvinek a krevních destiček, což vede ke zvýšenému počtu výskytu infekčních a krvácivých komplikací. Ty jsou pak překážkou další léčby. Účinnost léčby se může měnit i pro vznik rezistence na podávaná cytostatika. Nelze přehlížet ani tzv. přirozenou rezistenci nebo citlivost nádorů k chemoterapii, která vyplývá z biologických vlastností nádorů a liší se podle jejich histogeneze. Některé nádory (např. karcinom ledviny, karcinom pankreatu) jsou k chemoterapii téměř necitlivé, jindy je výborná citlivost zárukou jejich kurativního účinku, tj. úplného vyléčení nádoru (např. u choriokarcinomu, nádorů varlat, nádorů dětského věku).
Postavení chemoterapie v komplexní protinádorové léčbě
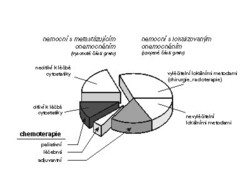 Chemoterapie je dnes v každém případě nepostradatelnou metodou léčby nádorových onemocnění a její podíl na celkovém úspěchu vyplývá z obrázku.
Chemoterapie je dnes v každém případě nepostradatelnou metodou léčby nádorových onemocnění a její podíl na celkovém úspěchu vyplývá z obrázku.
Přibližně u dvou třetin nemocných se nádor odhalí v lokalizovaném stadiu a zhruba polovina těchto nemocných může být vyléčena lokálními léčebnými metodami (operací, ozářením). U zbývající poloviny jsou tyto metody nedostačující. Chirurg sice může odstranit i značně objemný nádor, radioterapie zabrání jeho recidivě, ale diseminované (roztroušené, rozptýlené) onemocnění může ovlivnit výhradně chemoterapie. Protože v období operace nelze vyloučit přítomnost mikrometastáz, cytostatická léčba může přispět k likvidaci této zbytkové populace nádoru. To je cílem tzv. adjuvantní chemoterapie podávané v návaznosti na chirurgickou léčbu nebo radioterapii. Třetina nemocných přichází s pokročilým onemocněním. Ačkoliv téměř u poloviny těchto nemocných má chemoterapie výrazný léčebný účinek, bývá tento účinek dočasný, kdežto kurativní účinek (tj. trvalé vyléčení) zaručí chemoterapie jen asi u 4 % nemocných. Proto se hledají možnosti jak účinnost chemoterapie posílit.
Perspektivy chemoterapie v dalším desetiletí
Koncem 80. let se ozývaly četné názory deklarující, že éra chemoterapie prakticky skončila a že bylo již maximálně využito všech možností, které chemoterapie v léčbě nádorových onemocnění může nabídnout. Záhy se ukázalo, že je tato skepse předčasná. Pramenila bezpochyby z toho, že prakticky ustal přísun nových látek s cytostatickým účinkem do klinické praxe. V posledních letech se objevilo pouze několik nových antimetabolitů (fludarabin fosfát, 2-chlorodeoxyadenosin) a extrakt z kůry pacifického tisu (taxis brevifolia) nazvaný taxol (viz Vesmír 72, 356, 1993/6 a Vesmír 72, 533, 1993/9). Přísun nových cytostatik však rozhodně není jedinou cestou, jak účinnost a uplatnění protinádorové chemoterapie posílit. Existuje několik dalších možností. Jsou to:- zdokonalení léčebné taktiky, které spočívá v možnosti většího využití tzv. multimodálních přístupů (tj. kombinace všech metod protinádorové léčby), a zejména v možnosti aplikace vyšších dávek cytostatik, bez rizika fatálních důsledků. To bylo umožněno zdokonalením podpůrné léčby. Zde se uplatnila nejen dokonalejší profylaxe a léčba virové, mikrobiální a mykotické infekce, ale zejména možnost léčby útlumu kostní dřeně hemopoetickými růstovými faktory. Jde o působky produkované převážně T-lymfocyty, které podněcují tvorbu a diferenciaci bílých krvinek, popřípadě i jiných krevních elementů. Tyto působky byly připraveny rekombinantní technikou a jsou dostupné jako obchodní přípravky. Po jejich podání se velmi rychle upraví nízké počty krvinek, takže není nutno vyčkávat s dalším podáním léčebného cyklu chemoterapie až na spontánní úpravu krevního obrazu.
- Omezení toxicity chemoterapie je další cestou k posílení účinnosti chemoterapie. Známky orgánové toxicity často bránily v požadované délce cytostatické léčby. Objev ochranných látek tato omezení do značné míry eliminuje. Tak např. toxickému poškození močového ústrojí cyklofosfamidem a jeho deriváty lze předejít současným podáváním přípravku mesna, poškození srdečního svalu po antracyklinech brání současná léčba dexrazoxanem. Nověji se zavádí sulfhydrilová sloučenina amifostin se schopností selektivní ochrany normálních tkání proti účinku alkylačních látek.
- Překonání rezistence vůči chemoterapii je dnes v popředí zájmu klinického i experimentálního výzkumu. Nejvíce pozornosti se věnuje tzv. mnohočetné rezistenci (MDR = multiple drug resistence). Je to zvláštní druh rezistence společné pro různá, strukturálně odlišná cytostatika. Tento typ rezistence je způsoben nahromaděním zvláštního fosfoglykoproteinu v buněčné membráně nádorových buněk (P-glykoprotein). Zmíněný glykoprotein účinkuje jako pumpa, závislá na ATP, která odčerpává cytostatika z buňky a eliminuje tím jejich toxické působení. P-glykoprotein je produktem zvláštního genu, lokalizovaným na 7. chromozomu (MDR-gen), který lze určit různými molekulárněbiologickými metodami. Klinicky se zkouší řada přípravků schopných tento typ rezistence zrušit (verapamil, dexnigulpidin).
- Netradiční pojetí chemoterapie se začíná uplatňovat teprve v posledních letech. Jeho cílem není potlačit proliferaci, ale naopak podpořit vyzrávání dediferencovaných nádorových buněk. Diferenciační účinek byl zjištěn u některých polárních roztoků, jako je N-metylformamid, forbol ester a DMSO (dimetylsulfoxid). Dále byly diferenciační účinky pozorovány u vitaminu D3, a zejména u derivátů vitaminu A, tzv. retinoidů. Osvědčil se zejména tretinoin (ATRA = alltrans retinová kyselina), který působí dediferenciaci leukemických promyelocytů a jehož aplikace může indukovat remisi (přechodné vymizení příznaků) u akutní promyelocytární leukemie. Mechanizmus účinku není přesně znám, zdá se, že mimo jiné indukuje též programovanou smrt buňky, tzv. apoptózu. V léčbě nádorových onemocnění se již delší dobu uplatňují různé regulátory biologické odpovědi, především interferony. Mají kromě imunomodulačních a protivirových účinků též účinky antiproliferační. Jejich léčebný účinek je nejprokazatelnější u některých hematologických malignit, jako je leukemie z vlasatých buněk a chronická myeloidní leukemie.
Ve stručném přehledu nelze probrat všechny přednosti i nevýhody protinádorové chemoterapie. Jisté je, že podobně jako jiné, v současné době dostupné metody léčby zhoubných nádorů představuje chemoterapie pouze zásah do patogenetických mechanizmů. Možnost kauzální léčby se zdá zatím značně vzdálená, i když pokroky molekulární biologie a genetiky jsou reálným příslibem pro budoucnost. Experimentálně se již prověřuje možnost inhibice růstových faktorů, inhibice onkogenů použitím tzv. protisměrných oligonukleotidů nebo protilátek proti onkogenním proteinům, regulace transkripce onkogenů a další zásahy do genomu. Je však téměř jisté, že v nadcházející dekádě nebude ještě možno počítat s klinickým využitím takovýchto léčebných metod. Proto je nutné využívat zatím maximálně alespoň těch možností, které může chemoterapie nabídnout již v současné době.
Citát
JEAN-FRANÇOIS LYOTARD: O postmodernismu, Filozofický ústav AV ČR, Praha 1993, str. 155
Jakmile je akceptována představa, že existují poznatky, jejichž spolehlivost je zajištěna, otázka jejich předávání se pak pragmaticky rozčleňuje v řadu dalších otázek: Kdo předává? Co? Komu? Pomocí jakých prostředků? A v jaké formě? S jakým efektem? Univerzitní politiku tvoří právě vnitřně spjatý soubor odpovědí na tyto otázky.
Když rozhodujícím kritériem je performativita předpokládaného společenského systému,... výuka se pojímá jako podsystém tohoto společenského systému a na řešení každého ze zmíněných problémů se aplikuje totéž kritérium performativity.
Výsledek, kterého se má dosáhnout, je optimální příspěvek vysokoškolské výuky k lepší performativitě společenského systému. Ta bude muset vypěstovat lidi vybavené těmi typy kompetence, které jsou pro tento systém nepostradatelné... Jedny mají sloužit speciálně prosazení v mezinárodní soutěži... Jestliže naše obecná hypotéza je správná, pak poptávka po odbornících, vyšších kádrech a středních kádrech špičkových sektorů... bude vzrůstat; všechny obory týkající se „telematiky“ (informatikové, kybernetikové, lingvisté, matematikové, logikové...) by měly zakusit, že jim bude v oblasti výuky přiznáváno přednostní postavení. Tím spíš, že zmnohonásobení počtu těchto odborníků by mělo zrychlit pokroky výzkumu i v jiných odvětvích poznání, jak jsme to už viděli u medicíny a biologie.
Na druhé straně, vycházíme-li stále z téže obecné hypotézy, vysokoškolská výuka bude muset nadále zajišťovat pro společenský systém kompetence odpovídající jeho vlastním požadavkům, totiž požadavkům zachovat vnitřní soudržnost. Dříve tento úkol zahrnoval vytváření a šíření určitého obecného životního modelu, jehož legitimizaci zaručoval zpravidla emancipační příběh.

























