Protinádorová vakcinace pomocí radioterapie
Detailnější znalosti o mechanismu působení radioterapie a o jeho imunogenním potenciálu mění pohled na postavení radioterapie v léčbě nádorových onemocnění napříč většinou diagnóz.
Radioterapie (ozařování) je již desítky let nedílnou součástí onkologické léčby, často obávanou, až démonizovanou. Někteří lidé se dokonce obávají kontaktů s pacienty podstupujícími tuto léčbu, což pramení nejspíše ze zkušeností z přechodného rizika ozáření okolí u pacientů po radioizotopových vyšetřeních. Radiofobií netrpí pouze pacienti, ale bohužel i někteří lékaři jiných odborností.
Současné podoby ozařování
Při zevním ozařování využíváme více či méně cílené destrukce nádorové tkáně pomocí ionizujícího záření, jehož zdrojem jsou lineární urychlovače, radioizotopové zdroje či cyklotrony, případně synchrotrony (ozařování protony či těžkými ionty).
Radioterapie bývá považována za léčbu omezenou na cílovou oblast (nádor, případně spádové mízní uzliny) a její úloha v ovlivnění systémového „celotělového“ postižení byla považována za zanedbatelnou. Vychází z různé citlivosti nádorových buněk a zdravých tkání k ozáření. Při nutnosti ozáření nádoru, který je považován za málo citlivý k ozáření a navíc je obklopen tkáněmi s vysokou citlivostí k radiačnímu poškození (typicky nádory mozku, zažívacího traktu, některé ORL nádory, sarkomy a další), narážíme na problém, zda je dostatečně účinná radioterapie vůbec proveditelná, aniž bychom překročili akceptovatelnou míru rizika poškození.
Ozařování vždy historicky směřovalo k maximalizaci loko-regionálního efektu a jsou při něm předepisovány relativně vysoké kurativní dávky záření s cílem destrukce všech nádorových buněk v ložisku, často za cenu, že se přiblížíme tolerančním dávkám okolních zdravých tkání. Ozáření bývá standardně aplikováno tak, aby byla ozářena každá část nádoru stejně a dostatečně vysokou, tedy smrtící dávkou. Tato dávka ale nemůže být aplikována najednou kvůli riziku poškození okolních tkání. Ozařovací cyklus probíhá nejčastěji v 10 až 35 sezeních (frakcích). Celkové dávky se pak pohybují obvykle v rozmezí 30 až 70 Gy. Tato frakcionace vyplývá z empirické zkušenosti s ověřenou bezpečností pro zdravé tkáně a zároveň předpokládanou letální dávkou pro nádor.
K ozařovanému ložisku se často přidávají i nejbližší (spádové) mízní uzliny. Ze zkušeností z chirurgicky odstraněných a histologicky vyšetřených uzlin víme, že je zde vyšší pravděpodobnost mikroskopického postižení nádorem (subklinické postižení). Ozařování mízních uzlin tak bývá doporučováno u pacientů s agresivnějšími a pokročilejšími nádory. To zvětšuje velikost cíleně ozářené tkáně.
Po radikálním ozáření většiny nádorů může být narušena obnova buněk okolních tkání kvůli snížení počtu kmenových buněk, které slouží jako zásobárna pro přirozenou obnovu a regeneraci tkání. Poškozená tkáň bývá nahrazena méně funkčním vazivem, mohou být poškozeny stěny malých i větších cév, což může znamenat zhoršené prokrvování tkáně a její další degradaci (například její úplné odumření – nekrózu) nebo riziko krvácení z těchto poškozených cév. Nelze vyloučit, že dojde k akutnímu i opožděnému poškození tkání, které může po onkologické léčbě negativně ovlivnit kvalitu života. Znamená to také, že málokteré oblasti je možné radikálně ozářit vícekrát než jednou za život, pokud chceme zachovat únosnou míru rizika radiačního postižení.
„Zdá se, že se mohou změnit všechny aspekty této léčebné metody – tedy role, aplikace, kombinace se systémovou terapií i indikace.“
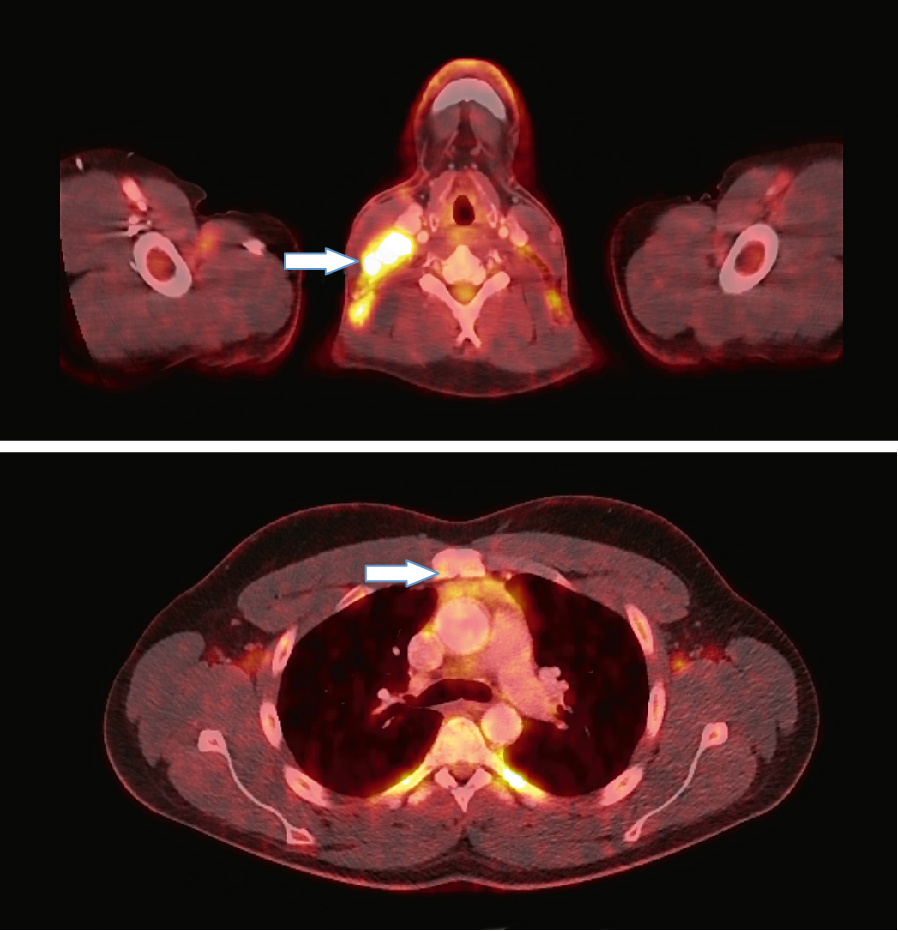
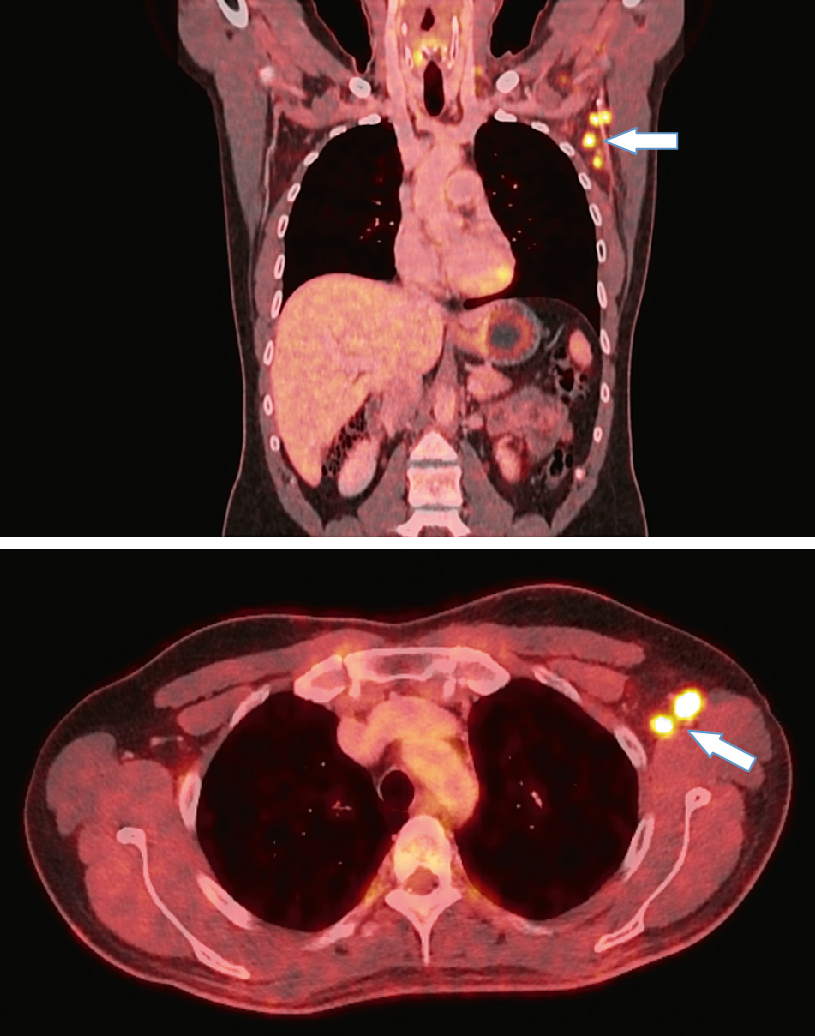
Standardní ozáření nádoru i se spádovými mízními uzlinami nebývá z imunologického hlediska optimální. Při frakcionaci radioterapie totiž opakovaně ozařujeme velký objem cirkulující krve a také mízní uzliny drénující nádor, a tím i přítomné četné buňky imunitního systému, které bývají velmi citlivé k nízkým dávkám záření (například lymfocyty již zhruba na 0,5 až 3 Gy). Jejich přítomnost v dostatečném počtu je zásadní pro účinnou aktivaci dějů protinádorové imunitní kaskády.
I přes tato úskalí je standardní radioterapie léčbou, která může zajistit velké části pacientů kontrolu jejich onkologického onemocnění a u řady z nich je jinými léčebnými postupy nenahraditelná. Při léčbě onkologických onemocnění se radioterapie zařazuje do léčebného schématu asi u 50 % až 60 % pacientů. Možnost kombinace radioterapie s různými imunoterapeutickými léčivy pak navyšuje potenciál tohoto přístupu v léčbě onkologicky nemocných pacientů.
Role imunitního systému
U solidních nádorů, jako jsou například plicní karcinomy, některé nádory hlavy a krku, nádory jícnu, maligní melanomy, karcinomy ledvin a další, chceme kromě loko-regionální kontroly také zabránit rozšíření do vzdálených lokalit (vznik metastáz). Naproti tomu hematologická onemocnění, jako leukemie a lymfomy, jsou svou přirozeností celotělovým onemocněním a důraz kladený na lokální ošetření je menší.
Pro obavy z nedostatečného celotělového efektu a poradiačního poškození zdravých okolních tkání se radioterapie u některých nádorů dostávala na okraj zájmu onkologů. Byla považována za metodu, která s sebou nese rizika vývoje obávané toxicity a je překonaná moderními, „bezpečnějšími“ přístupy cílené systémové terapie. Mezi tyto metody patří například monoklonální protilátky proti povrchovým znakům nádorových buněk, antiangiogenní léčba cílená proti tvorbě nádorových cév, inhibitory tyrosinkinázy, které brání přenosu signálu v rámci nádorových buněk. Použití těchto převratných léčiv však nemusí vyvolat dlouhodobý léčebný efekt. Dynamické změny v nádoru mohou vést k selekci buněk vykazujících rezistenci na cílený lék.
Imunitní systém pacienta s nádorovým onemocněním, jehož imunitnímu dohledu nádor původně unikl, byl dříve v další léčbě považován za méně důležitého hráče. Během tvorby nádoru se totiž postupně ztrácí schopnost hostitelského organismu zneškodnit maligní nádorové buňky kvůli selekci nádorových klonů s nízkou rozpoznatelností (antigenicitou) a nastává imunitní tolerance nádoru.