Regenerace nervové tkáně
Poranění mozku a míchy představují vážné zdravotní problémy, jejichž léčba je stále velmi omezená. V oddělení regenerace nervové tkáně se snažíme nalézt nové způsoby, jak tyto škody napravit. Náš výzkum se zaměřuje na několik klíčových oblastí: regeneraci axonů (nervových vláken), zlepšení prostředí v oblasti poranění, náhradu poškozených buněk a využití biomateriálů pro překlenutí místa poškození.
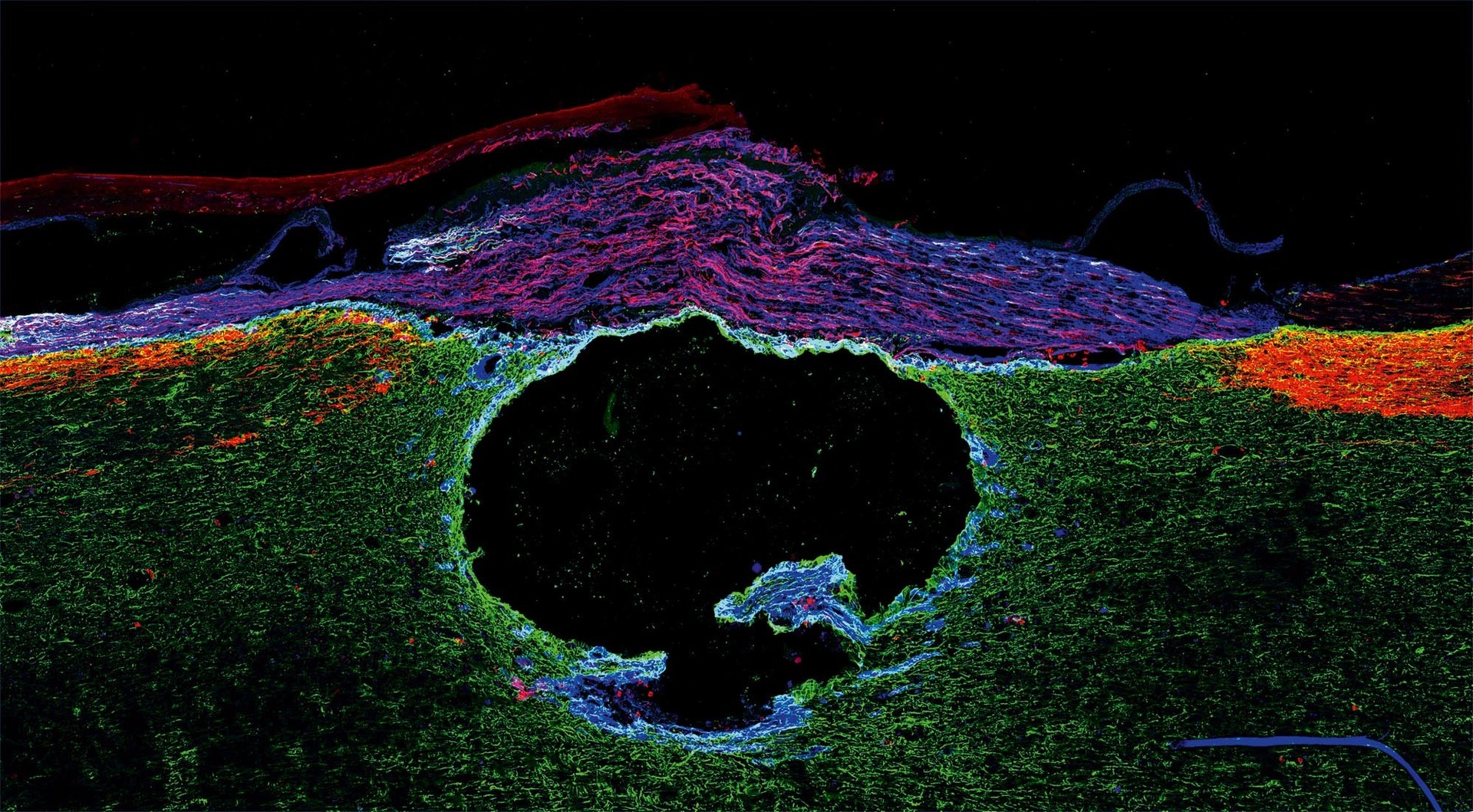
Proč je regenerace axonů v centrální nervové soustavě (CNS) dospělých jedinců tak obtížná? Nedávno se ukázalo, že problém spočívá ve špatném transportu molekul potřebných pro růst axonů. Jedněmi z klíčových molekul tohoto procesu jsou transmembránové receptory zvané integriny. A dospělým neuronům chybí specifický integrin, který by interagoval s molekulami v poraněné oblasti CNS. Ve spolupráci s vědci z Univerzity v Cambridge jsme do těl senzorických neuronů pokusných potkanů injikovali virové vektory nesoucí integrin α9 a zjistili jsme, že nervová vlákna těchto neuronů v poškozené míše výrazně regenerovala a zlepšily se senzorické funkce (viz obr. 1).
Další studie ukázaly, že důležitou roli v růstu axonů hraje molekula PIP3, která stimuluje buněčné procesy podporující růst. Hladiny této molekuly jsou v mladých axonech vysoké, ale postupně klesají. Náš výzkum zaměřený na enzym PI3Kδ, který se běžně vyskytuje v neuronech a PIP3 v nich vytváří, ukázal, že jeho aktivace v neuronech v mozku vede k regeneraci přerušených axonů v míše.
Klíčovým procesem při regeneraci axonů je také autofagie, což je mechanismus, kterým buňky likvidují poškozené části (Vesmír 95, 696, 2016/12). Během růstu axonů se autofagosomy (buněčné struktury zapojené do autofagie) tvoří v růstových kuželech na koncích axonů. Ale pokud jsou přítomny inhibiční molekuly, jako jsou proteoglykany s navázaným chondroitin sulfátem, je jejich pohyb omezen, což blokuje růst axonů. Na základě našich experimentů jsme zjistili, že autofagie hraje důležitou roli v transportu receptorů nezbytných pro růst axonů. Tento proces sledujeme na našich laboratorních modelech, které nám umožňují studovat tvorbu a transport autofagosomů a testovat účinky na růst neuronů.
Kromě buněčných faktorů, které omezují regeneraci, je dalším problémem přítomnost inhibičních molekul v gliové jizvě a myelinu. Tyto molekuly brání regeneraci axonů v poraněné oblasti. Molekuly mezibuněčné hmoty, které tvoří část gliové jizvy, lze rozštěpit enzymem chondroitinázou. Kvůli nízké stabilitě a bezpečnostním rizikům však má jen omezené využití. Proto jsme testovali látku 4-metylumbeliferon (4MU), která inhibuje syntézu kyseliny hyaluronové. V experimentech na zvířatech s chronickým poraněním míchy vedlo podávání 4MU k významné redukci gliové jizvy a k zvýšení plasticity nervové tkáně. Pokud se podaří podávání této látky optimalizovat, mohla by v budoucnu pomoci pacientům s poraněním CNS. Je již schváleným lékem pro jiné účely, což zjednodušuje její potenciální schválení pro léčbu poranění mozku a míchy.
Výzkum se také zaměřuje na neuroprotekci, tedy ochranu nervové tkáně před dalším poškozením. Zkoumáme zejména kmenové buňky a jejich produkty, jako jsou exozomy. Tyto malé váčky obsahují různé biologicky aktivní molekuly, které mohou podporovat regeneraci nervové tkáně, snižovat zánět, a dokonce překonávat hematoencefalickou bariéru, což z nich činí slibnou alternativu k samotné buněčné terapii.
Mladý tým vědců v detašovaném pracovišti ÚEM AV ČR v centru BIOCEV pracuje na několika dalších projektech zaměřených na regenerativní medicínu a tkáňové inženýrství. Jejich cílem je například vytvořit 3D modely mozkových nádorů nebo zlepšit terapeutické schopnosti kmenových buněk. Spolupracují s dalšími výzkumnými ústavy a soukromými společnostmi na vývoji nových technologií, které by mohly být použity jak v laboratořích, tak přímo v klinické praxi.
Oddělení regenerace nervové tkáně má jako své hlavní výzkumné směry regeneraci nervových drah po míšním poranění, zvýšení plasticity nervové tkáně po chronickém míšním poranění a zlepšení paměti během stárnutí a neurodegenerativních stavů. Vytváříme in vitro 3D modely pro testování léků a výzkum mozkových nádorů. Zkoumáme roli exozomů z kmenových buněk v regeneraci poraněné míchy, vývoji mozkových aneurysmat a mikroprostředí glioblastomů. Spolupracujeme s chemiky na vývoji polymerů pro regeneraci tkání a materiálů pro cílené doručování léčiv a in vivo zobrazování.
Vedoucí oddělení: doc. RNDr. Pavla Jendelová, Ph.D.
Ke stažení
 článek ve formátu pdf [365,87 kB]
článek ve formátu pdf [365,87 kB]