Editace genomů rostlin pomocí CRISPR/Cas9
| 2. 10. 2017V dubnu 2016 vydalo ministerstvo zemědělství USA nenápadnou zprávičku oznamující, že žampiony vyšlechtěné tak, aby po nakrájení nehnědly, nejsou považovány za geneticky modifikované a před jejich prodejem nejsou nutné žádné další testy. Zpráva by asi zapadla nepovšimnuta, nebýt toho, že půjde patrně o první potravinu na trhu, při jejímž šlechtění byla použita technika CRISPR/Cas9. K čemu ji mohou využít šlechtitelé rostlin?
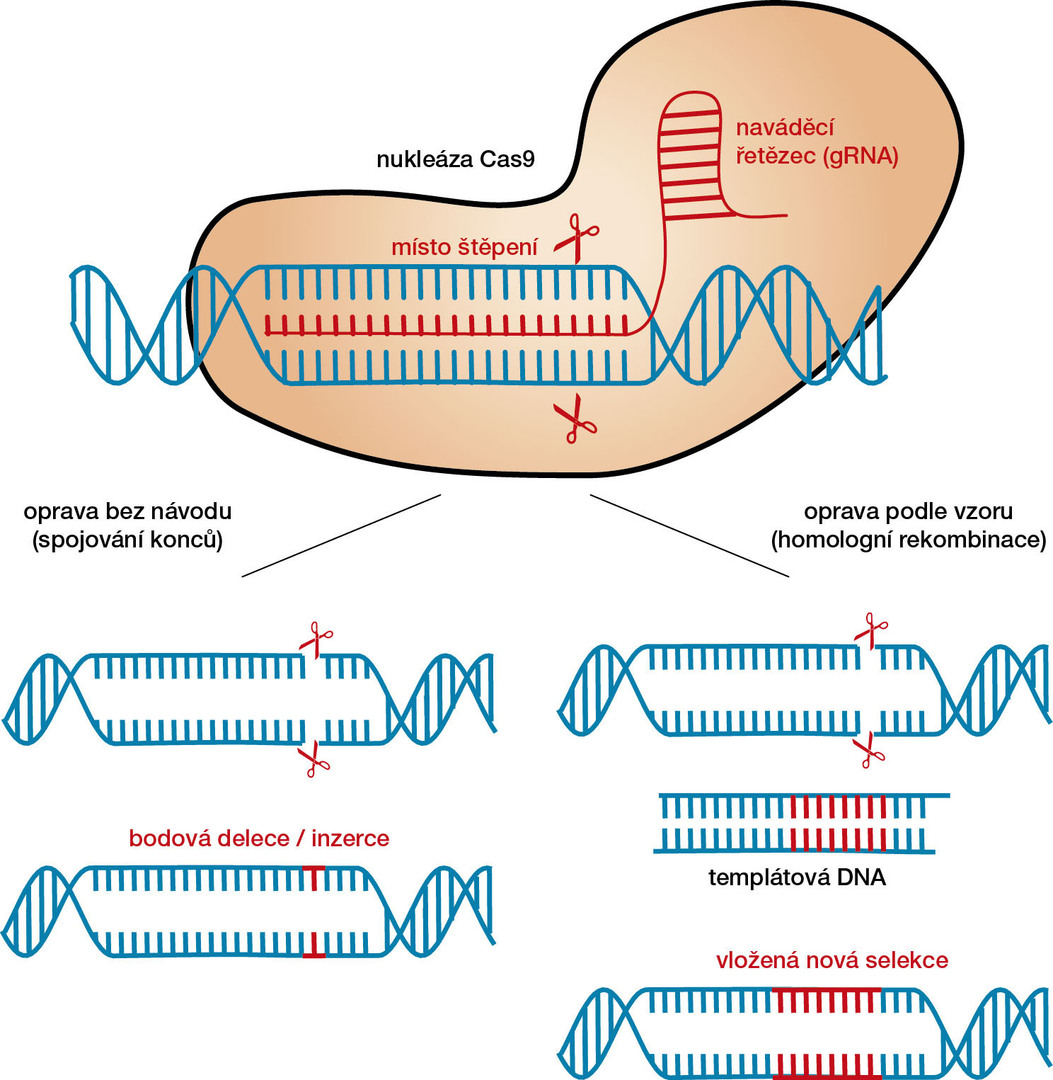
CRISPR/Cas9 umožňuje s dosud nebývalou snadností a přesností zasahovat do genomů všech živých organismů. Existující geny mohou být deaktivovány a místo nich lze na stejnou pozici vložit geny nové. Hovoří se o tzv. editaci genomu.
Koncem osmdesátých let si výzkumníci z Univerzity v Ósace všimli, že v genomech některých bakterií se vyskytují podivné opakující se motivy DNA oddělené „náhodnými“ krátkými úseky. Tyto repetice, pro které se vžil název CRISPR,1) byly vzápětí odhaleny asi u 40 % bakterií a 90 % archeí, nicméně jejich funkce zůstávala neznámá. Jejich význam si uvědomili až v roce 2007 vědci dánské společnosti Danisco vyrábějící jogurtové kultury, kteří je dali do souvislosti s odolností bakterií vůči bakteriofágům. Postupně byly odhalovány i funkce dalších genů, které s těmito repeticemi souvisejí a které byly pro přehlednost označovány jako Cas sekvence (CRISPR associated sequence). Začínalo být zřejmé, že i tak jednoduché organismy, jako jsou bakterie, mají důmyslný adaptivní imunitní systém na obranu proti fágům.
Okolo roku 2010 prokázal tým z Vídeňské univerzity pod vedením Emanuely Charpentierové, že enzym Cas9 z bakterie Streptococcus pyogenes je ve spojení s dvěma krátkými RNA (tracrRNA a crRNA) velmi účinnou nukleázou, jejíž specifita je dána jednou z krátkých RNA (crRNA). Tato crRNA vzniká transkripcí právě oněch „náhodných“ krátkých sekvencí uložených v bakteriálním genomu. Bakterie infikovaná fágem si krátké úseky fágové DNA uloží do svého genomu, a pokud infekci přežije, její potomci si střetnutí s fágem navždy pamatují a jsou na něj připraveny. Ve spojení s týmem Jeniffer Doudnaové z Kalifornské univerzity v Berkeley zanedlouho ukázali, že tento systém lze ještě zjednodušit, dvě krátké RNA spojit v jedinou, nově nazývanou gRNA (guide), a tímto komplexem poté provádět specifické „programovatelné“ štěpení DNA.
Téměř vzápětí na tyto výsledky navázal tým Fenga Zhanga z MIT, který systém modifikoval pro funkci v savčích a rybích buňkách. Během několika měsíců byla funkčnost nukleázy Cas9 prokázána mnoha skupinami v různých organismech včetně několika druhů modelových rostlin (tabáku, huseníčku), a dokonce i zemědělských plodin, jako je rýže. Již z prvních studií bylo zřejmé, že tato nová technika nejenže funguje, ale funguje po čertech dobře. Od prvotního objevu k revolučnímu biologickému nástroji uběhlo zhruba 25 let.2)
Dnes je CRISPR/Cas9 technologie používána ve všech oblastech biologického a lékařského výzkumu, téměř každý týden přicházejí další a další novinky, modifikace a vylepšení, případně použití pro nový účel. Depozitář volně dostupných DNA vektorů Addgene obsahuje přes 5000 různých CRISPR konstruktů, z nichž si mohou výzkumníci vybírat jako v samoobsluze podle toho, na jakém organismu pracují a co přesně chtějí udělat.
Co vlastně CRISPR/Cas9 umí
Původní Cas9 nukleáza z bakterií S. pyogenes umí dobře štěpit DNA v místě určeném krátkou crRNA. Nejprve vytvoří komplex se dvěma krátkými vlákny RNA (tracrRNA a crRNA) a poté na základě párování bází RNA/DNA vyhledá na molekule DNA úsek shodný s navázanou crRNA. Pokud najde shodu, rozštěpí obě dvě vlákna DNA dvoušroubovice. Na první pohled to možná nijak převratně nevypadá; enzymů, které dokážou štěpit DNA na předem určených místech, známe mnoho již od počátků molekulární biologie. Nicméně klasické restrikční enzymy mají většinou velmi krátké cílové sekvence, nejčastěji 4 až 8 nukleotidů. Takových míst je i v těch nejjednodušších genomech obrovské množství, takže tyto enzymy nejsou k přesné editaci genomů prakticky použitelné. Navíc je cílové místo každého enzymu pevně dáno a nelze ho nijak jednoduše změnit.
Zhruba od začátku tisíciletí se začínají objevovat programovatelné nukleázy. Nejprve to byly ZFN3) a později TALEN.4) Obě tyto třídy nukleáz fungují jako dimerické fúzní proteiny. Jejich specifita je dána DNA vazebnou doménou. Pokud je potřeba takovou nukleázou štěpit jiné místo v genomu, je nutné navrhnout a sestavit celou novou DNA vazebnou doménu. To je velmi pracné, zdlouhavé a navíc není ani zaručena její funkčnost. Každý takový nový protein se nejprve musí důkladně otestovat in vitro. Z těchto důvodů také není možné využívat ZFN a TALEN pro mnohonásobnou editaci genomu (tzv. multiplexing). Naproti tomu je cíl u CRISPR/Cas9 určen krátkým úsekem RNA, který lze velmi snadno nahradit jiným, stejně dlouhým. V dnešní době existují i dodavatelé, kteří během několika dnů na zakázku vyrobí a zašlou krátkou syntetickou RNA, na přání dokonce i v komplexu s proteinem Cas9. Není v zásadě problematické editovat genom na desítkách i stovkách míst současně.
Kromě původní Cas9 nukleázy dnes již existují i varianty vytvářející pouze jednovláknové zlomy, případně varianty, které DNA neštěpí vůbec, ale slouží jako „spojka“ pro naváděcí RNA a výkonný protein (aktivátor, represor atd.), který modifikuje genovou expresi.
K čemu je to dobré?
Rozštěpená vlákna DNA jsou buněčnými opravnými mechanismy opět spojena. V rostlinných buňkách je nejčastějším způsobem opravy nehomologní spojení konců (tzv. NHEJ, non homologous end joining). Jde v podstatě o panickou reakci rostliny na smrtelné ohrožení – přetržení DNA. Pro buňku je výhodnější opravit DNA špatně, než ji mít rozštěpenou. Opravné enzymy pospojují volné konce DNA a během opravy často přidají nebo uberou několik málo bází. Opravou vznikne mutace, která může vést k deaktivaci genu.
Ke stejnému typu poškození DNA dochází i vlivem vnějšího prostředí nebo během ozařování u klasického šlechtění. Výsledné mutace jsou v obou případech stejné. Rozdíl je pouze v tom, že ozařování vyvolá náhodné mutace po celém genomu, metodou CRISPR/Cas9 lze vyvolat přesnou mutaci v konkrétním genu (genech). Následné vyhledání a selekce žádoucích vlastností u potomstva je pak mnohem kratší a jednodušší.
„Od roku 2011 se každým okamžikem očekává, že Evropská komise rozhodne, zda a případně které tzv. nové techniky šlechtění budou považovány za GMO.“
Použitím této nejjednodušší varianty CRISPR/Cas9 lze tedy dosáhnout v principu stejných výsledků jako při běžném mutačním šlechtění, pouze nepoměrně rychleji a snadněji. Obrovský význam to má pro základní výzkum, kdy lze deaktivovat buď jeden konkrétní gen, nebo celou genovou rodinu najednou. Díky tomu lze určit funkci jednotlivých genů. Ve spojení s naší neustále se zlepšující schopností v genomu číst, s rozsáhlými databázemi a s metodami syntetické biologie jde o velmi důležitý nástroj.
Při použití této techniky ke šlechtění plodin se dají očekávat rostliny se zvýšenou odolností k některým chorobám, protože v nich byl deaktivován gen, který je pro patogen nezbytný. Již dnes jsou k dispozici okurky rezistentní vůči viru žluté mozaiky cukety a dalším potyvirům nebo rajčata a tabáky odolné vůči geminivirům. Dále se dají očekávat rostliny se změněnými užitnými vlastnostmi, například se změněným složením mastných kyselin. Příkladem je sója se sníženým obsahem polynenasycených mastných kyselin v oleji. U mnoha plodin lze zastavit syntézu alergenů, toxinů či antinutričních látek.
Je Cas9 dost přesná?
Jedinou oblastí, kde nukleáza Cas9 ještě (možná) pokulhává, je přesnost. Některé studie prokázaly, že kromě cílového místa dochází v malém procentu případů ke štěpení ještě jinde v genomu (tzv. off-target štěpení). Pro použití v humánní medicíně je to zásadní problém, protože mutace v jiných místech genomu může ohrozit zdraví pacienta.5) U rostlin je štěpení genomu na jiném než zamýšleném místě sice nepříjemné, nicméně to nepředstavuje zásadní problém. Většinou si lze vybrat z více linií anebo nežádoucí mutace odstranit zpětným křížením.
Pravděpodobnost nežádoucí mutace lze snížit také vhodným výběrem cíle gRNA, k čemuž lze použít stále se zlepšující volně dostupné webové nástroje a vyhledávače. Další možností je použít mutantní verzi Cas9, která vytváří pouze jednovláknové zlomy, a genomovou DNA naštěpit na dvou místech do cca 100 párů bází od sebe. Opravné mechanismy buňky pak buď odstraní celý fragment, nebo uvedou vše do původního stavu.
Jedním z důvodů, proč dochází k mutacím mimo zamýšlené místo, je dlouhá doba, po kterou je genom vystaven působení nukleázy Cas9. V prvních pokusech byla produkce enzymu Cas9 řízena velmi silným promotorem, který je navíc aktivní ve všech rostlinných pletivech. Stejně tak i gRNA se produkuje neustále, takže po celou dobu života rostliny je genomová DNA v každé buňce vystavena funkční nukleáze. Ukazuje se, že lepších výsledků dosáhneme „zapnutím“ nukleázy Cas9 pouze na krátkou chvíli v pohlavních buňkách. Dále je věnována velká pozornost hledání enzymu s lepší specifitou, první takový mutant byl popsán na jaře 2016 a jistě budou brzy následovat další.
Homologní rekombinace
V doposud uvedených případech byla Cas9 nukleáza použita k poškození funkčního genu vyvoláním bodové mutace. I když je to velmi důležitá schopnost, techniku CRISPR/Cas9 lze použít pro vytváření ještě daleko zásadnějších cílených změn s použitím dalšího opravného mechanismu – tzv. homologní rekombinace.
Homologní rekombinace (HR) byla u většiny rostlin dlouho považována za prakticky nepoužitelnou. Na rozdíl od oprav mechanismem NHEJ, kdy buňka opravuje zlomy v DNA bez jakékoliv další informace, je při opravách mechanismem HR zapotřebí neporušená kopie DNA, jejíž konce mají homologii s konci zlomené DNA. Buňka pak podle ní opraví poškozenou DNA. Tímto způsobem lze jednu variantu genu vyměnit za jinou, například z divoce rostoucího příbuzného modifikované plodiny.
Prostřednictvím programovatelných nukleáz (ZFN, TALEN nebo CRISPR/Cas9) lze sice naštěpit genomovou DNA na správném místě, ale pro úspěch homologní rekombinace je ještě potřeba do jádra vpravit dostatečné množství opravné templátové DNA, a navíc buňku popostrčit, aby ze dvou možných opravných mechanismů vybrala ten správný. To se začíná dařit až v poslední době díky využití rostlinného viru, který se v jádře rostlinné buňky replikuje jako malý plazmid a může být přítomen až v několika tisících kopií. Podíl rostlinek, ve kterých došlo k úspěšné homologní rekombinaci, je zatím malý (v řádu jednotek procent, nejlépe okolo 9 %), nicméně již to je obrovský posun.
Podobně jako u bodových mutací vyvolaných NHEJ je i při homologní rekombinaci možno dosáhnout stejného efektu jako u klasického šlechtění křížením. Pokud ovšem nová alela například pro rezistenci pochází z příbuzného křižitelného organismu. Při klasickém křížení se však bohužel s jednou žádoucí vlastností přenese i mnoho nevhodných, které je potřeba zpětným křížením odstranit.
Šlechtitelé se například již přes čtyřicet let snažili velmi obtížným šlechtěním přenést do brambor gen odolnosti k plísni bramborové přes mezihostitele z mexické rostliny Solanum bulbocastanum, než bylo toto úsilí korunováno úspěchem, tj. komerční odolnou odrůdou brambor Bionica. Transgenozí lze dosáhnout stejného výsledku v řádu několika málo let. Při transgenozi však dochází k vložení nového genu na náhodné místo v genomu.
S neodhadnutelnými následky, které taková integrace může mít, souvisí i rozsáhlá legislativní regulace transgenoze, která prakticky zamezuje použití transgenních brambor na poli. Panuje naděje, že cisgenní rostliny, tj. takové, které mají na přesně stejném místě v genomu zaměněn jeden konkrétní gen jeho variantou ze sexuálně příbuzného druhu, by mohly být regulovány o něco jednodušeji.
Další výhodou homologní rekombinace je neexistence tzv. pozičního efektu. Všechny rostlinky mají nový gen na stejném místě genomu a chovají se přibližně stejně, zatímco u klasické transgenoze se každá linie chová trochu jinak. Vědci tak nemusí testovat desítky nezávislých linií (pro práci v laboratoři) nebo dokonce tisíce jako při šlechtění komerčních geneticky modifikovaných odrůd.
Specifika CRISPR/Cas9 u rostlin
Od použití v lidských nebo obecně savčích buňkách se aplikace metody CRISPR/Cas9 v rostlinné říši několika technickými detaily liší. Jedna skupina odlišností souvisí s otázkou, jak nejlépe do jádra rostlinné buňky dostat funkční komplex Cas9 + gRNA. Rostlinné buňky jsou chráněny odolnou buněčnou stěnou. Technicky nejjednodušším a dobře otestovaným způsobem, jak tuto překážku překonat a dopravit příslušné genové konstrukty do jádra, je použití rostlinného patogenu Agrobacterium tumefaciens.
Agrobakterie jsou přirozenými genovými inženýry a člověk je pro transformaci rostlin využívá od poloviny osmdesátých let. Pro cílenou editaci se dnes již klasickým způsobem vytvoří transgenní rostlina, která nese gen pro nukleázu Cas9 a jeden nebo více genů pro gRNA. Z potomstva této rostliny se vyberou takové, u kterých proběhla editace genomu, ale přitom neobsahují transgen.
Použití agrobakterií má ale jednu velkou nevýhodu. Tím, že jde o rostlinný patogen, spadají rostliny vytvořené s jeho použitím v USA automaticky pod dohled ministerstva zemědělství a jsou regulovány jako potenciální rostlinný patogen a GMO (geneticky modifikovaný organismus). V EU jsou rostliny, do jejichž genomu byla vložena cizí DNA pomocí agrobakterií, považovány za GMO, a to včetně potomstva, které již transgen nebosahuje. Alespoň podle některých právních výkladů. Existuje proto snaha použití agrobakterií obejít.
Jako nejslibnější se jeví použít in vitro připravenou RNA kódující jak Cas9 nukleázu, tak i gRNA. Tyto RNA se poté do rostlinných buněk dopraví například elektrickým šokem. Podle některých právních názorů je taková RNA v podstatě mutagenní chemikálie (neintegruje se do genomu) a takto upravená rostlinná buňka není považována za GMO. V dalším kroku je však potřeba odlišit mutované a nemutované buňky a z těch, které nesou požadovanou mutaci, vypěstovat celou rostlinu. U modelových rostlin a některých mutací to docela dobře funguje, nicméně při šlechtění zemědělských plodin není použití RNA zatím vhodná metodika.
Další skupina rozdílů souvisí přímo se strukturou rostlinných genomů. Genomy mnoha rostlinných druhů jsou velmi rozsáhlé. Zejména v jádrech plodin, které prošly tisíciletími domestikace a cíleného šlechtění, se často vyskytuje několik genomů současně. Například jádra buněk pšenice obsahují genomy tří trav, dnešní odrůdy cukrové třtiny mají dokonce 8 až 10 genomů v jediném jádře. Mutace vyvolané pomocí CRISPR/Cas9 vedou typicky k recesivním mutacím – tj. ztrátě funkce zasažené kopie genu. Aby byly ovlivněny vlastnosti rostliny, je často zapotřebí provést současnou mutaci všech funkčních kopií genu.
V některých plodinách lze následným křížením z genomu odstranit nežádoucí transgen (Cas9), ale u některých to možné není buď pro ztrátu vlastností, nebo proto, že se rozmnožují vegetativně (např. banány).
Biozemědělství
Nová technika už dokázala rozvířit doposud klidné a pevně sevřené šiky biozemědělců. Biozemědělci zatím moderní šlechtitelské postupy s výjimkou mutagenze odmítali, plodiny označované jako GMO jsou v biopotravinách přímo zakázány. V dubnu 2016 se však ředitel švýcarského Výzkumného ústavu pro biologické zemědělství (FiBL) Urs Niggli nechal v rozhovoru pro německý týdeník Taz slyšet, že by biozemědělci neměli možnosti techniky CRISPR/Cas9 paušálně odmítat a měli by její použití ještě uvážit.
Vyjádřil obavy z paradoxní situace, ke které může v brzké budoucnosti dojít. Konvenční zemědělci budou mít k dispozici výnosné odrůdy s mnoha geny odolnosti k chorobám, které byly v posledních staletích šlechtění ztraceny, a sníží tak svou závislost na chemických pesticidech. Biozemědělci by tyto odolné odrůdy k dispozici neměli. Jako další výhodu nových technik uvedl jejich demokratičnost. Jsou zatím totiž poměrně levné a dostupné téměř komukoliv. To se ovšem jejich zahrnutím mezi GMO může snadno změnit. Na otázku, zda se nebojí nezamýšlených důsledků během genové editace, Niggli uvedl, že nezamýšlené důsledky nelze zcela vyloučit nikdy a u CRISPR/Cas9 je riziko menší než u klasického šlechtění.
Bouřlivá reakce na tento rozhovor byla téměř okamžitá. Německá organizace Saat:gut sdružující biozemědělce vydala otevřený dopis popisující rozhořčení jejích členů nad zrádnými názory prof. Niggliho, který podle nich „uráží důvěru našich zákazníků a zasívá sémě pochybností ohledně našeho postoje ke genovému inženýrství“. Petice dále požadovala, aby rada FiBL zajistila, že zaměstnanci ústavu (míněno hlavně pan ředitel) budou vyjadřovat pouze názory, které jsou v souladu s oficiálním názorem biohnutí. Podobně se nechali slyšet i Přátelé Země a další nevládní organizace, zástupci firem provozujících testování GMO (Testbiotech) a další. Oficiálně se od té doby k této problematice bohužel nikdo další nevyjádřil, existují však náznaky, že názory Urse Niggliho nejsou v komunitě biozemědělců a šlechtitelů ojedinělé.
Je to GMO, nebo není?
GMO je právní kategorie vytvořená na konci minulého století zejména pro potřeby mezinárodního obchodu, respektive ochrany trhu. V devadesátých letech do této kategorie spadaly zejména plodiny transgenní, tj. takové, do kterých byl pomocí technik rekombinantní DNA vložen gen z biologicky nekompatibilního organismu. Různé státy definují GMO různě, většinou je však rozsah přesně vymezen výčtem konkrétních technik, které vedou ke vzniku GMO. Toto vymezení má velký praktický význam. Vícenáklady na deregulaci jediné GMO odrůdy se v současnosti odhadují na 10–40 milionů dolarů. Proto jsou současné GMO plodiny vyvíjeny pouze komerčními společnostmi a omezeny na několik málo komoditních plodin.
Již po zhruba deseti letech od prvního použití GMO plodin v zemědělství se ukázalo, že u některých novějších metod není zřejmé, zda vedou ke vzniku GMO, nebo nikoliv. Proto již v roce 2007 Evropská komise ustanovila pracovní skupinu expertů mající za úkol doporučit, které techniky by měly spadat do kategorie GMO, a být tak běžným šlechtitelům nedostupné, a na které by se přísná regulace nevztahovala. V té době ještě technika editace genů pomocí CRISPR/Cas9 neexistovala, experti však zhodnotili analogickou techniku ZFN. Pracovní skupina uzavřela své jednání v roce 2011. Došla k závěru, že techniky vedoucí k drobným mutacím obdobným těm vzniklým při klasickém šlechtění nelze identifikovat, tudíž ani regulovat.6)
Od roku 2011 se každým okamžikem očekává, že Evropská komise rozhodne, zda a případně které tyto tzv. nové techniky šlechtění budou považovány za GMO. V roce 2015 již některým členským státům došla trpělivost a přestaly čekat na jednotné celoevropské rozhodnutí. Ve Švédsku byl například povolen venkovní pokus s rostlinami huseníčku, jejichž genom byl modifikován pomocí CRISPR/Cas9. Švédské úřady rozhodly, že se nejedná o GMO, a vědci z Univerzity v Umeå mohou rostliny pěstovat venku bez dalších povolení a bezpečnostních opatření. EU na to reagovala prosbou, aby členské státy zatím ještě s genově editovanými rostlinami vyčkaly na celoevropskou legislativu, nicméně za současné politické situace se nezdá, že by zrovna rozhodování o šlechtění rostlin bylo na seznamu priorit EU příliš vysoko.
Kromě jiného tato patová situace ukazuje, že regulace založená na použití konkrétních technik velmi rychle zastarává. Lze očekávat, že i v budoucnu budou vědci přicházet s novými metodami úprav a editování genomů, a budou tak stále vznikat situace, kdy nebude jasné, jakými zákony se řídit. Příkladem pro robustní regulaci by mohla být Kanada. V Kanadě se regulují všechny nové rostlinné odrůdy, které přinášejí nějakou novou vlastnost, nezávisle na použité technice.
Bude chleba levnější?
Oblíbená a velmi jednoduchá otázka dokáže mnoha vědcům nepříjemně zkomplikovat život a zejména kontakt s veřejností. Odpověď záleží na mnoha okolnostech. Již dnes je možné odhadnout několik možných scénářů, přičemž v některých z nich by chléb (potraviny) skutečně mohl být levnější, nebo by alespoň tolik nezdražil. Rostoucí populace spolu se změnami klimatu a nenávratnou degradací zemědělské půdy představují pro zemědělství a produkci potravin samy o sobě značná rizika. Šlechtitelé budou muset využívat veškeré dostupné techniky, aby s těmito tlaky drželi krok. Je velmi nebezpečné některé techniky jako transgenozi nebo genovou editaci předem zavrhnout. Právě tyto mocné techniky lze velmi dobře použít pro snížení ekologické stopy, kterou současné zemědělství nutně vytváří.7)
V prvním možném scénáři bude zachován stávající regulační systém založený na použité metodě šlechtění, který byl původně navržen pro transgenní rostliny. Plodiny vyšlechtěné novými technikami včetně CRISPR/Cas9 budou zahrnuty do kategorie GM organismů. Použití těchto technik pro šlechtění bude velmi drahé a mimo možnosti univerzit a veřejného sektoru. V EU budou tyto techniky používány pouze omezeně nebo vůbec. Použití se omezí na hlavní zemědělské komodity a několik málo vlastností. V dovážených komoditách zřejmě nepůjde plodiny získané moderními technikami detekovat. Je možné, že vznikne nějaký certifikační systém, který poskytne Evropanům pocit, že dovážené potraviny „GMO“ neobsahují. Nelze vyloučit ani možnost, že menší šlechtitelé a neziskový sektor budou cílenou mutagenezi používat, ale výsledné odrůdy budou vydávány za výsledek náhodné mutageneze. I v případě, že intenzivní regulace zamezí přímému použití technik genové editace při šlechtění, budou šlechtitelé využívat této technologie nepřímo. Editace genů pomůže vědcům rychleji popsat funkce jednotlivých genů a tato informace bude jistě použita i během klasického šlechtění.
Pokud však dojde k přehodnocení stávající legislativy směrem k systému, který bude klást větší důraz na vlastnosti plodin a menší důraz na použitou techniku, existuje naděje, že nové techniky šlechtění včetně editace genů budou široce používány nejenom ke šlechtění hlavních zemědělských komodit, ale i ovoce a zeleniny a plodin pěstovaných v tropických a subtropických podmínkách. V nejbližší době půjde zřejmě nejčastěji o zvýšení odolnosti k chorobám a případně o zlepšení užitných vlastností (chuť, vůně, obsahy vitaminů, alergenů a toxinů). Možná se dočkáme i genově editované biozeleniny.
Díky tomu, že nové metody cílené editace genů nezapadají do kategorií vymezených v osmdesátých letech, je možná dnes ta nejvhodnější chvíle pro nutnou změnu legislativy. Po zásadnějších změnách regulace nových technik šlechtění volají i environmentalistické organizace. Vědci a politici by se měli pokusit do debaty o budoucí regulaci šlechtitelských technik, respektive zemědělství jako celku, zatáhnout co nejširší veřejnost, protože dosavadní relativní neúspěch GMO spočíval mimo jiné v pocitu veřejnosti, že byla proti své vůli postavena před hotovou věc. Cílená editace genomu pomocí techniky CRISPR/Cas9 může být velmi důležitým nástrojem v rukou šlechtitelů, kteří se budou jistě lépe vyrovnávat s klimatickými změnami, úbytkem kvalitní zemědělské půdy a rostoucí populací, pokud nebudou mít svázané ruce.
Poznámky
1) CRISPR – Clustered regularly interspaced short palindromic repeats.
2) Viz také Vesmír 94, 288, 2015/5.
3) ZFN – zinc finger nucleases, nukleázy propojené s tzv. zinkovými prsty – proteiny, jejichž prostorové uspořádání je stabilizováno ionty zinku. Tyto „prsty“ rozpoznávají cílovou sekvenci DNA (typicky kombinace čtyř prstů rozpoznává sekvenci o délce 12 bází).
4) TALEN – Transcription activator-like effector nucleases, nukleázy využívající stejně jako ZNF pro cílení na konkrétní sekvenci DNA proteiny.
5) Viz článek Jaroslava Petra Když CRISPR přejde chuť , Vesmír 96, 550, 2017/10.
6) Viz závěrečnou zprávu dostupnou na http://ftp.jrc.es/EURdoc/JRC63971.pdf.
7) Viz také rozhovory s Marcem Van Montaguem (Vesmír 95, 430, 2016/7) a Johnem Pickettem (Vesmír 96, 484, 2017/9).
8) text
Ke stažení
 článek ve formátu PDF [339,73 kB]
článek ve formátu PDF [339,73 kB]
O autorovi
Tomáš Moravec