Retroviry v součinnosti i v souboji s buňkou
Poznávání funkce retrovirů prošlo pozoruhodným vývojem. Zahájeno bylo počátkem minulého století objevem dvou kuřecích virů, z nichž první způsoboval nádorovou změnu lymfocytů a druhý – po svém objeviteli nazvaný Rousův virus – vyvolával vznik sarkomů. Tyto nálezy, i když nepopiratelné, byly přijímány s rozpaky zvláště proto, že u savců obdobné viry nalezeny nebyly. Také virový původ těchto kuřecích nádorů byl zpochybňován a jejich původce byl označován všeobjímajícím názvem agens, ještě užívaným více než 30 let po objevu. Zvrat v poznání nádorových virů nastal v šedesátých letech, kdy H. M. Temin a H. Rubin vypracovali test na kvantitativní stanovení nádorotvorného působení viru v tkáňové kultuře. Test umožňoval spočítat počet dvůrků (fokusů) nádorově pozměněných fibroblastů. Tím otevřeli cestu ke klonování retrovirů a zároveň k poznání jejich genetiky. Závažnou otázkou zůstávala nesrovnalost v jejich životním cyklu. Ve virové částici nesou retroviry dvě kopie virové genomické RNA, avšak v infikované buňce se chovají jako přídatná genetická informace začleněná do genomu buňky.
 K těmto závěrům jsme dospěli na základě detailního studia krysí buněčné linie pozměněné Rousovým virem. Vlastní biochemický mechanizmus převodu virové RNA na provirovou DNA osvětlili později Temin a D. Baltimore, kteří nalezli ve virových částicích reverzní transkriptázu, enzym umožňující zpětný přepis RNA na DNA. Retroviry se tedy chovají obojživelně – ve virové částici je jejich genom přítomen jako RNA, zatímco v buňce se mění v DNA. Není překvapivé, že objev reverzní transkriptázy pronikavě změnil jak biotechnologie, tak náš pohled na evoluci.
K těmto závěrům jsme dospěli na základě detailního studia krysí buněčné linie pozměněné Rousovým virem. Vlastní biochemický mechanizmus převodu virové RNA na provirovou DNA osvětlili později Temin a D. Baltimore, kteří nalezli ve virových částicích reverzní transkriptázu, enzym umožňující zpětný přepis RNA na DNA. Retroviry se tedy chovají obojživelně – ve virové částici je jejich genom přítomen jako RNA, zatímco v buňce se mění v DNA. Není překvapivé, že objev reverzní transkriptázy pronikavě změnil jak biotechnologie, tak náš pohled na evoluci.
Z proviru virus
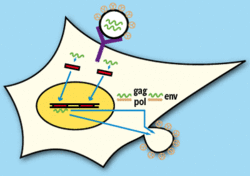
Jak probíhá životní cyklus retroviru (obrázek 1)? Virová částice, obsahující dvě virové genové RNA, je chráněna glykoproteinovou obálkou (env). Do buňky proniká tím, že se naváže na specifický buněčný receptor. Ještě v cytoplazmě se z virové částice uvolní reverzní transkriptáza, která zpětně přepíše každou virovou RNA na dvouvláknovou DNA. Po přechodu do jádra se takto vytvořené DNA začlení jako provirus do buněčného genomu a stanou se součástí genetické výbavy buňky.V dalších stupních infekce závisí životní cyklus viru na hostitelské buňce a jejích funkcích. Důležitý je přepis provirové DNA, která se stává součástí virové částice jako virová genomová RNA. Jiné přepisy jsou využívány k překladu virových proteinů. Týká se to například proteinu gag, jehož štěpy tvoří strukturu virové částice a reverzní transkriptázy. Glykoproteiny obálky vznikají ze sestřiženého přepisu proviru DNA. Všechny tyto složky vytvářejí virovou částici, která se z buněčné stěny uvolňuje pučením.
 Tento cyklus je sice znám, ale přece v něm zůstávají „bílá místa“, jako je sestavování virové částice. Z mnoha důvodů byl rozpitván až na úroveň role jednotlivých sekvencí nukleotidů. Přesto to nestačí, neboť retrovirové geny jsou kontrolovány i buněčným genomem.
Tento cyklus je sice znám, ale přece v něm zůstávají „bílá místa“, jako je sestavování virové částice. Z mnoha důvodů byl rozpitván až na úroveň role jednotlivých sekvencí nukleotidů. Přesto to nestačí, neboť retrovirové geny jsou kontrolovány i buněčným genomem.
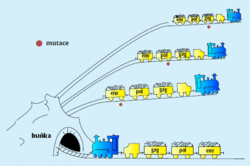
Retroviry můžeme rozdělit na jednoduché a složité (lentiviry). Jednoduchý retrovirus obsahuje pouze tři virové geny: gag, pol (kódující reverzní transkriptázu) a env (kódující virovou obálku). Takový retrovirus lze přirovnat k pomalu jedoucímu vláčku (obrázek 2), který zásluhou nízké rychlosti projede všemi zákruty buňky. Důležitým faktem je, že téměř každý potomek infikujícího viru má alespoň jednu mutaci v některém ze svých genů. Tato velká vnímavost k mutacím umožňuje velkou genetickou variabilitu retrovirů, tudíž vznik antigenních variant i kmenů rezistentních na protivirové léky.
Také složité retroviry (viz obrázek 3) jsou vybaveny geny gag, pol a env, ale navíc obsahují šest dalších genů, které fungují jako regulátory umožňující obměňovat buněčné pochody tak, aby vyhovovaly replikačnímu cyklu viru. Jeden z těchto genů (rev) zajišťuje přenos nesestřižených virových RNA z jádra do cytoplazmy, což je předpoklad pro tvorbu infekční částice. Složité retroviry lze tedy přirovnat k rychlovlaku, který úspěšně projíždí buněčnými zákruty, poněvadž je vybaven informačními tykadly.
Buňky přístupné a odmítavé k viru
Pro podmínky dovolující úspěšnou infekci buňky virem se dnes používá termín permisivita, tedy (v daném případě) přístupnost. Určovány jsou buňkou, například specifickými receptory na jejím povrchu. Buněčných faktorů ovlivňujících množení viru je však více. Zřetelně vypluly na povrch u savčích buněk nádorově transformovaných ptačím virem Rousova sarkomu. Tyto buňky v sobě mají začleněný provirus, avšak neprodukují infekční virus.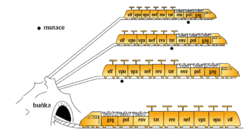 I v savčí buňce nesoucí provirus lze ale navodit tvorbu infekčního viru, jestliže ji necháme splynout s kuřecí buňkou respektive fibroblastem. Tak vznikne mnohojaderný útvar, pro který už tvorba infekčního viru nepředstavuje problém. Savčí transformovaná buňka se splynutím (fúzí) s kuřecí buňkou obohatila o nové buněčné faktory. Zdá se, že se buňka, která má provirus, navzájem doplňuje s buňkou, která má aparát pro tvorbu viru. Není ovšem vyloučeno, že buňka s aparátem pro tvorbu viru vypíná v buňce s provirem represory. Tyto otázky by bylo možno osvětlit sledováním potomstva buněk vzniklých fúzí, jenže ty žádné potomstvo nemají. Byly však již vyvinuty techniky, které dovolují přenést část genetické výbavy z jednoho druhu buněk do jiného, aniž se životnost vzniklých částečných hybridů poruší. Tyto techniky nyní zavádíme.
I v savčí buňce nesoucí provirus lze ale navodit tvorbu infekčního viru, jestliže ji necháme splynout s kuřecí buňkou respektive fibroblastem. Tak vznikne mnohojaderný útvar, pro který už tvorba infekčního viru nepředstavuje problém. Savčí transformovaná buňka se splynutím (fúzí) s kuřecí buňkou obohatila o nové buněčné faktory. Zdá se, že se buňka, která má provirus, navzájem doplňuje s buňkou, která má aparát pro tvorbu viru. Není ovšem vyloučeno, že buňka s aparátem pro tvorbu viru vypíná v buňce s provirem represory. Tyto otázky by bylo možno osvětlit sledováním potomstva buněk vzniklých fúzí, jenže ty žádné potomstvo nemají. Byly však již vyvinuty techniky, které dovolují přenést část genetické výbavy z jednoho druhu buněk do jiného, aniž se životnost vzniklých částečných hybridů poruší. Tyto techniky nyní zavádíme.
O krok dále pokročila studia nepřístupnosti u HIV, což je lidský virus, ale k prostudování rozsahu a charakteru jeho účinků by bylo velkou výhodou, kdyby se podařilo přenést tento virus na geneticky dobře definovaná laboratorní zvířata, jako jsou myši. Problém je v tom, že myš je k takové infekci necitlivá. Nízkou hladinu citlivosti lze navodit vnesením dvou lidských genů nutných pro vstup a replikaci HIV. Úplnou přístupnost k tomuto viru však lze získat opět jen splynutím infikované myší buňky s lidskou. Nedávno se zjistilo, že stačí vnést do myšího genomu pouze lidský chromozom 2 nebo 12, které zřejmě oba obsahují lidské geny vyžadované pro produkci HIV v myší buňce. Víme, že HIV je povzbuzován nejméně 10 buněčnými geny. Mezitím, co rukopis čekal na zařazení do tisku, se zvýšil počet buněčných bílkovin vyžadovaných pro produkci HIV na 273. Druhou stranou mince jsou buněčné geny, které aktivně potlačují retroviry, a tedy zabrání infekci buňky.
Gen bránící mezidruhovému přenosu infekce
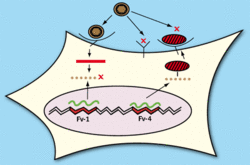 Mezi první takové geny patří endogenní retroviry. Jestliže retrovirus zasáhne zárodečnou buňku a provirus se začlení do jejího genomu, stává se novou genetickou informací, která se dědí podle klasických zákonů dědičnosti. V řadě případů takový provirus syntetizuje i své virové produkty. Jestliže je to obálkový glykoprotein (obrázek 4), váže se na receptory buňky, které vlastně vysytí, a tím zabrání vstupu viru do buňky neboli zamezí nové infekci. Tento mechanizmus – interference – je velmi účinný u jednoduchých retrovirů. Známe však případy, kdy u kuřat a myší byla navozena rezistence s využitím zmíněného mechanizmu i proti vysoce účinným retrovirům.
Mezi první takové geny patří endogenní retroviry. Jestliže retrovirus zasáhne zárodečnou buňku a provirus se začlení do jejího genomu, stává se novou genetickou informací, která se dědí podle klasických zákonů dědičnosti. V řadě případů takový provirus syntetizuje i své virové produkty. Jestliže je to obálkový glykoprotein (obrázek 4), váže se na receptory buňky, které vlastně vysytí, a tím zabrání vstupu viru do buňky neboli zamezí nové infekci. Tento mechanizmus – interference – je velmi účinný u jednoduchých retrovirů. Známe však případy, kdy u kuřat a myší byla navozena rezistence s využitím zmíněného mechanizmu i proti vysoce účinným retrovirům.
Frank Lilly již v sedmdesátých letech 20. století odkryl další typ obrany proti retrovirům. U myší je přítomen úsek chromozomu (lokus) Fv-1, který je trvale osídlen částečně modifikovaným endogenním retrovirem. U myší jsou známy dvě hlavní alely, z nichž každá určuje citlivost k určité skupině leukemických virů. Příčinou necitlivosti k infekci je střetnutí virového proteinu gag s Fv-1, při němž je protein zničen a infekce zastavena. Lokusy obdobné Fv-1 se podařilo zjistit i u jiných druhů savců včetně primátů. Proto nás nepřekvapí, že se badatelé velmi snažili najít obdobný faktor u člověka.
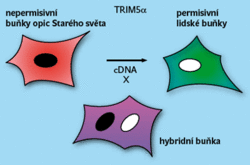
Při hledání jim posloužil fakt, že opičí buňky jsou nepřístupné pro HIV (obrázek 5). Značená opičí „celogenomová“ DNA byla vnesena do přístupných lidských buněk, z jejich populace se vyselektovaly nepřístupné buňky, a z nich byl izolován gen TRIM5α, který je za to odpovědný. Jde o gen kódující komplexní produkt, jehož jedna složka je velmi účinná. Reaguje (podobně jako Fv-1) s virem vstupujícím do buňky, a to v oblasti proteinu gag.
Poněvadž tento virový protein je potřeba pro reverzní transkripci, celý proces se naruší, a tím se zpřetrhá životní cyklus viru. Gen TRIM5α působí specificky na jednotlivé druhy retrovirů. Například lidský gen nechrání lidské buňky před infekcí HIV a stejně ani opičí gen nechrání opice před infekcí jejími vlastními opičími retroviry. Situace se ovšem prudce změní, když se do lidské buňky vloží opičí gen. Taková buňka je pro HIV nepřístupná. Tyto a další údaje naznačují, že se gen TRIM5α vyvinul jako bariéra bránící mezidruhovému přenosu retrovirů.
Další gen „zavírající vrátka“ před vetřelcem
 V průběhu posledních let byl poznán další gen navozující nepřístupnost pro virovou infekci. Tento gen APOBEC3G 1) je součástí rodiny genů měnících cytidin na uridin, což samozřejmě vede k mutacím. 2) Zmíněný gen kóduje enzym, který se „zamontuje“ do vznikající retrovirové částice, takže se váže na komplex virových proteinů gag a virové RNA. Při infekci nové buňky se uvolní a způsobí v průběhu reverzní transkripce mohutnou mutagenezi, která virovou DNA zničí. Složité retroviry ale vyvinuly zvláštní strategii, která jim umožňuje působení zmíněného genu odolávat. Strategie je založena na přídatném virovém genu Vif, 3) který hraje důležitou roli v přenosech HIV. Protein Vif se naváže na protein APOBEC3G a odbourá ho, do virové částice ho vůbec nepustí.
V průběhu posledních let byl poznán další gen navozující nepřístupnost pro virovou infekci. Tento gen APOBEC3G 1) je součástí rodiny genů měnících cytidin na uridin, což samozřejmě vede k mutacím. 2) Zmíněný gen kóduje enzym, který se „zamontuje“ do vznikající retrovirové částice, takže se váže na komplex virových proteinů gag a virové RNA. Při infekci nové buňky se uvolní a způsobí v průběhu reverzní transkripce mohutnou mutagenezi, která virovou DNA zničí. Složité retroviry ale vyvinuly zvláštní strategii, která jim umožňuje působení zmíněného genu odolávat. Strategie je založena na přídatném virovém genu Vif, 3) který hraje důležitou roli v přenosech HIV. Protein Vif se naváže na protein APOBEC3G a odbourá ho, do virové částice ho vůbec nepustí.
Tato elegantní hra mezi virem a buněčným faktorem nepřístupnosti bude asi složitější. 4) Podstatné je, že APOBEC3G opět vykazuje vysoký stupeň druhové specifičnosti, takže ten lidský není účinný proti HIV s přídatným virovým genem a podobně ten opičí není účinný proti infekci opičím virem imunodeficience s přídatným virovým genem. Situace se změní, když sledujeme mezidruhové vztahy: v lidských buňkách tento opičí gen navodí nepřístupnost pro HIV. 5)
Ze všech těchto příkladů vyplývá, že k tomu, aby retroviry získaly schopnost účinně se množit v hostiteli odlišného druhu, musely překonat řadu buněčných bariér a vytvořit i nové funkce. Nakonec se to některým podařilo. Mezi ně patří HIV, který je nepochybně opičího původu a byl několikrát nezávisle přenesen do lidské populace. Známe i úspěšný přenos retrovirů mezi savci a ptáky, který vedl k vzniku viru ptačí retikuloendoteliózy.
Přenos retrovirů na cizí druhy včetně člověka tedy zůstává reálným nebezpečím. Dotýká se i jiných závažných virů, jako jsou zvířecí kmeny viru chřipky (ty se sice v lidských buňkách běžně nemnoží, ale co kdyby z nich vznikly kmeny, které by se množily a způsobily pandemii). Podle nových studií hraje významnou roli virová polymeráza, která při mezidruhových přenosech prochází charakteristickými mutačními událostmi.
Čeká se na pokroky genové terapie
Jak nás poučil příklad HIV, retroviry po přenosu na hostitele jiného druhu (v tomto případě na člověka) jsou jen slabě infekční. Nejúčinnější cestu jejich dalšího přenosu zajišťuje přímý kontakt infikované buňky s buňkou zdravou. Proto všechny pokusy s přenosem tkání cizího druhu na člověka musí být důkladně kontrolovány, abychom předešli přenosu nového retroviru do lidské populace. Tento problém je akutní v případě transplantace prasečích tkání na člověka, neboť tyto tkáně obsahují i retroviry, které se mohou množit v lidských buňkách.Jestliže se podaří určit podmínky umožňující infekci buňky a najít faktory bránící vstupu infekce, může to mít neobyčejný význam jak pro vytvoření úplnějšího obrazu životního cyklu viru, tak pro definování molekul, které by bylo možno využít v protivirové terapii. V úvahu přicházejí zvláště vhodné varianty dvou zmíněných genů, které mají schopnost potlačit infekci HIV. Použití těchto genů k léčebným účelům vyžaduje jejich účinné a bezpečné vnášení do buněk organizmu. Říká se tomu též genová terapie. Pro vnášení genů se s výhodou využívají upravené retroviry, ale i jejich účinnost, a hlavně bezpečnost je dosud omezená. Terapeutické využití genů zavírajících vrátka před infekcí dosud čeká na pokroky genové terapie.
Poznámky
Ke stažení
 článek v souboru pdf [389,82 kB]
článek v souboru pdf [389,82 kB]















