Kdy je voda nejtěžší a kdy nejlehčí
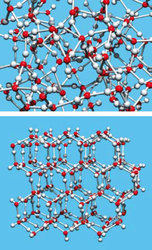
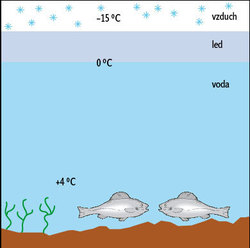
Voda je natolik spjata s naším životem, že bývá považována za typickou kapalinu. Ve skutečnosti je ale tak málo typická, jak jen si lze představit. V důsledku unikátních vlastností vytvářených vodíkových vazeb (obrázek 1) se voda chová divně. O nejznámější podivnosti spojené s vodou jsme se učili ve škole: kapři v našich rybnících přežívají, neboť voda má maximální hustotu při teplotě 4 °C a hustota kapalné vody je vyšší nežli hustota ledu. Můžete se o tom přesvědčit doma v kuchyni. Ve velkém hrnci s vodou a kusy ledu bude u hladiny teplota lehce nad nulou, u dna 4 °C (obrázek 2). Zvyšovat se začne, až když se všechen led rozpustí.
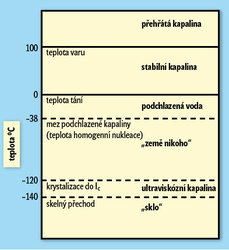
 Při teplotě 4 °C se voda rozpíná, ať už ji zahříváme (což je obvyklé), nebo ochlazujeme (což je neobvyklé, anomální). Roztahuje se ale kapalná voda při snižování teploty neustále, nebo se její hustota při určité teplotě začne zase zvyšovat? Při ochlazení na nulovou teplotu za rovnováhy přechází voda v led. Ke krystalizaci vody ovšem dochází na různých defektech, jako jsou například prachové částice. Mimořádně čistou vodu můžeme proto ochladit i na nižší teploty: ani za amatérských podmínek není těžké destilovanou vodu zchladit přibližně na –15 °C. Voda se nachází ve stavu podchlazené kapaliny a malý podnět pak vede k rychlé krystalizaci. Podchlazenou kapalinu o teplotě nižší než –38 °C se nám z vody (za normálního tlaku) připravit nepodaří. Pod touto teplotou (teplotou homogenní nukleace) vytvoříme vždy led anebo, při rychlém zchlazení, nekrystalickou pevnou vodu, „sklo“ (obrázek 3).
Při teplotě 4 °C se voda rozpíná, ať už ji zahříváme (což je obvyklé), nebo ochlazujeme (což je neobvyklé, anomální). Roztahuje se ale kapalná voda při snižování teploty neustále, nebo se její hustota při určité teplotě začne zase zvyšovat? Při ochlazení na nulovou teplotu za rovnováhy přechází voda v led. Ke krystalizaci vody ovšem dochází na různých defektech, jako jsou například prachové částice. Mimořádně čistou vodu můžeme proto ochladit i na nižší teploty: ani za amatérských podmínek není těžké destilovanou vodu zchladit přibližně na –15 °C. Voda se nachází ve stavu podchlazené kapaliny a malý podnět pak vede k rychlé krystalizaci. Podchlazenou kapalinu o teplotě nižší než –38 °C se nám z vody (za normálního tlaku) připravit nepodaří. Pod touto teplotou (teplotou homogenní nukleace) vytvoříme vždy led anebo, při rychlém zchlazení, nekrystalickou pevnou vodu, „sklo“ (obrázek 3).
 I podchlazená voda se chová anomálně, tedy při ochlazování se roztahuje až do bodu homogenní nukleace. Voda se dá podchladit ještě hlouběji, pokud z ní uděláme malé kapičky; mají-li mikrometrové rozměry, dají se podchladit v kapalném stavu lehce pod –40 °C. Ještě chytřejší nápad je umístit vodu do pórů o nanometrových rozměrech. Nedávno byla takto změřena hustota vody až do teploty –110 °C. Voda, přesněji těžká voda (D2O), byla umístěna do pórů o průměru 1,5 nm. Do takových skulinek se vejde jen několik desítek molekul vody. Hustota se pak dá změřit pomocí chytře provedené neutronové difrakce (kvůli které používali těžkou, a nikoliv normální vodu). Voda v nanopórech měla maximální hustotu při stejné teplotě jako běžná těžká voda. Hustotu kapalné vody je takto možné měřit i pro teploty, při kterých už makroskopická voda zamrzne. Ukázalo se, že se podchlazená voda rozpíná pouze do teploty –63 °C, a poté se začíná zase smrskávat. Voda tak má nejen hustotní maximum, ale i hustotní minimum (Proc. Nat. Acad. Sci. 104, 9570, 2007).
I podchlazená voda se chová anomálně, tedy při ochlazování se roztahuje až do bodu homogenní nukleace. Voda se dá podchladit ještě hlouběji, pokud z ní uděláme malé kapičky; mají-li mikrometrové rozměry, dají se podchladit v kapalném stavu lehce pod –40 °C. Ještě chytřejší nápad je umístit vodu do pórů o nanometrových rozměrech. Nedávno byla takto změřena hustota vody až do teploty –110 °C. Voda, přesněji těžká voda (D2O), byla umístěna do pórů o průměru 1,5 nm. Do takových skulinek se vejde jen několik desítek molekul vody. Hustota se pak dá změřit pomocí chytře provedené neutronové difrakce (kvůli které používali těžkou, a nikoliv normální vodu). Voda v nanopórech měla maximální hustotu při stejné teplotě jako běžná těžká voda. Hustotu kapalné vody je takto možné měřit i pro teploty, při kterých už makroskopická voda zamrzne. Ukázalo se, že se podchlazená voda rozpíná pouze do teploty –63 °C, a poté se začíná zase smrskávat. Voda tak má nejen hustotní maximum, ale i hustotní minimum (Proc. Nat. Acad. Sci. 104, 9570, 2007).
 Voda v nanopórech není samozřejmě to samé co voda v hrnci. Nicméně závislost hus toty těchto nanokapiček vody na teplotě je v pozoruhodném souladu s předpovědí získanou pro podchlazenou vodu metodami počítačových simulací. Na počítači se voda podchladí snadno ze stejných důvodů, z jakých je to možné u vody v nanopórech; „počítačová voda“ má totiž také jen několik stovek atomů a rovněž dochází k velmi rychlému chlazení. Je tedy možné, že se voda v nanopórech od makroskopické vody příliš neliší. Chování vody v pórech je ale zajímavé samo o sobě, například v biologii. Řada organizmů je schopna přežít i velmi nízké teploty (viz Vesmír 75, 669, 1996/12) a roli může hrát i nízká ochota vody v pórech přeměňovat se v led.
Voda v nanopórech není samozřejmě to samé co voda v hrnci. Nicméně závislost hus toty těchto nanokapiček vody na teplotě je v pozoruhodném souladu s předpovědí získanou pro podchlazenou vodu metodami počítačových simulací. Na počítači se voda podchladí snadno ze stejných důvodů, z jakých je to možné u vody v nanopórech; „počítačová voda“ má totiž také jen několik stovek atomů a rovněž dochází k velmi rychlému chlazení. Je tedy možné, že se voda v nanopórech od makroskopické vody příliš neliší. Chování vody v pórech je ale zajímavé samo o sobě, například v biologii. Řada organizmů je schopna přežít i velmi nízké teploty (viz Vesmír 75, 669, 1996/12) a roli může hrát i nízká ochota vody v pórech přeměňovat se v led.
Ke stažení
 článek v souboru pdf [400,34 kB]
článek v souboru pdf [400,34 kB]
O autorovi
Petr Slavíček
















