Molekulární pohled do světa klíšťat
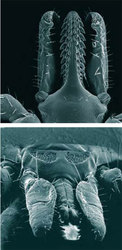 Klíšťata škodí svému hostiteli ztrátou krve, ale zejména jako přenašeči širokého spektra patogenů zahrnujících viry, bakterie a prvoky. Po komárech jsou klíšťata nejnebezpečnějšími krevsajícími přenašeči lidských onemocnění. Ekonomický i sociální dopad klíš ťat masivně sajících na hospodářských zvířatech je důležitý zejména v rozvojových zemích. V Evropě má největší význam klíště obecné (Ixodes ricinus), jehož vývojová stadia (larva, nymfa, dospělec) sají na třech, zpravidla různých hostitelích. Proti vážnému riziku virové klíšťové encefalitidy (TBE) je možné se bránit účinným očkováním. Naproti tomu humánní vakcína proti dalšímu nebezpečnému patogenu, spirochétám lymské boreliózy (Borrelia burgdorferi sensu lato), zatím není komerčně dostupná a hrozba nákazy zejména od snadno přehlédnutelných drobných nymf je veliká (viz rovněž Vesmír 83, 268, 2004/5 a 81, 573, 2002/10).
Klíšťata škodí svému hostiteli ztrátou krve, ale zejména jako přenašeči širokého spektra patogenů zahrnujících viry, bakterie a prvoky. Po komárech jsou klíšťata nejnebezpečnějšími krevsajícími přenašeči lidských onemocnění. Ekonomický i sociální dopad klíš ťat masivně sajících na hospodářských zvířatech je důležitý zejména v rozvojových zemích. V Evropě má největší význam klíště obecné (Ixodes ricinus), jehož vývojová stadia (larva, nymfa, dospělec) sají na třech, zpravidla různých hostitelích. Proti vážnému riziku virové klíšťové encefalitidy (TBE) je možné se bránit účinným očkováním. Naproti tomu humánní vakcína proti dalšímu nebezpečnému patogenu, spirochétám lymské boreliózy (Borrelia burgdorferi sensu lato), zatím není komerčně dostupná a hrozba nákazy zejména od snadno přehlédnutelných drobných nymf je veliká (viz rovněž Vesmír 83, 268, 2004/5 a 81, 573, 2002/10).
Vzájemné vztahy v trojúhelníku klíště-hostitel-patogen se doposud studovaly zejména po stránce biologické a medicínské. Zkoumání na molekulární úrovni poměrně dlouho zaostávalo a bylo omezeno množstvím dostupného materiálu a složitým vývojovým cyklem parazitů. Prudký rozvoj molekulárněbiologických metod, a zejména přístup reverzní genetiky (čili od genů k jejich funkci) v posledním desetiletí tento hendikep odstraňují. Otevírá se tak možnost nahlédnout do fascinujícího světa nových molekul formovaných evolucí v jedinečné nástroje parazitického života klíšťat.
Genom, sialom, mialom…
 Očekává se, že r. 2008 bude dokončeno sekvencování genomu klíštěte Ixodes scapularis, amerického druhu blízce příbuzného evropskému I. ricinus. Projekt je náročný kvůli neočekávané velikosti genomu, ale přinese zásadní obrat v oboru. Hlavní přínos se bude týkat analýzy interakcí klíště-hostitel a klíštěpatogen, jejichž praktickým výstupem by měl být vývoj vakcín a identifikace nových farmakologických látek z klíšťat. Doplňující výzkum je zaměřen na transkriptom a proteom klíčových tkání klíštěte. Vzájemných vztahů klíštěhostitel-patogen se účastní zejména „sialom“ slinných žláz a „mialom“ střeva.
Očekává se, že r. 2008 bude dokončeno sekvencování genomu klíštěte Ixodes scapularis, amerického druhu blízce příbuzného evropskému I. ricinus. Projekt je náročný kvůli neočekávané velikosti genomu, ale přinese zásadní obrat v oboru. Hlavní přínos se bude týkat analýzy interakcí klíště-hostitel a klíštěpatogen, jejichž praktickým výstupem by měl být vývoj vakcín a identifikace nových farmakologických látek z klíšťat. Doplňující výzkum je zaměřen na transkriptom a proteom klíčových tkání klíštěte. Vzájemných vztahů klíštěhostitel-patogen se účastní zejména „sialom“ slinných žláz a „mialom“ střeva.
 Další zásadní pomoc představují již dokončené nebo probíhající projekty sekvencování genomu několika patogenů přenášených klíšťaty. Mezi nové techniky funkční genomiky, která v současné době představuje nezastupitelný nástroj při výzkumu klíšťat, patří RNA interference (RNAi, viz Vesmír 86, 110, 2007/2 a 84, 198, 2005/4). Umožňuje potlačit expresi cílových genů a přesně analyzovat jejich funkci. Tímto způsobem se například nedávno podařilo charakterizovat receptor TROSPA ve střevě klíštěte, který je nutný pro infekci a přenos borelie.
Další zásadní pomoc představují již dokončené nebo probíhající projekty sekvencování genomu několika patogenů přenášených klíšťaty. Mezi nové techniky funkční genomiky, která v současné době představuje nezastupitelný nástroj při výzkumu klíšťat, patří RNA interference (RNAi, viz Vesmír 86, 110, 2007/2 a 84, 198, 2005/4). Umožňuje potlačit expresi cílových genů a přesně analyzovat jejich funkci. Tímto způsobem se například nedávno podařilo charakterizovat receptor TROSPA ve střevě klíštěte, který je nutný pro infekci a přenos borelie.
Klíště ovlivňuje vnitřní prostředí hostitele
Úspěch klíštěte jako parazita vychází z jeho jedinečné fyziologie. Klíčovou úlohu v první linii vztahu s hostitelem plní specializované slinné žlázy. Proniknutí sacího aparátu do hostitelovy kůže a jeho fixování v ráně proteinovým tmelem by mělo vyvolat silnou hemostatickou, zánětlivou a imunitní reakci. Tato komplexní odmítavá odpověď hostitele je ale překonána baterií bioaktivních molekul, které klíště vylučuje ve slinách do rány. Jde o proteiny a lipidické látky, jež mají protisrážlivé, protizánětlivé a imunoregulační účinky. Jejich tvorba výrazně vzrůstá během sání. Podívejme se na příklady této chemické komunikace, již evoluce přivedla k dokonalosti a která rozmanitým způsobem působí na mnoha frontách.- Potlačení hemostáze je zaměřeno na tři typy dějů: krevní srážlivost, regulaci krevních destiček a zúžení cév (vazokonstrikci). Mezi regulační proteiny ze slin patří zejména inhibitory trombinu, faktoru X a TF, tj. proteáz, které řídí proteolytickou koagulační kaskádu vedoucí k tvorbě fibrinu. Zároveň klíšťata produkují proteázy a proteázové inhibitory, které urychlují fibrinolýzu (rozpouštění fibrinové sraženiny). Přichycení a shlukování krevních destiček je potlačováno pomocí slinného enzymu apyrázy a dále sadou specifických proteinů, které blokují interakce krevních destiček vyvolané kolagenem nebo fibrinogenem. Mezi vazodilatační molekuly vylučované klíštětem patří prostacyklin a prostaglandin E2. Zvyšují průtok krve, brání uzavření rány, a tím usnadňují přísun krve ke klíštěti.
- Protizánětlivé působení slin potlačuje zejména funkce neutrofilů a brání jim v přesunu do místa zánětu. Molekuly z klíštěcích slin také zastavují na několika úrovních kaskádu komplementu a produkci vazebných proteinů, které vychytávají histamin a serotonin, látky, jež se podílejí na vzniku zánětu.
- Imunitní reakce hostitele je potlačována pomocí složité regulace exprese a aktivity cytokinů (interleukinů, interferonů); řada slinných proteinů se váže přímo na cytokiny nebo jejich receptory. Mezi výsledné efekty patří utlumení buněčného dělení lymfocytů T a imunitní reakce typu Th1 i potlačení funkce lymfocytů B a NK-buněk. Potlačení imunitních reakcí hostitele vytváří zároveň příznivé prostředí pro přenos patogenů.
Krev hostitele jako základní surovina
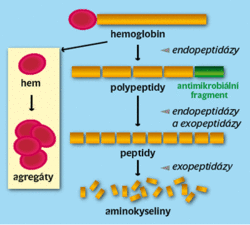
 Krev je bohatý potravní zdroj pro vývoj a rozmnožování klíšťat. Z hlediska výživy je nejdůležitější hemoglobin. Je tráven v lysozomech uvnitř trávicích buněk střeva klíštěte, kde se na jeho degradaci podílí sada proteolytických enzymů katepsinového typu. Jejich nedávná analýza prokázala, že tvoří evolučně konzervovanou kaskádu podobnou proteolytické dráze, kterou využívá parazitická motolice krevnička rodu Schistosoma (původce bilharziózy) a která je odlišná od trávicího arzenálu komárů a dalšího krevsajícího hmyzu.
Krev je bohatý potravní zdroj pro vývoj a rozmnožování klíšťat. Z hlediska výživy je nejdůležitější hemoglobin. Je tráven v lysozomech uvnitř trávicích buněk střeva klíštěte, kde se na jeho degradaci podílí sada proteolytických enzymů katepsinového typu. Jejich nedávná analýza prokázala, že tvoří evolučně konzervovanou kaskádu podobnou proteolytické dráze, kterou využívá parazitická motolice krevnička rodu Schistosoma (původce bilharziózy) a která je odlišná od trávicího arzenálu komárů a dalšího krevsajícího hmyzu.
Při štěpení hemoglobinu na peptidy až aminokyseliny vznikají fragmenty s antimikrobiální aktivitou. Tu mají také defenziny produkované střevem klíštěte a samotné trávicí proteázy. Dohromady vzniká důmyslný obranný systém, důležitý pro imunologii klíštěte. Při rozkladu hemoglobinu se ale také uvolňuje hem v toxickém množství a způsobuje oxidativní stres. Klíště jej detoxikuje tak, že vytváří hemové agregáty a uskladní je uvnitř specializovaných organel – hemozomů. Hem hostitele je dostupný v dostatečném množství, a proto ztratilo klíště schopnost jeho biosyntézy. Při tvorbě vlastních hemoproteinů pouze recykluje molekuly hemu z krve hostitele.
Jak je patogen přenášen klíštětem
Schopnost parazitů přenášet různé patogeny je závislá do značné míry na tom, jak daný mikroorganizmus dokáže čelit obranným imunitním reakcím parazita a organizovat svůj přenos z parazita do výsledného hostitele. Tato mimořádně atraktivní tematika je dnes asi nejlépe prozkoumána u komárů rodu Anopheles, vektoru malarických plasmodií. U klíšťat se k této úrovni poznání přibližujeme analýzou interakce klíště-borelie v důsledku zájmu řešit celosvětový problém lymské boreliózy.Klíště rodu Ixodes se může infikovat spirochétami Borrelia burgdorferi již jako larva. Spirochéty se uchytí na povrchu střevní tkáně (povrchový protein OspA se váže na receptor TROSPA), kde přečkají až do nymfálního vývojového stadia klíštěte. Během sání nymfy na hostiteli se začnou borelie ve střevě množit a přestanou vytvářet OspA, čímž se uvolní ze své vazby na receptor. Průnik střevní tkání klíštěte si borelie usnadňují pomocí proteázy plazminu, kterou si „vypůjčí“ z hostitelské krve. Následuje transport tělem klíštěte a průnik z hemolymfy do slinných žláz, během něhož borelie na svém povrchu syntetizují protein OspC. Na něj se v slinných žlázách naváže protein SALP15 produkovaný klíštětem, který inhibuje aktivaci pomocných T-lymfocytů, a tím potlačí jak přirozenou, tak adaptivní imunitní odpověď hostitele proti přenášeným spirochétám. SALP15 se tak podílí na přenosu patogenů aktivovaném slinami, na který je zaměřena pozornost při vývoji vakcinačních strategií.
SLOVNÍČEK
B-lymfocyty – buňky imunitního systému zajišťující tvorbu protilátekexprese genu – intenzita uplatnění genu, míra fenotypového projevu genu
hemostáze – rovnováha krevního prostředí a správné, vzájemně provázané působení všech jeho složek
komplement – sérové proteiny, které se mohou navázat na cizorodé částice a sérií kaskádovitě uspořádaných reakcí přispět k jejich odstranění
neutrofily – buňky „první obranné linie“; pohlcují a usmrcují většinu infekčních mikroorganizmů; uplatňují se jako důležité regulační složky zánětlivých dějů
nk-buňky – přirození zabíječi (natural killers), buňky, které vyhledávají a zabíjejí
virově infikované i některé nádorové buňky imunitní reakce Th1 – buněčná imunitní odpověď vázaná na T-lymfocyty směřující např. proti vnitrobuněčným patogenům
T-lymfocyty – buňky imunitního systému odpovědné za vývoj adaptivní imunitní odpovědi a za specifickou buněčně zprostředkovanou imunitu
ODKAZY NA DATABÁZE, VÝZKUMNÉ PROJEKTY A DALŠÍ INFORMACE
- www.icttd.nl – integrované konsorcium pro klíšťata a klíšťaty přenášené nemoci ( icTTD); informace o taxonomii a rozšíření klíšťat, katalog přenášených patogenů.
- www.entm.purdue.edu/igp – Genomový projekt Ixodes scapularis (iGP).
- www.vectorbase.org/index.php – vectorBase, informace o vektorech lidských patogenů a sekvenačních projektech.
- Hovius J. W. R. et al. (PloS medicine 5, 43, 2008; doi: 10.1371/journal.pmed.0050043), valen zue la J. G. (Parasitology 129, 83, 2004) – Analýza a farmakologie molekul ze slin klíšťat.
- www.szu.cz, www.chmi.cz/meteo/ok/klistata.html – Aktuální informace o aktivitě klíšťat na území čR a přenášených nemocech.
– UŽITEČNÉ MOLEKULY VE SLINÁCH KLÍŠŤAT
Sliny klíšťat obsahují koktejl účinných biochemikálií s protisrážlivou a protizánětlivou aktivitou, s imunosupresivními a antiproliferačními účinky. Představují cenný zdroj nových molekul s potenciální aplikací ve farmakologii. Jejich objevování podstatně urychlí genomická a proteomická analýza, podle které lze předpokládat stovky účinných látek. v budoucnu mohou doplnit omezený počet léčiv pro kardiovaskulární nebo nádorová onemocnění, a navázat tak na hirudin, léčivo pocházející z pijavky lékařské (Hirudo medicinalis) a využívané k rozpouštění krevních sraženin.VAKCÍNY PROTI KLÍŠŤATŮM – INTELIGENTNÍ OBRANA PROTI PARAZITOVI A PŘENOSU PATOGENŮ
Podrobná znalost molekulární podstaty důležitých dějů ve fyziologii klíštěte slibuje odhalení „Achillovy paty“, na kterou je možné zamířit účinnými prostředky, jako je vakcinace. kromě vakcinace proti jednotlivým patogenům se stává trendem vývoj „protiklíštěcí“ vakcíny, která naruší sání klíštěte na hostiteli, a tím zabrání přenosu patogenů. Tato strategie se zaměřila na dva typy potenciálních antigenů: 1. exponované antigeny jsou molekuly produkované slinnými žlázami klíštěte, které během sání přijdou do styku s imunitním systémem hostitele. Příkladem slibného antigenu je „cementový“ protein, upevňující hypostom klíštěte v místě sání. 2. skryté antigeny jsou molekuly klíštěte, se kterými se hostitel přímo nesetká, např. komponenty trávicího systému. nasátím specifických protilátek v krvi vakcinovaného hostitele se zablokuje funkce cílového proteinu a naruší fyziologie klíštěte. zatím jediná komerčně dostupná „protiklíštěcí“ vakcína je založena právě na tomto principu.Ke stažení
 článek ve formátu pdf [582,53 kB]
článek ve formátu pdf [582,53 kB]

























