Nitrobuněčné rozpoznávání bakterií
Od poznání k uvědomění, že poznáváme, je ještě hezký kousek cesty.
Thomas Mann, Josef a bratří jeho
Jak vznikla imunita? Stále složitější a objemnější těla mnohobuněčných organizmů poskytovala bakteriím a virům vhodné prostředí i dostatek živin. Tak se vyvinuly imunitní mechanizmy, které začaly vstupu destruktivních mikroorganizmů bránit. Základnou obranného systému se staly specializované molekuly přirozené (nespecifické) imunity.
Předpokládá se, že se prototypy přirozené imunity musely objevit dřív, než se oddělily říše prokaryont (s buňkami, které nebyly vybaveny jádrem) a eukaryont (s jadernými buňkami). Nevíme, co vznik eukaryontních organizmů vyvolalo, ani kdy se to stalo, podle odhadu zhruba před 2,7 miliardy let. Víme ale, že před 600 miliony let již žili na Zemi mnohobuněční prvoústí živočichové vybavení přirozenou imunitou. Dokonce se kmeny prvoústých vzájemně odlišily nejen svými charakteristickými morfologickými znaky, ale i typickými strategiemi přirozené imunity, pro něž se jim vytvořily specializované tkáně a buňky, které byly schopny různých obranných reakcí.
Nové obranné molekuly, buňky a tkáně
Novinky v obraně vnitřního prostředí se začaly postupně objevovat až u druhoústých: ostnokožců a strunatců. Nejprve to byly ojedinělé buňky, které lze přirovnat k lymfocytům obratlovců. V nich byly poprvé produkovány obranné molekuly z nadrodiny imunoglobulinů. Teprve na evolučním stupni paryb se ale dotvořily složitější mechanizmy obrany, které se staly součástí imunity získané (adaptivní, specifické). Tehdy se vyvinuly lymfatické tkáně a orgány i typy buněk specializovaných na obranu. Ty v organizmu odhalí vše „cizí“, získanou imunogenní informaci předají dál specializovaným klonům imunitních buněk, které se imunitní odpovědi účastní ve formě rozpoznávacích (vazebných) molekul na buněčných membránách nebo jako volné molekuly zvané protilátky. Projevy evolučně nové adaptivní imunity jsou tak nápadné, že byly hlavní náplní imunologie 20. století.Paradox získané imunity
Přesto zůstával jeden problém nejasný. Získaná imunita není tak pohotová, aby bezprostředně poté, co vysoce virulentní mikroorganizmy proniknou za mechanické bariéry, potlačila jejich namnožení a šíření uvnitř těla. Mají-li buňky produkující obranné molekuly reagovat na cizorodou invazi, musí nejprve poměrně složitým způsobem rozpoznat antigeny patogenního mikroba. Pak tuto informaci zpracují a vystavějí genetický aparát, který řídí syntézu specifických imunoglobulinových molekul – a ty už se vážou jenom na antigenní látky, jež jejich tvorbu vyvolaly.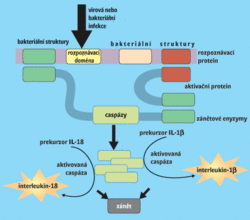 Celý tento proces chvíli trvá, buňky se během něj musí několikrát dělit. První obranné molekuly (např. protilátky) se začínají objevovat po 48–72 hodinách. Rozpor je v tom, že se bakterie dokážou dělit i v dvacetiminutových intervalech. Co se tedy v organizmu děje v prvních okamžicích po kontaktu s infekcí?
Celý tento proces chvíli trvá, buňky se během něj musí několikrát dělit. První obranné molekuly (např. protilátky) se začínají objevovat po 48–72 hodinách. Rozpor je v tom, že se bakterie dokážou dělit i v dvacetiminutových intervalech. Co se tedy v organizmu děje v prvních okamžicích po kontaktu s infekcí?
Řešení paradoxu: opomíjená přirozená imunita
Zatímco se imunologové zabývali výzkumem získané imunity, začaly se (zhruba od počátku osmdesátých let 20. století) hromadit důkazy, že je organizmus na počátku infekce chráněn množstvím různorodých molekul, které zabíjejí patogenní mikroorganizmy ihned. Ukázalo se, že tyto molekuly jsou strukturálně i funkčně blízké obranným molekulám přirozené imunity bezobratlých živočichů. Převážně jsou to malé peptidy, které nesou kladně nabité ionty, díky nimž se okamžitě vážou na bakteriální buněčnou stěnu a ničí její integritu. Zabití bakterie je v podstatě fyzikálně-chemický proces. Na rozdíl od imunoglobulinů adaptivní imunity jsou kationické peptidy produkovány stále a zasahují téměř okamžitě široké spektrum bakterií, podobně jako klasická antibiotika nebo sulfonamidy.Postupně se ukázalo, že geny regulující přirozenou imunitu bezobratlých vykazují pozoruhodnou podobnost s geny odpovědnými za přirozenou imunitu obratlovců včetně člověka. Rovněž mechanizmus produkující antibakteriální kationické peptidy u obratlovců se v principu shoduje s evolučně prastarými obrannými reakcemi bezobratlých, a dokonce rostlin.
U rostlin se obrany proti infekci účastní rodina proteinů s koncovou rozpoznávací oblastí, v níž se opakují sekvence s vysokým obsahem aminokyseliny leucinu. Označují se LRR (Leucine-Rich Repeats). Podobné rozpoznávací proteiny se ale našly i v cytoplazmě živočišných buněk. Účastní se programované buněčné smrti – apoptózy (viz Vesmír 73, 550, 1994/10). Nesou doménu vázající nukleotidy, která je odpovědná za vytvoření proteinového komplexu, a proto se označují NOD (Nucleotide-binding Oligomerization Domain).
Jak vidí buněčné „vnitřní oči“
Buňky adaptivní imunity rozpoznávají antigenní struktury bakterií prostřednictvím povrchových receptorů imunoglobulinového typu, které se liší svými vazebnými místy a tvoří se po celý život jedince. Již delší dobu je známo, že cizorodé peptidy jsou rozpoznávány také nitrobuněčně – prostřednictvím molekul hlavního histokompatibilního komplexu, které předkládají rozpoznané antigenní determinanty T-lymfocytům (viz Vesmír 78, 565, 1999/10).Buňky přirozené imunity rozpoznávají poměrně stabilní antigeny bakterií povrchovými receptory, zakódovanými geneticky. Nedávno se však podařilo prokázat, že mimo to jsou bakterie rozpoznávány receptory v cytoplazmě. A jako tyto „vnitřní oči“ slouží právě proteiny rodiny NOD.
U člověka byly zatím identifikovány dva: NOD1 rozpoznává určité struktury v peptidoglykanech bakteriální stěny gramnegativních bakterií (k nim se řadí obávané meningokoky, vyvolávající onemocnění mozku, nebo enterobakterie, jež jsou původci střevních chorob). NOD2 váže i peptidoglykany bakterií grampozitivních (stafylokoků a streptokoků známých z běžných raných infekcí). Molekula proteinů NOD má rozpoznávací část s vysokým obsahem leucinu podobnou, jakou má rozpoznávací protein rostlin. 1)
Molekuly zánětu: caspázy a cytokiny
Do procesu infekčního zánětu vstupují další členové rodiny NOD, proteiny NALP, které se jednak účastní programované buněčné smrti, jednak spouštějí zánět. Je zajímavé, že oba procesy jsou si podobné, a dokonce využívají podobné cytoplazmatické komplexy molekul: buněčná smrt je vázána na apoptozom, nitrobuněčné rozpoznávání bakterií na inflamazom. Komplex infl amazomu (viz obr.) je tvořen třemi základními proteiny: NALP1, spojovacím proteinem a zánětovým enzymem caspázou-1. NALP1 rozpoznává bakterie (váže se na struktury bakteriální stěny rozpoznávací doménou LRR), a tento proces aktivuje celý komplex. Aktivovaná caspáza-1 vyvolá tvorbu prozánětových cytokinů (Vesmír 70, 386, 1991/7) z jejich neaktivních prekurzorů, které se nacházejí v sliznicích na strategicky důležitých rozhraních mezi vnějším a vnitřním prostředím organizmu.Inflamazom reaguje na infekci tím, že okamžitě začne tvořit prozánětové cytokiny, spustí akutní zánět a neustále zpracovává informace o průběhu a intenzitě infekce. Na jejich základě se pak rozhodne, jestli bude zánět protizánětovými cytokiny ukončen a zahájena obnova, nebo zda se rozvine a stane se chronickým, popřípadě vyústí v smrt buňky, orgánu či celého organizmu. Je samozřejmé, že u rozsáhlých zánětů (jako je zápal plic nebo některé choroby zažívacího ústrojí) je produkce zánětových molekul velmi vysoká.
Studium nitrobuněčného rozpoznávání prostřednictvím mechanizmů přirozené imunity je teprve v počátcích. Je známo, že některé bakterie schopné nitrobuněčného parazitizmu, např. Salmonella, jsou po opuštění ochranné vakuoly zničeny podobným procesem, jakým jsou rozkládány „opotřebované“ bílkoviny. Další objevy jak rozpoznávacích molekul, tak molekul podporujících nebo potlačujících zánět, které lze očekávat v nejbližší budoucnosti, budou jistě využity pro léčení infekčních chorob, zejména hrozivého septického šoku, na který umírají ve světě každoročně miliony lidí.
Poznámky
SLOVNÍČEK
gramnegativní a grampozitivní bakterie – mají rozdílnou chemickou skladbu stěny, a proto je lze odlišit barvením; gramnegativní bakterie mají složitou, neprostupnou vnější membránu, která je tvořena lipopolysacharidemhlavní histokompatibilní komplex – systém genů, jejichž produkty jsou antigeny pro každého jedince unikátní; ty jsou příčinou neslučivosti tkání (viz např. transplantační reakce)
T-buňky – lymfocyty, které k rozpoznání antigenu vyžadují účast molekul hlavního histokompatibilního komplexu
inflamazom – (z lat. inflammatio, zánět); proteinový komplex rozpoznávající bakterie uvnitř buňky a indukující zánětovou odpověď
caspázy – (z. angl. Cysteinyl Aspartate-Specific Proteases); cysteinové proteázy (proto „c“!) učastnící se v procesu programované buněčné smrti (apoptózy) i v zánětu
Ke stažení
 článek ve formátu pdf [148,33 kB]
článek ve formátu pdf [148,33 kB]

























