Ze života „červů“
Nobelova cena za objevy ve fyziologii a medicíně byla r. 2002 udělena třem vědcům za práce prováděné převážně na malém bezobratlém organizmu, hlístici Caenorhabditis elegans neboli háďátku (viz Vesmír 82, 133, 2003/3). Veřejnost již nepovažuje za nic neobvyklého, že k objevům v lékařství z velké části přispívá studium organizmů, jako jsou bakterie, kvasinky či Drosophila. Jak ale k poznatkům, které se v biologii hrnou ze všech stran, přispívá právě háďátko?
Je na malém „červíku“ něco zvláštního?
Sydney Brenner, John E. Sulston a H. Robert Horvitz nebyli oceněni pouze za význačné objevy měnící chápání v oboru, ale také za aktivitu, s níž vytvořili mezinárodně soustředěný a široce sdílený výzkum jediného malého organizmu. Kompletní analýzu háďátka (od vývojových schémat po genom, transkripty a proteom) umožnila spolupráce. Těžko říci, odkud která iniciativa vyšla, vědci se inspirují navzájem. Argumenty svědčící pro širokou spolupráci jsou dnes obecně uznávány. Jestliže potřebujeme nějakou informaci týkající se struktury a funkce určitého proteinu, sekvencí nukleových kyselin či genetických dat a chorob, pravděpodobně ji najdeme na internetu – a právě tento vývoj byl do značné míry podpořen tím, co se odehrálo ve výzkumu C. elegans.Programovaný vývoj a buněčná smrt
Co je to programová buněčná smrt (apoptóza) a čím je podmíněna? Je to fyziologický proces, který se vyskytuje u mnohobuněčných organizmů a má důležitou úlohu při vývoji stejně jako později při likvidaci nepotřebných nebo potenciálně škodlivých buněk. Tento proces je geneticky regulován – zcela zdravé buňky během něj zanikají na základě vlastního genetického programu. Vyskytuje se jak za fyziologických, tak za patologických podmínek, a to již během vývoje organizmů. Například při vývoji lidského plodu zanikají apoptózou některé neurony, které jsou přítomny v časných stadiích utváření mozku. Apoptóza je důležitá také při tvarování tkání, například při tvorbě prstů se apoptózou odbourává meziprstní mezoderm. Podobně zanikají některé tkáně při metamorfóze u hmyzu a obojživelníků.Apoptóza může být aktivována mnoha různými podněty, například extracelulárními růstovými faktory, steroidními hormony, poškozením DNA při ozáření, nedostatkem kyslíku v tkáních či virovou infekcí. Liší se od nekrózy, která vzniká po poškození buněk chemicky, zánětem apod. Morfologické změny buněk C. elegans, které odumírají apoptózou, jsou podobné změnám u savců. Zmenší se objem buňky, kondenzuje cytoplazma i jaderný chromatin, probíhá jaderná fragmentace a fragmenty se vážou na membránu. Zbytky buněk jsou později pohlceny (fagocytovány) sousedními buňkami a rozloženy v lyzozomech.
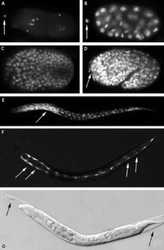
Díky zachovanému sledu buněčných dělení u C. elegans bylo možno zjistit, že apoptózou zahyne přesně 131 z 1090 buněk. Které buňky to jsou a kdy zaniknou? Identifikace těchto buněk je u C. elegans jednoduchá, protože epidermální buňky s kutikulou, která je kryje, jsou průhledné (viz obrázek A–F). Apoptózou hynou převážně buňky ektodermálního původu (neurony a epidermální buňky), méně už buňky mezodermálního původu (svaly). Nejvíce buněk zahyne již v embryonálním období, ale zanikají i během larválního vývoje a poměrně velké množství zárodečných buněk hyne také u dospělých jedinců – hermafroditů.
Genetika apoptózy: proč buňky umírají
Díky C. elegans se zjistilo, že programová buněčná smrt je regulována geneticky. Genetickými manipulacemi bylo izolováno více než 100 mutací ovlivňujících apoptózu, a dokonce se podařilo identifikovat geny, které jsou za to odpovědné. Tyto geny byly seřazeny podle toho, jak fungují, a tím byla definována genetická regulační cesta. Můžeme ji rozdělit na čtyři základní kroky: „rozhodnutí“ individuální buňky k apoptóze, zahájení tohoto procesu, pohlcení umírající buňky sousední buňkou a zánik (degradaci) buňky.Velká část této práce byla udělána v laboratoři Roberta Horvitze z Massachusettské techniky. V roce 1986 publikovali R. Horvitz a jeho spolupracovníci v časopise Cell práci, v níž prokázali, že u C. elegans jsou pro zahájení apoptózy nezbytné geny ced-3 a ced-4 (ced znamená cell death). Jestliže tyto geny zmutují, buněčná smrt není možná. Čím se tyto mutované organizmy liší? Mají větší množství somatických buněk a například 407 neuronů místo původních 302. Jedinci nejsou příliš poškozeni, jen rostou pomaleji, mají sníženou plodnost a poruchu chemotaxe.
Důležitým zjištěním bylo, že gen ced-3 kóduje enzym kaspázu (cysteinproteázu), patřící do skupiny genů ICE, které jsou přítomny i u savců. Jméno skupiny je odvozeno od jejího hlavního člena, jímž je Interleukin-1 beta-Converting Enzyme. Analýzou enzymatické aktivity u některých mutantů C. elegans nesoucích mutovaný gen ced-3 potvrdili R. Horvitz a jeho spolupracovníci vzájemnou závislost mezi mutací v tomto genu a množstvím produkovaného enzymu. Později bylo prokázáno, že zvýšená exprese genu způsobuje apoptózu také u savčích buněk. Funkce kaspázy CED-3 1) je regulována genem ced-4. Tento gen kaspázy, má také svůj homolog u lidí (Apaf-1).
R. Horvitz a jeho spolupracovníci později ukázali, že přítomnost jiného genu, ced-9, naopak působí proti programové buněčné smrti a buňky, které by měly zahynout, v organizmu pod jeho vlivem přetrvávají. Ced-9 je homolog genu bcl-2, savčího protoonkogenu, který chrání buňky před apoptózou. Tento gen použili Horvitz a jeho kolegové pro „vyléčení“ mutanta C. elegans, kterému gen ced-9 chyběl, a tím prokázali zastupitelnou funkci obou proteinů. Objevili také, že ced-9 zruší funkci genu ced-4 a funguje v regulační kaskádě před ním.
Vědci pracující pod vedením Roberta Horvitze dále studovali, čím je regulováno odstranění umírající buňky, a objevili geny, které jsou za odstranění buňky odpovědné (ced-1, ced-2, ced-5, ced-7, ced-10), a také geny regulující čas buněčné smrti (ced-8). I když je známo mnoho genů účastnících se programové buněčné smrti, zbývají další nezodpovězené otázky: Jak se oněch 131 buněk „rozhodne“ zahynout buněčnou smrtí? Co takovému „rozhodnutí“ předchází? Jaké jsou substráty kaspázy CED-3? Které signály z umírající buňky působí na sousední buňky a spouštějí v nich procesy degradace? Proč je objevení všech genů regulujících apoptózu tak důležité? Odpověď na poslední otázku už tušíme. Potlačení apoptózy může být spojeno se vznikem nádorů či autoimunních onemocnění, zatímco mimořádná aktivace buněčné smrti možná přispívá k odumírání buněk při neurodegenerativních onemocněních.
Od klasické genetiky k obrácené
Zmíněné objevy vznikaly na pozadí rozvoje ve všech oblastech biologie a medicíny. Sekvenační metody se zlepšily, a proto bylo možno pomýšlet na plošné sekvencování genetické informace u celých organizmů. Od počátečních bakterií, jako je Mycoplasma genitalium, jíž parazitický způsob života umožňuje existenci s méně než 500 geny, se přešlo na komplexnější prokaryonta a později i na eukaryonta. Sekvencování genomu Sacharomyces cerevisiae bylo velmi pokročilé už počátkem devadesátých let. Při výzkumu C. elegans byli archivováni specifičtí mutanti, přirození i uměle vytvoření. Rozvoj metod molekulární genetiky C. elegans umožnil identifikovat geny odpovědné za studované fenotypy, tedy to, co se dnes obecně nazývá dopředná genetika. Dopředná proto, že háďátko umožnilo i opačný postup, od známé sekvence funkčně neznámého genu k pochopení jeho funkce. Tím, že byl jeho genom kompletně sekvencován, byly poznány nejen genomové sekvence kódující proteiny, ale také introny a mezigenové i okrajové sekvence.Ukázalo se, že genom C. elegans je velice komplexní a obsahuje velké množství genů homologních genům obratlovců, ale je mnohem menší (asi třicetkrát) v porovnání s genomem lidským. Je to způsobeno tím, že mezigenové sekvence a introny jsou poměrně krátké. Organizace genů a pozice intronů bývá často evolučně zachována.
Genomový sekvenační projekt byl zahájen r. 1990 ve dvou centrech, v britské Cambridži a v americkém St. Louis. Dokončen měl být kolem r. 2003, ale rozvoj sekvenačních metod i počítačového zpracování umožnil, že byl hotov již r. 1998. Počítačový program Genefinder, který byl vytvořen na předpovězení možných transkriptů, vedl k odhadu asi 19 000 hypotetických genů. Ukázalo se, že předpověď byla mimořádně přesná, i když stále ještě nacházíme další možné sestřihové formy transkriptů.
Jednou z prvních metod, která se na modelu C. elegans rozšířila jako nástroj k pochopení funkce určitého genu, byla metoda tvorby cílených delecí (ztrát nukleotidů) ve sledovaných genech pomocí mobilních transpozonů. Ty umožnily vytvářet v genomové DNA delece, 2 které mohly být identifikovány pomocí reverzní transkripce a polymerázové řetězové reakce neboli PCR (viz Vesmír 77, 444, 1998/ 8) cílené přímo na sledovaný gen. Metoda se rozšířila tak, že dokonce vznikla centra vytvářející dané mutanty,3 někdy i na vyžádání zdarma. Tato metoda byla postupně nahrazena chemickou mutagenezí.
Jak vypnout gen
Funkci sledovaného genu lze utlumit i na úrovni posttranskripční. Jestliže je uměle připravená RNA komplementární k určité mRNA vnesena do jádra buňky, může za jistých okolností s mRNA hybridizovat, a tím zabrání efektivnímu překladu na protein. Díky tomu, že Thomas Cech objevil enzymatické schopnosti RNA (r. 1989 za to dostal Nobelovu cenu), lze vytvořit takovou RNA, která dovolí nejen hybridizaci k cílové mRNA, ale také její štěpení strukturou známou jako „hlava kladiva“ (hammerhead). Je pochopitelné, že při studiu funkce určitého genu jsou nutné kontroly, které dokážou, že studovaný efekt je specifický pro danou sekvenci RNA. Asi nejlepší kontrolou je v takovém případě použití sekvence komplementární k RNA, kterou používáme jako pokusný prostředek (je tedy shodná s cílovou mRNA). Taková RNA samozřejmě nemůže hybridizovat s mRNA a měla by být dokonalou kontrolou.Ve světě C. elegans, kde je vše podřízeno detailnímu popisu a veřejné diskusi, je místo i pro data, která s naším systémem nesouhlasí. Na počátku dalšího velkého objevu byla dvě pozorování, která zveřejnil r. 1991 Andrew Fire se spolupracovníky (tehdy působil v Laboratoři molekulární biologie v anglické Cambridži) a r. 1995 Su Guo a Ken Kemphues z Cornellovy univerzity. Všimli si, že jejich kontrolní RNA (sense) má podobný efekt jako RNA „správná“ (antisense), která brání překladu. Viděli, že jde o specifický jev. Nejsilnější byl dokonce vliv takové RNA, kde byly pro pokus použity „sense“ a „antisense“ najednou. Od té chvíle pak už nebylo daleko k pochopení, že nejsilnější vliv má RNA, která je dvouvláknová.
Tuto záhadu objasnili Andy Fire ve Washingtonově ústavu Carnegiho nadace v Baltimore, a Craig Mello z Lékařské fakulty Massachusettské univerzity. Zjistili, že po mikroinjekcích dvouvláknové RNA určitého genu do vaječníku hlístice degraduje specifická mRNA. Prokázali, že tento mechanizmus je geneticky kódován a podílí se na regulaci vývoje. Později bylo zjištěno, že stejný mechanizmus se uplatňuje u drozofily a že krátké interferující RNA brzdí funkci genů také v některých lidských buněčných liniích. Dále byl objeven enzym dicer, účastnící se počátečního štěpení dvouvláknové RNA, a enzymatický komplex RISC, který se uplatňuje při degradaci cílové mRNA. Tato metoda se u C. elegans rozvinula tak, že se dnes běžně používá pro testování funkce daného genu. V současné době se touto metodou plošně sleduje funkce genů celých chromozomů a v blízké budoucnosti bude celý genom C. elegans charakterizován funkčně. Možnosti uplatnění interference RNA (viz obrázek G) v medicíně jsou nasnadě. Dvouvláknová RNA by se mohla využít proti transkriptům viru HIV v progenitorových imunitně aktivních buňkách. Podobně se zkouší dvouvláknová RNA pro utlumení genů, které se uplatňují v růstu nádorů.
Dalším objevem bylo zjištění Garyho Ravkuna a jeho spolupracovníků z Harvardské univerzity, že vývoj C. elegans je regulován působením malých, krátkých RNA.4 Překvapivě se ukázalo, že další organizmy včetně člověka mají podobné „malé“ geny, které mají nejen časově regulační funkci, ale dokonce jsou podobné i sekvenčně, a tedy představují novou skupinu genů fungujících na úrovni RNA.
Možnost pochopit život v evolučním rozměru
Některé laboratoře se zaměřily na detailní určení genů uplatňujících se při regulování diferenciace buněk. Od prvních dělení jsou geneticky určovány geny odpovědné za asymetrické dělení buněk, které navodí novou diferenciaci. Můžeme očekávat, že během jednoho nebo dvou let budou poznány základní genové bloky regulující buněčná určení.Přístup uplatněný při výzkumu C. elegans se rozšířil na další systémy. Trend uveřejňovat data a propojit vědu internetem není samozřejmě jen dílem komunity studující C. elegans, nicméně tito lidé ukázali, že systematické uplatňování takového přístupu je nesmírně efektivním prostředkem výzkumu. Záhy byl obdobně pojat výzkum C. briggsae, jehož cílem je vysledovat konzervované sekvence, které mohou mít regulační funkci.
Koncept se uplatňuje i při studiu jiných modelových organizmů, v sekvenačním projektu lidského genomu, v lidské genetice, strukturální biologii a dalších oborech. Data, která jsou díky tomu k dispozici, nemají význam jen pro jednotlivé organizmy, ale pomáhají nám pochopit mechanizmy určující i vývoj a funkci organizmů evolučně vzdálených. Otevírají se tak před námi možnosti pochopení života v jeho evolučním rozměru.
Poznámky
SYDNEY BRENNER, JOHN SULSTON, ROBERT HORVITZ
(Repetitorium, ad Vesmír 82, 133, 2003/3)
- SYDNEY BRENNER pátral po organizmu, který by byl dostatečně jednoduchý pro detailní vývojový popis, a přitom by měl předpoklady pro existenci základních vývojových regulačních cest. Jako modelový organizmus, vhodný zejména ke studiu vývoje, zvolil háďátko. Od Darwinových dob víme, že živá příroda své objevy uchovává, a ať byla její minulost dobrá nebo špatná, nese ji s sebou v podobě svých funkcí a organizace. Je to s ní podobné jako s jazykem, ten si také uchovává spíš mechanizmy a strukturu než specifické významy jednotlivých zvuků. Mimořádný „červík“, vyvíjející se od zygoty v dospělého jedince se stálým, vždy stejným počtem somatických buněk, byl prozkoumán do detailů. Jeho tělo bylo rekonstruováno v sériových elektronmikroskopických řezech a byla definována všechna nervová spojení. Na základě podrobné analýzy pak bylo možno vytvořit schémata buněčných dělení a buněčné diferenciace všech jeho somatických buněk.
- JOHN SULSTON zásadním způsobem přispěl k pochopení buněčné specifikace dělících se buněk a také ukázal, že během normálního diferenciačního procesu při vývoji C. elegans specifické buňky zahynou programovou buněčnou smrtí, apoptózou.
- ROBERT HORVITZ použil C. elegans ke studiu genů, které programovou buněčnou smrt regulují. Prokázal, že stejné geny, které regulují apoptózu u C. elegans, se vyskytují také u člověka.
Ke stažení
 Článek ve formátu PDF [254,47 kB]
Článek ve formátu PDF [254,47 kB]