Alternatívne stratégie replikácie telomér I.
...Posledný gén musí mať špeciálnu funkciu – zalepiť koniec chromozómu, pretože chromozóm s „nezalepenými“ koncami z neznámych dôvodov nie je schopný dlhodobej existencie. Tento gén treba označiť nejakým špeciálnym termínom, napríklad ,teloméra‘ (nezávisle aplikovaným mnou, Darlingtonom a Haldaneom)...
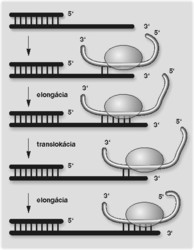
 Povie vám to každý komik: nech je scénka akokoľvek vtipná a plná originálnych nápadov, bez pointy z nej ostáva len trápny dojem. A pointami chromozómov sú teloméry (gr. telos, koniec, meros, časť), štruktúry na konci lineárneho chromozómu zabezpečujúce jeho ochranu pred degradáciou a fúziou s inými chromozómami. Akokoľvek je replikácia chromozómu bezchybná a rýchla, bez syntézy a stabilizácie telomér sa neubráni istej dávke rozpačitosti. Všimli si to už Barbara McClintocková a Hermann J. Müller v 30. rokoch minulého storočia: chromozómy s narušenými koncami majú tendenciu fúzovať a vytvárať štruktúry, ktoré nie sú stabilné pri delení bunky. A bol to práve Müller, ktorý do cytogenetiky zaviedol termín teloméra. Po štyridsiatich rokoch relatívneho ticha zadunel telomérami ďalší problém, ktorý nezávisle od seba formulovali James D. Watson a ruský biofyzik Alexej M. Olovnikov. Práve sa končila éra Arthura Kornberga, ktorý v priebehu 15 rokov odhalil základné princípy replikácie DNA. Jedným z nich bol prekvapivý fakt, že DNA-polymerázy (enzýmy zodpovedné za syntézu DNA) sú tvrdohlavo jednosmerné (od konca 5‘ ku koncu 3‘) a všetky potrebujú pre začiatok syntézy dcérskeho vlákna voľnú hydroxylovú skupinu. Ani jednu z týchto požiadaviek im koniec chromozómu nedokáže splniť. Replikácia telomér teda nevyhnutne vyžaduje špeciálny mechanizmus a podľa všetkého špeciálny proteínový aparát. Bez jeho existencie by po každom kole replikácie dochádzalo ku skracovaniu chromozómu a po erózii nevyhnutných génov v blízkosti telomér aj k smrti bunky (obrázek).
Povie vám to každý komik: nech je scénka akokoľvek vtipná a plná originálnych nápadov, bez pointy z nej ostáva len trápny dojem. A pointami chromozómov sú teloméry (gr. telos, koniec, meros, časť), štruktúry na konci lineárneho chromozómu zabezpečujúce jeho ochranu pred degradáciou a fúziou s inými chromozómami. Akokoľvek je replikácia chromozómu bezchybná a rýchla, bez syntézy a stabilizácie telomér sa neubráni istej dávke rozpačitosti. Všimli si to už Barbara McClintocková a Hermann J. Müller v 30. rokoch minulého storočia: chromozómy s narušenými koncami majú tendenciu fúzovať a vytvárať štruktúry, ktoré nie sú stabilné pri delení bunky. A bol to práve Müller, ktorý do cytogenetiky zaviedol termín teloméra. Po štyridsiatich rokoch relatívneho ticha zadunel telomérami ďalší problém, ktorý nezávisle od seba formulovali James D. Watson a ruský biofyzik Alexej M. Olovnikov. Práve sa končila éra Arthura Kornberga, ktorý v priebehu 15 rokov odhalil základné princípy replikácie DNA. Jedným z nich bol prekvapivý fakt, že DNA-polymerázy (enzýmy zodpovedné za syntézu DNA) sú tvrdohlavo jednosmerné (od konca 5‘ ku koncu 3‘) a všetky potrebujú pre začiatok syntézy dcérskeho vlákna voľnú hydroxylovú skupinu. Ani jednu z týchto požiadaviek im koniec chromozómu nedokáže splniť. Replikácia telomér teda nevyhnutne vyžaduje špeciálny mechanizmus a podľa všetkého špeciálny proteínový aparát. Bez jeho existencie by po každom kole replikácie dochádzalo ku skracovaniu chromozómu a po erózii nevyhnutných génov v blízkosti telomér aj k smrti bunky (obrázek).
 Problém replikácie a stabilizácie koncov lineárnych molekúl DNA sa stal jednou z najvzrušujúcejších tém, pretože bol v úzkom vzťahu k mitotickej nestabilite spojenej s nádorovou transformáciou na jednej strane a bunkovým starnutím na strane druhej. Olovnikov totiž jasnozrivo predpovedal, že teloméry môžu predstavovať mitotické hodiny normálnej bunky. Práca Leonarda Hayflicka zo 60. rokov naznačili, že ľudská bunka má len limitovaný deliaci potenciál (50 až 100 generácií – Hayflickov limit), po prekročení ktorého sa zapína program jej starnutia. Mitotické hodiny sú na začiatku života organizmu natiahnuté len na tento počet generácií a skracovanie telomér by mohlo predstavovať hodinovú ručičku, ktorá sa zastaví pri kritickej dĺžke koncov chromozómov a nepustí bunku do ďalšieho bunkového cyklu. Naopak keď sa hodinový mechanizmus poškodí, napríklad patologickým predlžovaním telomér, bunka ignoruje Hayflickov limit a je na najlepšej ceste k nesmrteľnosti (Vesmír 75, 5, 1996/1).
Problém replikácie a stabilizácie koncov lineárnych molekúl DNA sa stal jednou z najvzrušujúcejších tém, pretože bol v úzkom vzťahu k mitotickej nestabilite spojenej s nádorovou transformáciou na jednej strane a bunkovým starnutím na strane druhej. Olovnikov totiž jasnozrivo predpovedal, že teloméry môžu predstavovať mitotické hodiny normálnej bunky. Práca Leonarda Hayflicka zo 60. rokov naznačili, že ľudská bunka má len limitovaný deliaci potenciál (50 až 100 generácií – Hayflickov limit), po prekročení ktorého sa zapína program jej starnutia. Mitotické hodiny sú na začiatku života organizmu natiahnuté len na tento počet generácií a skracovanie telomér by mohlo predstavovať hodinovú ručičku, ktorá sa zastaví pri kritickej dĺžke koncov chromozómov a nepustí bunku do ďalšieho bunkového cyklu. Naopak keď sa hodinový mechanizmus poškodí, napríklad patologickým predlžovaním telomér, bunka ignoruje Hayflickov limit a je na najlepšej ceste k nesmrteľnosti (Vesmír 75, 5, 1996/1).
Začiatkom 70. rokov boli teda problémy telomér definované: nebolo jasné, akým spôsobom sa replikujú, ako je tento proces regulovaný a ako sa konce chromozómov bránia proti vzájomnej fúzii. Okrem toho teloméry sú prototypom dvojvláknových zlomov DNA s veľmi nestabilnou štruktúrou, ktorá pripomína chorý prvok na jadrovej scéne a reparačné bunkové systémy ju vedia rozpoznať. Teloméry teda musia byť schopné brániť sa aj proti snahám bunky o ich „opravu“. A pritom hypotéza o vzťahu dynamiky telomér k starnutiu bunky a nádorovej premene ostávala visieť vo vzduchu bez experimentálneho overenia.
Cesta k riešeniu: sekvenčná analýza telomér
 Keďže chvíľu trvalo, kým sa našli vhodné experimentálne prostriedky, na problém sa vrhli teoretici. Výsledkom ich snaženia bola séria špekulatívnych prác s krkolomnými schémami. Prielom do tohto zmätku vniesla až Elisabeth Blackburnová, ktorá roku 1978 stanovila sekvenciu prvej jadrovej teloméry. Ako modelový organizmus si vybrala prvoka Tetrahymena thermophila. Jeho zvláštnosťou je to, že pri delení buniek sa v procese prepisu (transkripcie) genetickej informácie spontánne vytvárajú tisíce podobných minichromozómov a každý z nich má špecifickú telomerickú sekvenciu. To znamená, že v procese tvorby makrojadra dochádza k prirodzenému klonovaniu telomér.
Keďže chvíľu trvalo, kým sa našli vhodné experimentálne prostriedky, na problém sa vrhli teoretici. Výsledkom ich snaženia bola séria špekulatívnych prác s krkolomnými schémami. Prielom do tohto zmätku vniesla až Elisabeth Blackburnová, ktorá roku 1978 stanovila sekvenciu prvej jadrovej teloméry. Ako modelový organizmus si vybrala prvoka Tetrahymena thermophila. Jeho zvláštnosťou je to, že pri delení buniek sa v procese prepisu (transkripcie) genetickej informácie spontánne vytvárajú tisíce podobných minichromozómov a každý z nich má špecifickú telomerickú sekvenciu. To znamená, že v procese tvorby makrojadra dochádza k prirodzenému klonovaniu telomér.
Tento fakt Blackburnová využila na stanovenie sekvencie telomér prvoka a zistila, že pozostávajú z niekoľkých desiatok opakovaní tej istej sekvencie TTGGGG. Zakrátko bola stanovená sekvencia telomér ďalších organizmov, vrátane človeka (tab. I a II). Na všeobecné prekvapenie, ľudské teloméry sa od telomér prvoka Tetrahymena odlišovali len jediným nukleotidom (TTAGGG). Väčšina doteraz známych telomér jadrových chromozómov sa len nepatrne odlišuje od telomér Tetrahymena. A nielen to: ďalšou spoločnou črtou jadrových telomér je existencia jednovláknového prečnievania na konci 3‘ (obrázek, obrázek). Takmer univerzálna organizácia telomér – séria jednoduchých tandemových opakovaní nasledovaná prečnievaním na konci 3‘ – naznačila, že možno bude univerzálny aj spôsob ich replikácie.
Telomeráza
Začiatkom 80. rokov E. Blackburnová spolu s Jackom W. Szostakom a Janis Shampayovou navrhli riešenie problému replikácie telomér, ktoré bolo založené na existencii (v tom čase hypotetického) enzýmu, ktorý by bol schopný aktivity, akou nedisponujú známe DNA-polymerázy. Opäť do hry vstúpil prvok Tetrahymena. Extrakty z jeho makrojadier sa pre Blackburnovú a jej študentku Carol Greiderovú (všimnite si dominanciu žien v tejto oblasti) stali v roku 1984 zdrojom na identifikáciu hľadaného enzýmu, ktorý pomenovali telomeráza. V krátkom slede publikovali dve práce, ktoré možno bude raz zvažovať nobelovská komisia. Tento enzým je schopný opakovane pripájať k prečnievajúcemu koncu 3’ sekvenčný motív TTGGGG. Naviac dokázali, že táto fascinujúca DNA-polymeráza nepotrebuje na svoju aktivitu pridanie templátu (vzoru pre syntézu DNA) do reakčnej zmesi! Greiderová a Blackburnová zistili, že telomeráza sama obsahuje templát v podobe krátkej molekuly RNA. Telomeráza sa tak zaradila do rodiny DNA-polymeráz závislých od RNA. Dôverne ich poznáme predovšetkým vďaka životnému cyklu retrovírusov (Vesmír 80, 332, 2001/6). Na rozdiel od reverzných transkriptáz sú telomerázy veľmi prieberčivé enzýmy, v bunke si zásadne vyberajú len jediný substrát, svoju vlastnú podjednotku RNA. Tá má tri úlohy:
Greiderová a Blackburnová zistili, že telomeráza sama obsahuje templát v podobe krátkej molekuly RNA. Telomeráza sa tak zaradila do rodiny DNA-polymeráz závislých od RNA. Dôverne ich poznáme predovšetkým vďaka životnému cyklu retrovírusov (Vesmír 80, 332, 2001/6). Na rozdiel od reverzných transkriptáz sú telomerázy veľmi prieberčivé enzýmy, v bunke si zásadne vyberajú len jediný substrát, svoju vlastnú podjednotku RNA. Tá má tri úlohy:
- prechodne ukotviť telomerázu na vlákno prečnievajúce na konci 3‘;
- slúžiť ako templát pre proteínovú podjednotku katalyzujúcu syntézu DNA;
- premiestniť celý telomerázový komplex.
 Výsledkom je predĺžený reťazec na konci 3‘ (obrázek), ktorý sa tak stáva templátom pre štandardnú DNA-polymerázu. Už v 80. rokoch bola telomerázová aktivita detegovaná v jadrách mnohých ďalších organizmov. Vyvrcholením tohto obdobia bolo úspechom korunované úsilie Gregga B. Morina – dôkaz telomerázy v bunkách ľudskej nádorovej línie (pozri Vesmír 75, 155, 1996/3).
Výsledkom je predĺžený reťazec na konci 3‘ (obrázek), ktorý sa tak stáva templátom pre štandardnú DNA-polymerázu. Už v 80. rokoch bola telomerázová aktivita detegovaná v jadrách mnohých ďalších organizmov. Vyvrcholením tohto obdobia bolo úspechom korunované úsilie Gregga B. Morina – dôkaz telomerázy v bunkách ľudskej nádorovej línie (pozri Vesmír 75, 155, 1996/3).
Zatiaľ čo identifikácia telomerickej podjednotky RNA nepredstavovala zásadný problém, izoláciu proteínového katalyzátora sprevádzalo množstvo neúspechov a v dôsledku nesmiernej súťaživosti aj pomerne veľa falošných kandidátov. Paradoxne, Tetrahymena spolu s Carol Greiderovou ostala tentoraz v poli „porazených“. Víťazom sa stal Tom Cech, ktorého študent Joachim Lingner izoloval hľadaný proteínový komponent z prvoka Euplotes aediculatus. Paralelne s Cechovými štúdiami sa objavili práce Victorie Lundbladovej, ktorá svoj kredit vyťažila z potenciálu kvasinkovej genetiky. Izolovala sériu štyroch est (ever shorter telomeres) mutantov, ktorým sa progresívne skracujú teloméry. Keďže v normálnych kmeňoch kvasinky Saccharomyces cerevisiae je telomeráza permanentne aktívna, bola šanca, že jeden z mutantov bude mať poškodený gén kódujúci proteínovú podjednotku telomerázy. Predpoklad bol správny: gén EST2 kódoval proteín s vysokým stupňom sekvenčnej podobnosti s proteínom izolovaným v Cechovom laboratóriu z Euplotes. Zakrátko boli identifikované homologické proteíny z ďalších organizmov vrátane ľudského. Ich sekvenčná analýza potvrdila predpoklad, že patria do skupiny reverzných transkriptáz.
Rekombinácia
Jedným zo skeptikov v tejto oblasti bol aj Roger Reddel, ktorý pred piatimi rokmi dokázal, že niektoré nádorové bunky rastú bez problémov aj bez aktívnej telomerázy a že napriek tomuto „defektu“ majú teloméry nezvyčajne dlhé. Tieto pozorovania viedli k hypotéze, že cicavčie bunky disponujú alternatívnym mechanizmom replikácie telomér nezávislým od telomerázy, ktorý označil ALT (alternative lengthening of telomeres).Pre ľudí študujúcich replikáciu telomér kvasiniek Saccharomyces cerevisiae neboli Reddelove experimenty prekvapujúce. Virginia Zakianová a Tom Petes už v polovici 80. rokov (pred objavom telomerázy) experimentálne potvrdili „rekombinačnú dráhu“ replikácie telomér u kvasiniek. Ich experimenty boli výsledkom logickej úvahy: keďže teloméry všetkých chromozómov majú veľmi podobné sekvencie (vo väčšine organizmov sú identické), malo by medzi nimi dochádzať k pomerne častým výmenám (rekombináciám). V prípade, že táto rekombinácia nie je recipročná, môže sa predlžovať jedna z telomér bez účasti telomerázy. Od Zakianovej a Petesových pionierskych objavov bolo identifikovaných niekoľko proteínových „hráčov“ tejto dráhy replikácie. Väčšina z nich (napr. proteíny Rad51 a Rad52) sa zúčastňuje napríklad v procese opravy rôznych typov poškodení DNA.
 Analogický rekombinačný systém sa podieľa aj na alternatívnej dráhe replikácie cicavčích telomér. ALT bunkové línie (na rozdiel od línií s aktívnou telomerázou) obsahujú vo svojich jadrách mimochromozómové štruktúry, označované ako APB (ALT-associated PML bodies), ktoré sú zložené z telomerickej DNA, telomerických proteínov a rekombinačných proteínov Rad51 a Rad52. To bol len krok k experimentu, ktorý ukázal, že v bunkách ALT sa teloméry predlžujú mechanizmom využívajúcim výmenu sekvencií DNA (génovú konverziu) (obrázek). Ukázalo sa, že pôvodné odvážne predstavy o využití telomerázových inhibítorov v chemoterapii nádorových buniek sú príliš zjednodušené a že replikáciu jadrových telomér kontrolujú minimálne dva systémy. Situácia je však ešte komplikovanejšia.
Analogický rekombinačný systém sa podieľa aj na alternatívnej dráhe replikácie cicavčích telomér. ALT bunkové línie (na rozdiel od línií s aktívnou telomerázou) obsahujú vo svojich jadrách mimochromozómové štruktúry, označované ako APB (ALT-associated PML bodies), ktoré sú zložené z telomerickej DNA, telomerických proteínov a rekombinačných proteínov Rad51 a Rad52. To bol len krok k experimentu, ktorý ukázal, že v bunkách ALT sa teloméry predlžujú mechanizmom využívajúcim výmenu sekvencií DNA (génovú konverziu) (obrázek). Ukázalo sa, že pôvodné odvážne predstavy o využití telomerázových inhibítorov v chemoterapii nádorových buniek sú príliš zjednodušené a že replikáciu jadrových telomér kontrolujú minimálne dva systémy. Situácia je však ešte komplikovanejšia.
Telomérové slučky
Na chvíľu odbočme od replikácie telomér a pozrime sa bližšie na ich štruktúru. Identifikácia proteínov, ktoré špecificky interagujú s koncami chromozómov, bola ďalšou stratégiou na ceste k spoznaniu mechanizmov udržiavania telomerických sekvencií. Prvý proteín viažuci teloméru (TP) izoloval z makrojadier prvoka Oxytricha nova začiatkom 80. rokov Dan Gottschling. Biochemická analýza odhalila, že väzba proteínu na telomerické prečnievanie konca 3’ je doteraz najstabilnejšou interakciou medzi bielkovinou a nukleovou kyselinou (v podmienkach in vitro sa proteín uvoľňuje približne raz za niekoľko týždňov). Keďže teloméry Oxytricha sú organizáciou i sekvenčne podobné teloméram väčšiny organizmov (vrátane cicavcov), nasledujúcich 15 rokov bolo venovaných pátraniu po proteínoch, ktoré viažu teloméru.Pátranie bolo vzrušujúce predovšetkým kvôli tomu, že okrem makrojadier prvokov nebol proteín podobný TP Oxytricha izolovaný zo žiadneho modelového organizmu. V kvasinkách a rastlinách boli identifikované proteíny, ktoré rozpoznávajú prečnievanie na konci 3’ (napr. proteíny Cdc13 a Est1, ktoré slúžia ako „lákadlo“ pre telomerázový komplex), ich sekvencia a schopnosť viazať DNA sa však od TP Oxytricha značne odlišovali. U cicavcov bola detegovaná doteraz jediná bielkovina, ktorá sa špecificky viaže na jednovláknové telomerické sekvencie.
 Na druhej strane Titia de Langeová izolovala dva proteíny (TRF1 a TRF2), ktoré sa s vysokou afinitou viažu na dvojvláknové časti telomér. Pomerne dlho sa TRF1 a TRF2 považovali za analógy kvasinkového proteínu Rap1, ktorý v 80. rokoch identifikovali David Shore a Kim Nasmyth. Rap1 je promiskuitný proteín, ktorý sa viaže na rôzne sekvencie DNA vrátane dvojvláknových telomerických úsekov. Tam sa okrem iného zúčastňuje na procese „utišovania“ prepisu génov, ktoré sú lokalizované v blízkosti telomér (tzv. telomérovom pozičnom efekte). D. Shore zistil, že kvasinky používajú Rap1 ako proteínové „počítadlo“ telomerických opakovaní. Pred rokom de Langeová dokázala, že cicavce majú svoj vlastný proteín Rap1. Na rozdiel od kvasinkového homológu sa však neviaže s DNA a s telomérami sa spája prostredníctvom TRF1. Bez ohľadu na to sa zdá, že aj cicavčie bunky majú svoje telomérové počítadlo s potenciálnym významom pre regulácie bunkového cyklu a starnutie.
Na druhej strane Titia de Langeová izolovala dva proteíny (TRF1 a TRF2), ktoré sa s vysokou afinitou viažu na dvojvláknové časti telomér. Pomerne dlho sa TRF1 a TRF2 považovali za analógy kvasinkového proteínu Rap1, ktorý v 80. rokoch identifikovali David Shore a Kim Nasmyth. Rap1 je promiskuitný proteín, ktorý sa viaže na rôzne sekvencie DNA vrátane dvojvláknových telomerických úsekov. Tam sa okrem iného zúčastňuje na procese „utišovania“ prepisu génov, ktoré sú lokalizované v blízkosti telomér (tzv. telomérovom pozičnom efekte). D. Shore zistil, že kvasinky používajú Rap1 ako proteínové „počítadlo“ telomerických opakovaní. Pred rokom de Langeová dokázala, že cicavce majú svoj vlastný proteín Rap1. Na rozdiel od kvasinkového homológu sa však neviaže s DNA a s telomérami sa spája prostredníctvom TRF1. Bez ohľadu na to sa zdá, že aj cicavčie bunky majú svoje telomérové počítadlo s potenciálnym významom pre regulácie bunkového cyklu a starnutie.
Charakterizácia cicavčích proteínov TRF1 a TRF2 vyústila do jedného z najzaujímavejších objavov v oblasti telomér z posledných piatich rokov. V 70. rokoch vyvinul Griffith v laboratóriu Arthura Kornberga niekoľko revolučných techník elektrónovomikroskopickej vizualizácie DNA a DNA-proteínových komplexov a odvtedy azda každý zaujímavý proteín viažuci DNA prešiel jeho rukami. Nebolo to inak ani v prípade TRF1 a TRF2, u ktorých si všimol vágnu podobnosť s bakteriálnym proteínom recA, ktorý sa zúčastňuje takmer na všetkých rekombinačných transakciách v Escherichia coli. Potom stačil letmý pohľad na cicavčiu teloméru: prečnievanie konca 3‘ a dvojvláknová oblasť s identickou sekvenciou sú priam ideálnym substrátom pre proteíny podobné recA, ktoré s obľubou katalyzujú prienik jednovláknovej DNA do dvojvlákna za vzniku tzv. D-slučky. Ostávalo dokázať, že cicavčie telomerické proteíny majú podobnú aktivitu, ktorej následkom teloméry cicavcov nekončia „do stratena“, ale tvoria lasovité telomerické slučky (t-slučky, t-loops).
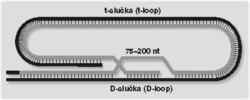 Ako však túto hypotézu testovať experimentálne? Bolo treba prekonať niekoľko problémov: stabilizovať t-slučky, izolovať dostatočne koncentrovanú populáciu telomér, pripraviť elektrónovomikroskopický preparát a zistiť, či možno detegovať koncové lasovité štruktúry (obrázek). V priebehu niekoľkých mesiacov boli tieto problémy vyriešené. Griffith a de Langeová dokázali, že významná časť cicavčích telomér sa skutočne vyskytuje vo forme slučiek, za ktorých tvorbu je zodpovedný proteín TRF2. Výsledky poslali Benovi Levinovi do jedného z najprestížnejších biologických časopisov Cell. Bol nimi taký nadšený, že osobne urýchlil posudzovanie článku, v dôsledku čoho ho prijali do tlače v rekordne krátkom čase: od poslania do prijatia revidovanej verzie uplynulo 18 dní!
Ako však túto hypotézu testovať experimentálne? Bolo treba prekonať niekoľko problémov: stabilizovať t-slučky, izolovať dostatočne koncentrovanú populáciu telomér, pripraviť elektrónovomikroskopický preparát a zistiť, či možno detegovať koncové lasovité štruktúry (obrázek). V priebehu niekoľkých mesiacov boli tieto problémy vyriešené. Griffith a de Langeová dokázali, že významná časť cicavčích telomér sa skutočne vyskytuje vo forme slučiek, za ktorých tvorbu je zodpovedný proteín TRF2. Výsledky poslali Benovi Levinovi do jedného z najprestížnejších biologických časopisov Cell. Bol nimi taký nadšený, že osobne urýchlil posudzovanie článku, v dôsledku čoho ho prijali do tlače v rekordne krátkom čase: od poslania do prijatia revidovanej verzie uplynulo 18 dní!
Levinovo nadšenie bolo pochopiteľné. Objav t-slučiek naznačil riešenia viacerých telomerických záhad. Ochranu proti nukleázam a reparačným systémom bunky zabezpečuje špeciálna štruktúra teloméry. A čo je azda najpodstatnejšie, t-slučka predstavuje možné riešenie replikácie telomér, ktoré je nezávislé od telomerázy: vnorením prečnievania konca 3‘ do dvojvláknovej telomerickej oblasti získava štandardná DNA-polymeráza primer (obrázek) aj templát, ktorý jej v prípade „voľného“ zakončenia teloméry chýba (obrázek).
Zdá sa, že telomerické slučky nemajú iba cicavce. Nedávno boli identifikované aj u trypanozóm a, možno paradoxne, aj u Oxytricha. Teda u tých istých prvokov, z ktorých bol izolovaný prvý telomerický proteín špecifický k jednovláknovému prečnievaniu na konci 3‘. Vysvetlenie tohto paradoxu je v dvojtvárnosti makro- a mikrojadier týchto prvokov. V makrojadrách sú teloméry veľmi krátke, čo im znemožňuje ohýbanie a tvorbu slučiek. Namiesto lasovitých štruktúr ich chráni telomerický proteín. V mikrojadre tento proteín nie je potrebný. Dĺžka mikrojadrových telomér im umožňuje tvorbu t-slučiek analogických so slučkami cicavcov. Oxytricha teda predstavuje unikátny príklad riešenia toho istého problému dvoma dramaticky odlišnými stratégiami v jednej a tej istej bunke. 1)
Poznámky
Slovníček
DNA-polymeráza – Enzým katalyzujúci syntézu dcérskeho vlákna DNA polymerizáciou jeho stavebných jednotiek, nukleotidov.
ALT – Alternative Lenghtening of Telomeres. Termín zaviedol Roger Reddel pre mechanizmy replikácie telomér bez účasti telomerázy.
D-slučka (č. D-smyčka) – Štruktúra tvaru písmena D, ktorá vzniká v dôsledku vytesnenia jedného z vláken DNA jednovláknovým úsekom nukleovej kyseliny.
est mutanty – (Ever Shorter Telomeres). Mutanty Saccharomyces cerevisiae, u ktorých dochádza k progresívnemu skracovaniu telomér a po niekoľkých generáciách k postupnej strate proliferačnej aktivity.
FISH – Fluorescent in situ hybridization.
imortalizácia – Proces, pri ktorom sa z pôvodne smrteľnej bunkovej kultúry stáva nesmrteľná bunková línia.
makrojadro – Transkripčne aktívne jadro niektorých prvokov, ktoré vzniká fragmentáciou chromozómov mikrojadra a nasledujúcou amplifikáciou fragmentov DNA na niekoľko tisíc kópií. Každý fragment je opatrený identickou telomerickou sekvenciou.
mikrojadro – Transkripčne neaktívne jadro niektorých prvokov, ktoré slúži ako genetická jednotka.
PML – Promyelocytic leukemia
SSB proteíny – (Single-Stranded DNA Binding proteins). Proteíny, ktoré sa s vysokou afinitou a bez sekvenčnej preferencie viažu na jednovláknovú DNA. Ich hlavná úloha spočíva v zabraňovaní reasociácie dvoch komplementárnych vláken DNA počas replikácie a rekombinácie.
tandemová repetícia – Sekvencia DNA, ktorá sa v tej istej orientácii opakuje niekoľkokrát za sebou.
telomeráza – DNA-polymeráza závislá od RNA, predlžujúca prečnievanie na telomerickom konci 3’. Je zložená z RNA-podjednotky plniacej úlohu templátu a katalytickej proteínovej podjednotky.
teloméra – (Gr. telos, koniec, meros, časť). Štruktúra na konci lineárneho chromozómu zabezpečujúca jeho ochranu pred degradáciou a fúziou s inými chromozómami.
telomérový pozičný efekt – Represia (umlčanie) prepisu génu lokalizovaného do oblasti telomerického chromatínu.
transpozón – Segment DNA, ktorý sa môže pohybovať z miesta na miesto v genóme tej istej bunky. Významný zdroj genetickej variability.
t-slučka (č. t-smyčka) – Lasovitá štruktúra na konci cicavčích chromozómov, ktorá vzniká vnorením telomerického prečnievania na konci 3’ do dvojvláknovej telomerickej oblasti. Zabezpečuje ochranu telomér pred degradáciou a DNA-opravnými systémami bunky i alternatívny spôsob ich replikácie.
Teloméry, telomeráza, starnutie a nesmrteľnosť
Začiatkom 90. rokov už konečne boli k dispozícii prostriedky na testovanie Olovnikovovej hypotézy: bola známa sekvencia telomér a bolo teda možné zmerať ich dĺžku v rôznych typoch buniek. Prvýkrát podnikli takúto exkurziu Calvin B. Harley, Carol Greiderová a Nicholas D. Hastie. Výsledky boli veľmi povzbudivé. V somatických bunkách dochádzalo s vekom k ich skracovaniu. Naopak, ako dokázal Howard J. Cooke, zárodočné bunky disponovali dlhými telomérami bez náznakov skracovania. Pôvodné výsledky využívajúce klasické techniky DNA-DNA hybridizácie boli v zásade potvrdené aj sofistikovanejšími analýzami (napr. fluorescent
Analýza rôznych typov nádorov v laboratóriách Calvina Harleya a Jerryho W. Shaya odhalila, že väčšina z nich má teloméry stabilnej dĺžky bez náznakov skracovania. Zárodočné bunky a bunky s vysokým proliferačným potenciálom vykazovali telomerázovú aktivitu, somatickým bunkám podliehajúcim starnutiu telomeráza chýbala a väčšina nádorových buniek prekročila Hayflickov limit a telomeráza bola opätovne aktívna. Farmaceutické firmy začali zháňať odborníkov na telomerázu s víziou prípravy telomerázového inhibítora ako univerzálneho prostriedku boja proti nádorovým chorobám. Ich nadšenie však narazilo na prekážku: akokoľvek je telomeráza elegantným riešením problému replikácie koncov jadrových chromozómov, teloméry sú priveľmi dôležitou štruktúrou chromozómu, aby sa spoliehali len na jeden mechanizmus údržby. Boli objavené nádorové bunkové línie (10 % zo všetkých testovaných línií), ktoré nemali detegovateľnú telomerázovú aktivitu, a predsa sa ich teloméry vyznačovali stabilnou dĺžkou. Myš bez funkčnej telomerázy (následkom delécie génu pre RNA-podjednotku), ktorú skonštruovala Maria Blascová, nevykazovala rezistenciu voči vytváraniu nádorov. Tieto a ďalšie výsledky naznačili, že replikácia cicavčích telomér je pod komplexnou kontrolou.
Revízia telomérovej hypotézy bunkového starnutia a nesmrteľnosti
Pôvodná telomérová hypotéza predpokladala, že dĺžku telomér udržiava aktivita telomerázy len v zárodočných bunkách. V ľudských somatických bunkách je v dôsledku ich diferenciácie produkcia tohto enzýmu potlačená. Vypnutie telomerázovej aktivity má s rastúcim počtom bunkových delení za následok postupné skracovanie dĺžky koncov chromozómov, pričom po dosiahnutí ich kritickej dĺžky bunka vstúpi do fázy starnutia. Úlohu telomerázy ako faktora rozhodujúceho o nesmrteľnosti buniek potvrdzovala jej aktivita v bunkách väčšiny nádorov a nesmrteľných bunkových línií. Podobne aj v experimentoch s umelo navodenou tvorbou telomerázy umožnila jej aktivita delenie buniek fibroblastov v čase, keď kontrolné línie boli už dávno vo fáze starnutia. Preto sa podľa telomérovej hypotézy považuje skracovanie telomér za mechanizmus potláčajúci vznik nádorov a reaktivácia telomerázy je nevyhnutným krokom ku vzniku nesmrteľných bunkových línií. Z tohto hľadiska inhibítory telomerázy predstavovali nádejný prostriedok v terapii nádorových ochorení. 
Avšak situácia je zložitejšia než opisuje tento jednoduchý model a spomínaná hypotéza musela byť modifikovaná (obrázek). Prvou komplikáciou je fakt, že telomeráza je aktívna aj v normálnych somatických bunkových líniách s vysokou proliferačnou kapacitou (napr. bunkách imunitného systému, kože, vlasových folikulov). Ďalšie pozorovania ukázali, že v niektorých prípadoch sa môže telomeráza znovu aktivovať ešte pred vstupom buniek do fázy starnutia. Alebo sa naruší rovnováha medzi procesmi predlžovania a skracovania, pričom sa dĺžka telomér zväčší. Naviac – v približne 10 % nádorov a nesmrteľných bunkových línií aktivita telomerázy nie je detegovateľná. Hoci by sa na prvý pohľad mohlo zdať, že je to spôsobené chybou v rutinnej laboratórnej diagnostike, štúdie viacerých bunkových linií ukázali, že ich teloméry sa predlžujú alternatívnym mechanizmom nezávislým od telomerázy. Vzhľadom na to, že takéto alternatívne dráhy môžu pracovať paralelne s telomerázou, alebo môžu byť špecificky indukované v bunkách, v ktorých bola jej aktivita vyradená použitím inhibítorov, tieto mechanizmy predstavujú nielen zaujímavý biologický fenomén, ale zároveň aj závažný terapeutický problém.
Najnovšia korekcia hypotézy vychádza zo skutočnosti, že samotná dĺžka polí telomerických repetícií sa neukázala ako dostatočne spoľahlivý molekulárny marker starnutia alebo nesmrteľnosti buniek. Podľa Blackburnovej je viac než samotná dĺžka dôležitá jedna z esenciálnych funkcií telomér, ktorá je v angličtine nazývaná capping. Táto funkcia zabezpečuje integritu chromozómov, ochranu pred enzymatickou degradáciou, zabraňuje vzájomnej fúzii chromozómov a maskuje teloméru pred rozpoznaním opravnou mašinériou. Funkcia je závislá nielen od dĺžky polí telomerických repetícií, ale aj od aktivity telomerázy a špecifických proteínov viažucich telomerickú DNA. Ak koniec chromozómu nie je chránený, dochádza k zastaveniu bunkového cyklu, prípadne k ďalším následkom (napr. k programovanej smrti bunky). Preto je ochranná funkcia telomér, bez ohľadu na ich dĺžku, kľúčovým faktorom rozhodujúcim o osude chromozómu i samotnej bunky.
Ke stažení
 Článek ve formátu PDF [931,73 kB]
Článek ve formátu PDF [931,73 kB]