Biočipová revoluce v DNA laboratořích?
Po několika letech přibývajících záchvěvů se zdá jasné, že k erupci nových technik v molekulární genetice dojde ještě do konce tisíciletí. Nepůjde zřejmě o metody založené na nově objevených principech, ale o miniaturizaci dnes běžně používaných procesů, která umožní provádět velké množství reakcí na malé ploše (tedy i současně). Miniaturizovaných přístupů je mnoho a různé výrobní společnosti je propracovávají do podoby přístrojů použitelných nejen na výzkumných pracovištích, ale hlavně v laboratořích zabývajících se rutinní diagnostikou. Dnes je těchto výrobců asi 15, ale před třemi lety se dali spočítat na prstech jedné ruky. Většina jich je z Kalifornie a jejich přehled není nezajímavý (viz rámeček 1 ).
 Bohužel i v rozvoji technologií platí pro Evropu totéž, co pro jiné moderní vědecké postupy. Pokud se vývojové laboratoře nepřestěhují z Evropy do USA, kde mají lepší podmínky včetně větší svobody (příkladem mohou být skotské a holandské laboratoře klonující zvířata), je jejich postup vpřed mnohem obtížnější. Mají sice možnost rozvíjet se na „akademické půdě“, ale s velmi omezenými prostředky a do rozvoje nových technických vymožeností patrně zasáhnou spíše na úrovni teoretické. Ložiska snah rozvíjet tuto oblast výzkumu najdeme i v bývalém Sovětském svazu. Někteří z průkopníků tohoto odvětví odešli do USA, kde se stali vedoucími pracovních týmů výrobních společností, a přitom si ponechávají vedoucí pozice i na domácí akademické půdě. Tak vlastně znásobují své vědecké kapacity (Skolnick, JAMA 1996). Málem jsem prohlásil svou vlast v tomto směru za zanedbanou, ale není to úplně pravda. V Praze na Vysoké škole chemicko-technologické a v Ústavu organické chemie a biochemie AV ČR, a zejména v Brně v Biofyzikálním ústavu AV ČR nejsou dané problematice příliš vzdáleni. Průmyslovou a obchodní stránkou těchto problémů se možná zabývá nějaká kompetentní instituce, třeba obchodní komora, zatím však je „laboratorní technika“ u nás jedním z nejopomíjenějších, a přitom potencionálně nejlukrativnějších průmyslových odvětví.
Bohužel i v rozvoji technologií platí pro Evropu totéž, co pro jiné moderní vědecké postupy. Pokud se vývojové laboratoře nepřestěhují z Evropy do USA, kde mají lepší podmínky včetně větší svobody (příkladem mohou být skotské a holandské laboratoře klonující zvířata), je jejich postup vpřed mnohem obtížnější. Mají sice možnost rozvíjet se na „akademické půdě“, ale s velmi omezenými prostředky a do rozvoje nových technických vymožeností patrně zasáhnou spíše na úrovni teoretické. Ložiska snah rozvíjet tuto oblast výzkumu najdeme i v bývalém Sovětském svazu. Někteří z průkopníků tohoto odvětví odešli do USA, kde se stali vedoucími pracovních týmů výrobních společností, a přitom si ponechávají vedoucí pozice i na domácí akademické půdě. Tak vlastně znásobují své vědecké kapacity (Skolnick, JAMA 1996). Málem jsem prohlásil svou vlast v tomto směru za zanedbanou, ale není to úplně pravda. V Praze na Vysoké škole chemicko-technologické a v Ústavu organické chemie a biochemie AV ČR, a zejména v Brně v Biofyzikálním ústavu AV ČR nejsou dané problematice příliš vzdáleni. Průmyslovou a obchodní stránkou těchto problémů se možná zabývá nějaká kompetentní instituce, třeba obchodní komora, zatím však je „laboratorní technika“ u nás jedním z nejopomíjenějších, a přitom potencionálně nejlukrativnějších průmyslových odvětví.
Biočip a jeho předchůdci
Pod termínem biočip se neskrývá jen integrovaný obvod nebo soustava obvodů a neomezuje se na polovodičovou technologii. Jeho pojmový obsah je mnohem širší. V anglosaské literatuře je téměř synonymem termín „array“, s jehož výstižným převodem do češtiny jsem měl nemalé potíže – v různých oborech se používají různé české ekvivalenty. Kupodivu biočipu nejlépe odpovídá překlad array z vojenské terminologie: šik – soubor základních funkčních jednotek sestavený k plnění úkolu. Má dokonce i záviděníhodnou krátkost a je v češtině vžitý.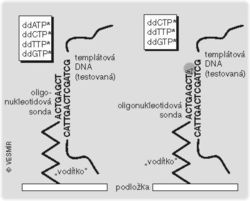 Z funkčního hlediska lze za předobraz biočipu považovat membrány s nanesenými sondami, na nichž pomocí hybridizace (Vesmír 77, 312, 1998/6) vybíráme ze vzorku komplementární úseky DNA (nebo RNA). Dodavateli těchto (dnes již průmyslově vyráběných) membrán jsou např. firmy Genomic Systems Inc. (membrána klasické velikosti 22 × 22 cm s 36 864 ploškami různých DNA sond reprezentuje 18 394 genů) a společnost Genetic Research vyrábějící membránu velikosti 5 × 7 cm, na níž je naneseno několik tisíc sond (3000 v případě kvasinkového genomu). O skutečném biočipu můžeme hovořit tehdy, když je membránový nosič sond nahrazen skleněnou destičkou velikosti poštovní známky a nese statisícový počet funkčních míst. Na rozdíl od membrán, které si můžeme v každé průměrně vybavené DNA laboratoři připravit ručně, se skleněné destičky většinou vyrábějí průmyslově. Technologie jejich výroby jsou podobné postupům používaným v elektrotechnickém průmyslu.
Z funkčního hlediska lze za předobraz biočipu považovat membrány s nanesenými sondami, na nichž pomocí hybridizace (Vesmír 77, 312, 1998/6) vybíráme ze vzorku komplementární úseky DNA (nebo RNA). Dodavateli těchto (dnes již průmyslově vyráběných) membrán jsou např. firmy Genomic Systems Inc. (membrána klasické velikosti 22 × 22 cm s 36 864 ploškami různých DNA sond reprezentuje 18 394 genů) a společnost Genetic Research vyrábějící membránu velikosti 5 × 7 cm, na níž je naneseno několik tisíc sond (3000 v případě kvasinkového genomu). O skutečném biočipu můžeme hovořit tehdy, když je membránový nosič sond nahrazen skleněnou destičkou velikosti poštovní známky a nese statisícový počet funkčních míst. Na rozdíl od membrán, které si můžeme v každé průměrně vybavené DNA laboratoři připravit ručně, se skleněné destičky většinou vyrábějí průmyslově. Technologie jejich výroby jsou podobné postupům používaným v elektrotechnickém průmyslu.
Biočipy na skle
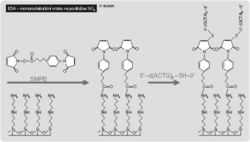
Některé způsoby přípravy biočipů se mohou uplatnit přímo ve výzkumné laboratoři. Na mikroskopická podložní skla se mikromanipulátorem nanesou sondy ve stanoveném uspořádání. Skleněný povrch destičky se ovšem musí upravit tak, aby na něm nanášené sondy zůstaly pevně ukotveny. Někdy se sklíčka upravují tak, aby místa kolem nanášených sond nebyla pouze inertní nebo neutrální, ale přímo odpudivá, což zpřesňuje jejich ohraničení a zmenšuje plošky s připevněnými sondami. Tyto sondy musí být dostupné pro molekuly nukleových kyselin ze zkoumaného roztoku. Proto není vhodné, aby sondy byly k povrchu destičky připoutány příliš těsně, ale potřebují jistou volnost pohybu, asi jako pes na vodítku. Optimální délka „vodítka“ se pohybuje mezi 40 až 60 atomy a ukotvení se děje silanizací povrchu destičky (obr. obrázek). K ukotvení řetězců nukleových kyselin může být též použita vrstva aminovaného polypropylenu a další látky.Skládání nukleotidových řetězců – biočipové sondy
Potřebné aktivní a neaktivní plošky se vytvářejí např. ozářením laserem (193 nm). Na nezastíněných ploškách se fotolýzou odstraní aktivní monomolekulární vrstva. Zrušením vazeb Si–C se obnaží povrch oxidovaného křemíku a pouze v místě zastínění zůstane aktivní aminosilan. Tak lze oddělit aktivní plošky široké 2 mikrometry mezerami o šířce 1 mikrometru. Stejný princip fotoaktivace nebo inaktivace se používá při syntéze oligonukleotidů. Zastiňováním a osvětlováním připravíme k připojení dalšího nukleotidu jen vybrané cílové plošky a můžeme tak syntetizovat řetězce oligonukleotidových sond nejen zvolené sekvence, ale i na zvolených místech. Takto vyrábí své biočipy např. firma Affymetrix (obr. obrázek obrázek obrázek).Postupným a střídavým zastiňováním (a ozařováním) můžeme připojovat k řetězci oligonukleotidové sondy další nukleotidy tak, aby příslušný biočip obsahoval všechny možné sekvence pro danou délku. Např. pro 8nukletidovou sekvenci potřebujeme biočip o 65 536 pracovních ploškách (48 možných kombinací čtyř různých nukleotidů v 8nukleotidovém řetězci). Podle odhadů z r. 1996, kdy se na 1 cm2 mohlo vejít 20 až 30 tisíc těchto plošek (o velikosti cca 20 × 20 mikrometrů), bychom biočipy potřebovali dva. Dnes se všechny plošky vejdou na jeden a předpokládá se, že v blízké budoucnosti bude možné vyrábět biočipy až se 400 000 různými oligonukleotidovými sondami.
Všechny dosud zmíněné biočipy jsou založeny na principu hybridizace (spojování komplementárních úseků nukleotidových kyselin). Hybridizační reakce se využívá k vyhledávání komplementárních sekvencí v analyzovaných vzorcích, a to jak pro nalezení konkrétní podobnosti (alelické specifičnosti), tak pro určení sekvence nukleotidů ve zkoumaných nukleových kyselinách. Alelickou specifickou hybridizační reakcí by se daly identifikovat pomocí jednoho biočipu téměř všechny dnes známé patogenní mutanty daného genu včetně běžné variability každého z jejich známých genů.
Elektrobiočipy
Kromě ovládání tvorby vodíkových vazeb teplotou, iontovou silou prostředí a koncentrací vodíkových iontů lze použít – a na tom je založena zvláštní skupina hybridizačních čipů – elektrické pole. Takovým biočipům se dá říkat mikroelektročipy nebo elektrobiočipy a při práci s nimi se používají pufry o nízké vodivosti. Na rozdíl od dříve uvedených „pasivních“ biočipů, které vyžadují, aby všechny upevněné sondy reagovaly přibližně za stejných podmínek (měly vhodnou délku, obsah G a C bází a sekundární strukturu), v případě „aktivních“ mikroelektročipů je možné vedle parametrů, které jsou všem pracovním ploškám v mikročipu společné, použít pro každou navíc individuální parametr daný napětím, které se sem zavede. Tak můžeme v rámci jednoho čipu měnit podmínky pro každou z jednotlivých pracovních plošek zvlášť. Můžeme místně zvyšovat nebo snižovat koncentraci testované nukleové kyseliny, k něteré plošce ji přitahovat, anebo od ní odpuzovat.Od zachycení bílé krvinky k „biočipovým strojům“
Samostatnou skupinu těchto mikropřístrojů tvoří biočipy, jejichž činnost není založena na hybridizační reakci, ale mají jinou funkci. Některé z nich jsou konstruovány tak, aby dělily buňky podle velikosti a slouží k získání DNA ze zachycených bílých krvinek. V jiných se provádí řetězová polymerázová reakce (PCR, viz Vesmír 77, 444, 1998/8). Některé společnosti se pokoušejí sestavit „ministroj“, který by buňky roztřídil, izoloval z nich DNA, zmnožil její příslušné úseky (např. geny), ty porovnal se sondami, produkty detegoval a nakonec všechno vyhodnotil – stroj by tedy ve sledu na sebe navazujících operací separoval buňky, izoloval DNA, amplifikoval, hybridizoval, detegoval a vyhodnocoval. Blížíme se k laboratoři, která se vejde na pracovní stůl a jejíž základní složky nebudou větší než krabička sirek. Přitom výkon takové „minilaboratoře“ mnohonásobně předčí výkon mnoha desítek laboratoří současných. První „biočipové stroje“ tohoto typu jsou již na světě (Affymetrix GeneChip Fluidics Station 400).Mikrocyklery
 Nezávisle na vývoji biočipů znásobují cyklery, dnes snad nejběžnější přístroje DNA laboratoří, své schopnosti amplifikace (zmnožování úseků nukleových kyselin) nejenom v počtu možných programů, ale také v množství vzorků současně amplifikovaných. Přestože by dnešní cyklery byly schopny z hlediska programového ovládání řídit i několik desítek výkonných jednotek (bloků), ovládají většinou jen 2 až 4. Množství vzorků amplifikovaných zároveň v jednom bloku se zvýšilo tak, že se od běžných destiček s 96 jamkami přechází na dvojnásobný až čtyřnásobný počet, tj. 384 jamek. To již však je pro ruční nanášení různých vzorků kritické množství.
Nezávisle na vývoji biočipů znásobují cyklery, dnes snad nejběžnější přístroje DNA laboratoří, své schopnosti amplifikace (zmnožování úseků nukleových kyselin) nejenom v počtu možných programů, ale také v množství vzorků současně amplifikovaných. Přestože by dnešní cyklery byly schopny z hlediska programového ovládání řídit i několik desítek výkonných jednotek (bloků), ovládají většinou jen 2 až 4. Množství vzorků amplifikovaných zároveň v jednom bloku se zvýšilo tak, že se od běžných destiček s 96 jamkami přechází na dvojnásobný až čtyřnásobný počet, tj. 384 jamek. To již však je pro ruční nanášení různých vzorků kritické množství.
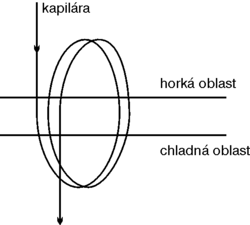
Mikrocyklery zůstávají zatím u nejmenšího počtu (jeden mikrocykler = jeden vzorek), jejich hlavní výhodou je však nepoměrně menší velikost a vyšší rychlost. Ohřívání a chlazení v nich probíhá mnohem rychleji. V poměru k objemu vzorku je plocha, na niž se teplo převádí, mnohem větší. Rychlost ohřívání je u dnešních nejlepších cyklerů 3 °C za sekundu a ochlazování je ještě pomalejší. Průměrný rozdíl mezi krokem „rozplétajícím“ dvoušroubovici DNA (denaturací) a krokem, při kterém se DNA zase správně „skládá“, je 30 °C. Přechod tedy trvá nejméně 10 vteřin. U mikrocykleru je tento teplotní přechod téměř okamžitý také proto, že průměrná „tloušťka“ vzorku v jamce je několik milimetrů, kdežto v mikrocykleru méně než jeden, ačkoliv mezi objemy již takový rozdíl není (i u mikrocykleru se pohybuje mezi 5 až 15 mikrolitry). Zdá se, že také amplifikace, zůstane-li nezbytným krokem analýzy, bude muset použít nové konstrukční nápady, aby i biočip pro polymerázovou reakci zvládl najednou mnoho vzorků. Jednou z možností je „kontinuální amplifikace v kapiláře“, jejíž princip je znázorněn na obrázku. V tomto uspořádání odpovídá počet smyček počtu cyklů. Dobu denaturace, spojování s primery a syntetické fáze lze měnit velikostí částí smyček ponořených v prostředí s určitou teplotou a lze ovládat i celkovou rychlost průtoku kapilárou. Množství produktů lze měřit nejen u „výtoku“, ale i během reakce v jakékoli smyčce. Čipy tohoto typu se již objevily, jak ukazuje článek v Science 280, 1046, 1998.
Zasáhne biočipová revoluce naše laboratoře?
Nová technologie nabízí ohromné zvýšení výkonu, menší nárok na prostor, nižší spotřebu materiálu včetně vyšetřovaných vzorků a pochopitelně i méně ruční práce. Momentálně biočipová technologie vyžaduje asi 2 mikrolitry krve, ze které oddělí a lyzuje bílé krvinky. Uvolněná DNA se pak zpracovává v dalším biočipu. Filtrační biočipy používají dělení buněk podle velikosti a konstruktéři jsou přesvědčeni, že zvládnou ještě podrobnější dělení buněk.Pokud budou biočipy použity jako diagnostické mikropřístroje v lékařství, bude to znamenat menší nároky na pacienta, zkrácení doby mezi odběrem a výsledkem a přes vysoké investiční náklady (komplet firmy Affymetrix stojí zhruba 135 000 dolarů) jistě přinese i relativní zlevnění DNA diagnostiky. Zatím totiž jeden biočip s nanesenými sondami pro detekci HIV, pro geny z oblasti nádorové predispozice P53, nebo pro geny ovládající metabolizmus xenogenních látek – farmak (CYP450) stojí přibližně 100 až 150 dolarů. Musíme si však uvědomit, že ačkoliv jedno vyšetření bude stát méně, počet vyšetření značně stoupne. Mimo jiné proto, že budeme znát více a více genů i jejich forem.
Naše možnosti se díky propojování různých vědeckých disciplín (v našem případě např. výpočetní techniky, robotiky a molekulární genetiky) neustále zvětšují a rozšiřují. Bylo by zpátečnické se tomuto vývoji bránit. Na druhé straně je někdy náročné se mu přizpůsobit, natož ho podporovat, o čemž svědčí naivní představy, že náklady na zdravotnictví lze omezit nějakým pevným stropem.
Výrobci biočipů
Affymetrix (CA, USA)
Brax (Cambridge, UK)
Clontech (CA, USA)
Genome Systems Inc. (MI, USA)
Hyseq (CA, USA)
Incyte Pharmaceuticals (CA, USA)
Molecular Dynamics (CA, USA)
Nanogen (CA, USA)
Protogene Laboratories (CA, USA)
Sequenom (Hamburg, DE)
Synteni (CA, USA)
German Cancer Inst. (Heidelberg, DE)
[Podle seznamu přednášek na nedávném sympoziu v Sestri Levante, doplněno o dvě firmy uvedené v článku A. Marshalla a J. Hodgsona, Nature Biotechnology 16, 1998]
Mendel by se nestačil divit
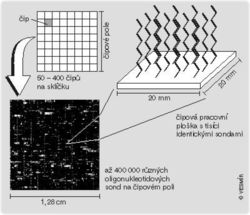
Molekulární genetici miniaturizují a rafinovaně využívají osvědčené principy zkoumání nukleových kyselin. Na skleňenou podložku velikosti mikroskopického podložního sklíčka lze umístit až stovky biočipů (viz obrázek - co čtvereček, to čip). Jednotlivé malinké čipy se skládají z ještě nepatrnějších plošek o mikromilimetrových velikostech, na nichž jsou přilepeny oligonukleotidové sondy přesně definované krátké řetězce nukleových kyselin o známém pořadí bází ACGT. Každá tato ploška nese řádově tisíce zcela stejných sond a na biočipu lze těchto plošek obsahujících různésondy stěsnat statisíce. Jestliže se na biočip naleje roztok s neznámým úsekem nukleové kyseliny (třeba genem v konkrétní, tedy alelické podobě), může zkoumaný úsek hybridizovat (tj. komplementárně se spojit podle odpovídajících bází tak, aby se A(deninová) báze neznámého úseku přiložita k T(yminové) bázi sondy, C ke G, T k A a G k C). Místa hybridizace se dají zviditelnit, např. fluorescenční barvou, a plošky, na nichž k hybridizaci došlo, potom zasvítí (obrázek představuje úseky šesti membránových čipů s jednotlivými ploškami). Protože se musíme orientovat ve statisícovém množství svítících, nesvítících či různě svítících signálů, vyhodnocení provádí počítač. Další rafinovaností je to, že sondy se syntetizují až na ploškách biočipů, a to po jednotlivých bázích (tedy nukleosidech), nepřilepují se proto již někde jinde vyrobené celé oligonukleotidové sondy. K těmto postupům se využívají fotolitografické techniky, na obrázku je postup firmy Affymetrix. Pomocí jediného a stále stejného biočipu tak můžeme identifikovat obrovské množství různých řetězců DNA každá kombinace svítících plošek odpovídá něčemu jinému.
Ke stažení
 Článek ve formátu PDF [344,46 kB]
Článek ve formátu PDF [344,46 kB]