Trypanozomy – mistři v převlékání kabátů
 Trypanozomy byly poprvé pozorovány v krvi pstruhů v polovině minulého století a od té doby je zoologové popsali ve stovkách druhů bezobratlých, obratlovců a rostlin. Opravdovou pozornost na sebe upoutaly však až poté, co se před 100 lety podařilo kapitánu D. Bruceovi prokázat souvislost mezi jejich výskytem v lidské krvi a spavou nemocí (v jazyce zulu nagana – ztráta duše), která sužovala a stále sužuje obyvatelstvo velké části Afriky.
Trypanozomy byly poprvé pozorovány v krvi pstruhů v polovině minulého století a od té doby je zoologové popsali ve stovkách druhů bezobratlých, obratlovců a rostlin. Opravdovou pozornost na sebe upoutaly však až poté, co se před 100 lety podařilo kapitánu D. Bruceovi prokázat souvislost mezi jejich výskytem v lidské krvi a spavou nemocí (v jazyce zulu nagana – ztráta duše), která sužovala a stále sužuje obyvatelstvo velké části Afriky.
Trypanozomy jsou řazeny do řádu Kinetoplastida, který představuje zajímavou společnost; patří sem neškodní a všudypřítomní bodové, kteří pomáhají v našich čističkách odpadních vod, fytomonády, které hubí kokosové plantáže, leishmanie, vytvářející vředy i smrtelná onemocnění, a konečně i trypanozomy, působící spavou nemoc (T. brucei) či Chagasovu chorobu (T. cruzi), které zná pod označením krevní bičivky snad každý.
Zejména díky parazitickým druhům se bičíkovci stali středem pozornosti v posledních zhruba 15 letech v souvislosti s nástupem molekulární biologie. Ukázalo se, že tato skupina prvoků představuje jedny z nejstarších mitochondriálních eukaryot, tj. organizmů, které se oddělily od eukaryotické větve krátce poté, co došlo k endosymbióze bakterií a jejich přeměně v mitochondrie, tak jak je dnes nalézáme v téměř každé eukaryotické buňce. Snad právě díky tomuto stáří se u trypanozom vyskytují zcela jedinečné mechanizmy, jejichž studium přilákalo značný zájem. Jako příklad těchto jedinečností můžeme uvést editování RNA (viz např. Vesmír 73, 365, 1994/7), trans-splicing, polycistronickou transkripci, organizaci mitochondriální (kinetoplastové) DNA či variabilní povrchový glykoprotein (variant surface glycoprotein – VSG). Právě posledně jmenovaná vlastnost ukazuje, jak záludný trik vymyslely trypanozomy během stamilionů let strávených v krvi nešťastných hostitelů.
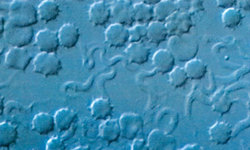
Za výhody, které skýtá život v hostiteli, musí každý parazit čelit hostitelovým obranným mechanizmům. Trypanozomy, plovoucí volně v krevním řečišti, se potýkají především s protilátkami namířenými proti jejich povrchovému antigenu. Důsledkem této vazby je lýze parazitárních buněk způsobená makrofágy, vázajícími se na protilátky. Trypanozomy se však naučily svůj povrchový protein měnit a unikat tím hostitelské obraně.
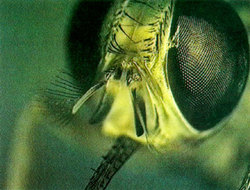
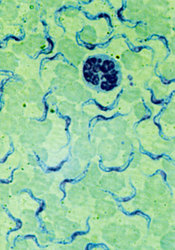
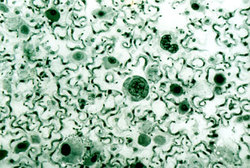
Infekce začíná vpichem několika trypanozom při bodnutí mouchou tse-tse (Glossina spp.) do krve a ty se v prostředí plném živin začínají intenzivně množit. Zhruba 5 dní trvá hostiteli tvorba protilátek vázajících se specificky na povrch trypanozom a působících jejich lýzi. Právě v té době se však již některým parazitům podaří změnit si povrchový protein na jinou formu a unikají tím obranné reakci hostitele. 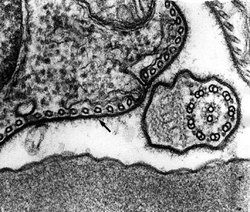
Spavá nemoc tedy probíhá ve vlnách, při nichž většina prvoků (až 95 %) zahyne a přeživší jedinci se znovu začnou intenzivně množit. Tento průběh byl zjištěn již na počátku našeho století a poměrně dlouho se také ví, že povrchový protein je u jednotlivých klonů (populace trypanozom pocházející z jediné buňky) odlišný a obměňuje se i v kultuře bez vlivu protilátek. Podrobné studium vyvrátilo dlouho tradovaný názor, že se typ povrchového proteinu mění podle pevně stanoveného sledu, tj. VSG-A je nahrazen VSG-B a poté následuje VSG-C atd. Typ povrchového proteinu totiž nelze předpovědět už kvůli počtu možností (podle posledních hybridizačních studií je v genomu trypanozom rozptýleno až kolem 1000 odlišných genů pro povrchový protein). Mechanizmus, který umožňuje bičíkovcům měnit ve vhodném okamžiku svůj variabilní povrchový protein, byl popsán poměrně nedávno a – jak soudím podle příspěvků na loňském kongresu ve Woods Hole – patří stále mezi nejvíce studované procesy molekulární parazitologie.
Aktivní gen povrchového proteinu je lokalizován v tzv. expresním místě poblíž telomery (přirozeného zakončení chromozomu). Toto expresní místo je spolu s řadou přidružených genů přepsáno do jediné obrovské poslíčkové (m)RNA, která je až posléze rozštípána na molekuly mRNA příslušející jednotlivým genům. Tato tzv. polycistronická transkripce je další jedinečností trypanozom; každá mRNA je, podobně jako u všech eukaryot, opatřena na jednom (3') konci sérií adeninů (tzv. polyadenylace), úprava druhého (5') konce je však vysoce specifická pro trypanozomy a spočívá v připojení 39 nukleotidů dlouhého úseku RNA, kódovaného na úplně jiném chromozomu. Smysl této náročné činnosti, spočívající v opatřování každé mRNA touto tzv. vodící sekvencí, zůstává záhadou.
Vraťme se však zpět ke genům povrchového proteinu. Antigenní variace trypanozom je umožněna vnesením nového genu povrchového proteinu do expresního místa nebo zapnutím jiného expresního místa, jichž je v genomu alespoň kolem dvaceti. Již zmíněných 1000 genů představuje obrovský potenciál, který je podle nejnovějších studií ještě zvýšen schopností trypanozom tuto sadu plasticky obměňovat (viz dále). Vlastní funkce celého aparátu lze přirovnat k hudebnímu automatu. Jednotlivé desky (geny povrchového proteinu) jsou vsunovány do magnetické hrací hlavy (expresního místa), a po přehrání nahrazeny jinou deskou. Představa je zjednodušena v tom smyslu, že příslušný gen povrchového proteinu je těsně před svou aktivací zdvojen a do expresního místa je zasunuta čerstvě vytvořená kopie, zatímco původní verze zůstává v genomu na svém místě (tzv. duplikativní transpozice). Po určitém počtu dělení se do expresního místa zasune jiný gen povrchového proteinu a vznikne antigenně odlišný protein. V tom okamžiku je povrch trypanozomy stále ještě tvořen původním variabilním povrchovým proteinem a je nahrazován novým. Počítačové modelování různých povrchových proteinů prokázalo, že i přes výrazně odlišnou skladbu aminokyselin se uspořádávají do podobných, vzájemně kompatibilních trojrozměrných struktur. Tento mechanizmus je sám o sobě jedinečný, tím ale nápaditost bičíkovců nekončí.
Čtenářům je jistě známo, že DNA je tvořena bázemi adeninem, tyminem, cytozinem a guaninem, přičemž v RNA je alternativou pro tymin uracil. Zcela výjimečně jsou tyto báze pozměněny, jako nejznámější příklad můžeme uvést modifikované báze v přenosových (transferových) RNA. V současnosti byla v genomu trypanozom identifikována zcela nová modifikace tyminu (tzv. báze J), která je velmi četná v tichých genech povrchového proteinu. Naopak nebyla nalezena u aktivně přepisovaných genů a zdá se, jako by přítomnost báze J hrála významnou roli při mechanizmech kontrolujících vypínání a zapínání jednotlivých genů povrchového proteinu. Velmi detailními analýzami bylo dále zjištěno, že geny povrchového proteinu mutují rychleji než ostatní genom, a navíc, zřídka ale přesto, dochází při nahrazování jedné kopie povrchového proteinu jinou k „chybě“, která způsobí spojení části starého a nového genu a vznikne gen zcela nový. Jeho trvalá fixace je však nejistá, protože v expresním místě, kde k slepení došlo, je brzy nahrazen další verzí. Vše, co bylo výše popsáno, provádějí bičíkovci jen ve svém obratlovčím hostiteli. Když moucha tse-tse nasaje infikovanou krev, přestanou trypanozomy v jejím střevě převlékat kabát (už to není nutné) a na jejich povrchu se objeví vždy stejný procyklinový protein. Po přesunu ze střeva přenašeče do slinných žláz se však trypanozomy začínají aktivovat a už na povrchu tzv. metacyklických jedinců, připravených pro novou invazi, se povrchový glykoprotein opět objevuje.
Povrchová proměnlivost afrických trypanozom (u amerických druhů nebyl tento jev zjištěn) je nádherným a intelektuálně neobyčejně podnětným objektem pro bohaté americké a západoevropské laboratoře, zároveň však zajištuje vysokou úmrtnost na spavou nemoc a mimořádnou odolnost vůči potenciálním vakcinám.
Je známo, že trypanozomy přijímají z krve hostitele kromě jiných látek i transferin. Jelikož je celý jejich povrch souvisle pokryt silnou vrstvou povrchového proteinu, musely své receptory umístit do kapsy na bázi bičíku, od něhož je odvozeno jméno celé skupiny prvoků. Hostitelské protilátky proniknou i sem, a zejména při chronických infekcích by zřejmě mohly trypanozomě působit potíže. Nejnovější výsledky ale naznačují, že parazitická buňka si dovede poradit i s tímto nebezpečím a společně s povrchovým proteinem mění částečně strukturu vazebného místa pro transferin. Přesto nemůže transferinový receptor ani další maskovat stejně účinně jako zbytek svého povrchu a budoucí vakcina bude s největší pravděpodobností zaměřena právě na tuto Achillovu patu parazita. 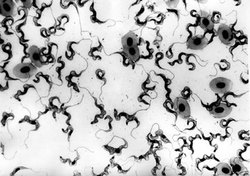
Trypanozomy dokázaly zužitkovat miliony let strávené v bezobratlých i obratlovčích hostitelích. Nepatrná, několik mikrometrů dlouhá buňka, která musí zajišťovat všechny životně nezbytné funkce, dokáže být více než rovnocenným soupeřem imunitnímu systému člověka, který je tvořen obrovskou a dobře vyzbrojenou armádou funkčně rozrůzněných a vzájemně spolupracujících buněk.
Glossina brevipalpis je přenašečem Trypanosoma congolense a T. brucei. Trypanozomy se u T. congolense vyvíjejí v žaludku, pak vnikají do spodního pysku, kde se mění v metacyklické trypanozomy. Ve střevě ani slinných žlázách mouchy tse-tse se u tohoto druhu nevyvíjejí. Oba druhy způsobují naganu, zhoubnou nemoc koní, oslů a hlavně skotu v různých oblastech Afriky.
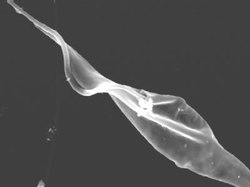
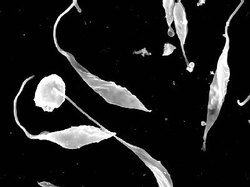
Jiný životní cyklus má trypanozoma Chagasova (T. cruzi, viz obrázek v článku 76, 242, 1997/5), která napadá přímo hostitelovy buňky vnitřních orgánů. Jejich rozpadem je amastigoti uvolňují a dostanou-li se do periferní krve, mění se zase ve stadia trypanozomová. Jejím přenašečem jsou ploštice rodu Triatoma a Rhodnius, v jejichž zažívací trubici se trypanozomy množía mění v dále se množící stadia epimastigotní, ta pak v malé metacyklické trypanozomy, které odcházejí s výkaly ploštice. Když se takto dostanou na lidskou pokožku, aktivně pronikají do krevního oběhu a způsobují infekci. Zdrojem nákazy jsou psi, kočky, pásovci, vačice, opice, myši ad. Choroba může probíhat akutně (hlavně u dětí) i chronicky, kdy trvá léta a často končí srdeční mrtvicí.
Čtrnáctiminutový film PRVOCI - BIČÍKOVCI natočil podle scénáře Josefa Chalupského Josef Reischig na Referenčním pracovišti optické mikroskopie firmy Olympus v Biologickém ústavu Lékařské fakulty UK v Plzni. Ukazuje životní projevy třiceti druhů bičíkovců. Z volně žijících sladkovodních druhů jsou prezentovány rody Euglena, Lepocinclis, Phacus, Pandorina, Stephanodon, Volvox a další. Mořští volně žijící bičíkovci jsou zachyceni společně s dalšími tvory mořské bičíkovcům rodu ho planktonu (např. s dírkonožci a rozsivkami). Ukázáni jsou i prvoci, kteří se usídlili v tělech mnohobuněčných hostitelů (např. v ruměnicích, termitech, hlemýždích), dále pak mnohobičíkaté opalinky, žijící v kloace skokanů. Významná část je věnována parazitickým Trichomonas, Trypanosoma, Giardia a Leishmania, kteří u lidí vyvolávají závažná onemocnění. Pořad přibližuje jeden z mnoha drobnohledných světů, se kterým tu pohromadě žijeme a na jehož bytí se podílíme. Je určen pro výuku zoologie na všech typech škol. Tento film získal v roce 1995 na Academia filmu cenu J. A. Komenského. Jeho distributorem je firma Mantis, Částkova 93, 301 46 Plzeň.
O autorovi
Julius Lukeš