Od buněk k molekulám
Před 111 lety vystoupil Ilja Mečnikov s teorií buněčné imunity a fagocytózou, za 55 let po jeho objevu poprvé použili W. Weaver a W. T. Astbury slovní spojení molekulární biologie. Před 10 lety se stali laureáty Nobelovy ceny C. Milstein a G. Köhler za vynález hybridomů, které tvoří monoklonální protilátky. Tou dobou se již imunologické objevy přesunuly na molekulární úroveň. Považujeme proto za potřebné velmi zjednodušenou formou shrnout ve třech článcích současný pohled na „molekulární imunologii“.
(redakce)
Základním úkolem imunitního systému je nejen obrana organizmu proti cizorodým látkám a mikroorganizmům, ale také zneškodnění vlastních buněk, které se začaly chovat abnormálně a mohly by proto představovat nebezpečí. Imunitní systém musí být v první řadě schopen rozeznávat „normální“ složky organizmu od složek abnormálních a cizorodých. Činí tak pomocí nespecifických a antigenně specifických mechanizmů.
„Nespecifické“ obranné mechanizmy
Obvykle pokládáme tyto fylogeneticky starší obranné systémy za relativně primitivní (Vesmír Vesmír 70, 625, 1991/11). Je však pozoruhodné, jak dobře s některými z nich vystačí všichni bezobratlí a jak nepostradatelné jsou i pro obratlovce, kteří navíc disponují vývojově pokročilejšími antigenně specifickými mechanizmy. Mezi tyto „nespecifické“ způsoby obrany řadíme hlavně:
- fagocytózu,
- různé baktericidní látky,
- komplementovou soustavu,
- antivirové proteiny, interferony,
- proteiny rozeznávající obecné mikrobiální struktury (sacharidy, lipopolysacharidy, peptidové fragmenty).
Obvykle se mezi „nespecifické“ elementy imunitního systému řadí i tzv. NK-buňky („přirození zabíječi“), které však podle současných názorů náleží spíše mezi velmi nekonvenční antigenně specifické buňky.
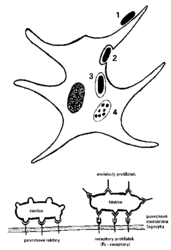 Nespecifické a antigenně specifické mechanizmy ovšem nelze striktně oddělit, neboť při každé imunitní odpovědi jsou vzájemně provázány a do značné míry se navzájem podmiňují.
Nespecifické a antigenně specifické mechanizmy ovšem nelze striktně oddělit, neboť při každé imunitní odpovědi jsou vzájemně provázány a do značné míry se navzájem podmiňují.
Fagocytóza
je asi fylogeneticky nejstarší obranný mechanizmus. Spočívá v “nespecifickém“ pohlcování různých částic makrofágy (Vesmír 72, 252, 1993/5), granulocyty nebo dendritickými buňkami a jejich následné destrukci hydrolytickými enzymy. Účinnost fagocytózy se podstatně zvyšuje, pokud jsou částice obaleny (opsonizovány) např. protilátkami (obrázek). Na povrchu fagocytů je mnoho receptorových molekul schopných takové „značky“ rozeznat. Některé fagocyty zde mají kromě toho také několik typů lektinů – proteinů rozeznávajících sacharidové struktury z povrchu různých druhů mikroorganizmů. Jsou tu také molekulární čidla pro lipopolysacharidy a pro specifické peptidy uvolňující se z bakterií. Tyto bakteriální produkty „lákají“ fagocyty do místa infekce. Kromě prostého odstraňování – požírání – cizorodých částic mají makrofágy a dendritické buňky velmi důležitou úlohu též v antigenně specifické části imunitního systému. Předkládají a představují antigen, který nově vnikl do organizmu, dalším „vyčkávajícím“ imunitním buňkám. Takto stimulované buňky začnou svou obrannou aktivitu vyvíjet až po stimulační „imunitní společenské události“. Makrofágy a dendritické buňky jsou tedyPřirozené protilátky a sérové lektiny
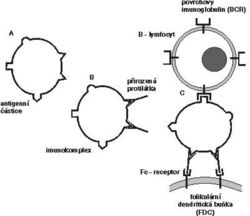 V krevní plazmě se nachází v poměrně vysoké koncentraci pestrá směs přirozených protilátek, hlavně třídy IgM. Vyznačují se širokou reaktivitou, (tj. nízkou specifitou a nízkou afinitou), k různým – hlavně sacharidovým – strukturám na povrchu mikroorganizmů. Tyto protilátky jsou produkovány snad spontánně zvláštní skupinou (subpopulací) B-lymfocytů, tzv. B1-buňkami. Pro buňky B1 je charakteristická přítomnost glykoproteinu CD5 na jejich povrchu. V plazmě jsou dále přítomny funkčně obdobné, ale strukturně zcela odlišné rozpustné lektiny, které se také vážou na určité sacharidové struktury mikrobiálních povrchů. Navázání přirozených protilátek a lektinů na mikroorganizmy, popř. na jiné cizorodé částice stimuluje jejich odstraňování fagocytózou a usnadňuje spuštění tzv. komplementové kaskády. Zdá se, že tvorba imunokomplexů z antigenů, přirozených protilátek, popř. komplementových fragmentů je velmi důležitá při zahájení antigenně specifické protilátkové odpovědi. Imunokomplexy jsou totiž zachycovány na povrchu specializovaných folikulárních dendritických buněk (FDC) v lymfatických uzlinách, kde se s nimi setkávají antigenně specifické B-lymfocyty (obrázek).
V krevní plazmě se nachází v poměrně vysoké koncentraci pestrá směs přirozených protilátek, hlavně třídy IgM. Vyznačují se širokou reaktivitou, (tj. nízkou specifitou a nízkou afinitou), k různým – hlavně sacharidovým – strukturám na povrchu mikroorganizmů. Tyto protilátky jsou produkovány snad spontánně zvláštní skupinou (subpopulací) B-lymfocytů, tzv. B1-buňkami. Pro buňky B1 je charakteristická přítomnost glykoproteinu CD5 na jejich povrchu. V plazmě jsou dále přítomny funkčně obdobné, ale strukturně zcela odlišné rozpustné lektiny, které se také vážou na určité sacharidové struktury mikrobiálních povrchů. Navázání přirozených protilátek a lektinů na mikroorganizmy, popř. na jiné cizorodé částice stimuluje jejich odstraňování fagocytózou a usnadňuje spuštění tzv. komplementové kaskády. Zdá se, že tvorba imunokomplexů z antigenů, přirozených protilátek, popř. komplementových fragmentů je velmi důležitá při zahájení antigenně specifické protilátkové odpovědi. Imunokomplexy jsou totiž zachycovány na povrchu specializovaných folikulárních dendritických buněk (FDC) v lymfatických uzlinách, kde se s nimi setkávají antigenně specifické B-lymfocyty (obrázek).
Receptory pro lipopolysacharid
Na povrchu různých druhů buněk, hlavně monocytů, granulocytů, B-lymfocytů a endotelových buněk se vyskytují receptory pro hlavní složku vnější membrány grammnegativních bakterií – lipopolysacharid (LPS; endotoxin). Nejlépe charakterizovaným a zřejmě funkčně nejdůležitějším receptorem pro lipopolysacharid je povrchový glykoprotein monocytů CD14. Navázání lypopolysacharidu na receptor vede k velmi rychlé aktivaci monocytů (resp. jiných buněk), kterou provází hlavně sekrece cytokinů IL-1 (interleukinu 1) a TNF (faktoru nekrotizujícího nádory, tumor necrosis factor, Vesmír 71, 509, 1991/9). Tyto cytokiny velmi účinně spolupůsobí při vyvolání obranného místního zánětu. Působení lipopolysacharidu prostřednictvím jeho receptorů a následnou sekrecí velkých množství IL-1, TNF a řady dalších látek však může vést k těžkým šokovým stavům ohrožujícím organizmus více než sám mikrob – zdroj lipopolysacharidu. To je jeden z mnoha případů, kdy obranné mechanizmy mají dvousečný charakter a působí někdy mnohem více škody než užitku.Interferony
jsou proteiny sekretované buňkami po virové infekci a vážou se na speciální receptory. To ve zdravých buňkách indukuje produkci několika desítek proteinů, které na různých úrovních brání účinné replikaci virů – navozují tzv. antivirový stav. Takto působí hlavně interferony ze skupiny α a β, kdežto interferon γ produkovaný leukocyty je velmi účinný pozitivní modulátor specifické imunitní odpovědi – způsobuje velké zvýšení syntézy řady funkčně důležitých proteinů, hlavně klíčových molekul imunitního systému – glykoproteinů hlavního histokompatibilitního komplexu (MHC, Vesmír 69, 274, 1990/5). Interferonům a mechanizmu jejich působení byl věnován pěkný článek v Scientific American (květen 1994).Komplement
je souhrnný název pro komplikovanou soustavu sérových a membránových proteinů. Objasnění tohoto mimořádně zajímavého systému bylo vpravdě obdivuhodným experimentálním a intelektuálním výkonem. Aktivace komplementové kaskády (obrázek) vede:- ke kovalentnímu navázání fragmentů proteinů C3 a C4 na povrch mikroorganizmů, což má opsonizační efekt (tj. zlepšení fagocytózy),
- k tvorbě malých fragmentů C3a a C5a, které chemotakticky „lákají“ fagocyty,
- v konečné fázi na membráně komplementem napadeného mikroorganizmu k případnému vzniku terminálních lytických komplexů, které mohou proděravět membránu a způsobit tak lýzu mikrobiální buňky.
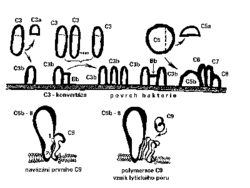 Komplement je dalším příkladem poměrně nebezpečné imunitní „dvousečné zbraně“. Komplementové fragmenty a terminální lytické komplexy se totiž ukládají také na povrchu “nevinných přihlížejících“ – na vlastních buňkách organizmu, které jsou poblíž místa zásahu. Na povrchu všech buněk organizmu je však několik regulačních proteinů, které inaktivují komplementové komplexy a tím brání nepatřičnému poškození „nevinných“ buněk (nejdůležitější z nich je glykoprotein CD 59, zvaný někdy též protektin).
Komplement je dalším příkladem poměrně nebezpečné imunitní „dvousečné zbraně“. Komplementové fragmenty a terminální lytické komplexy se totiž ukládají také na povrchu “nevinných přihlížejících“ – na vlastních buňkách organizmu, které jsou poblíž místa zásahu. Na povrchu všech buněk organizmu je však několik regulačních proteinů, které inaktivují komplementové komplexy a tím brání nepatřičnému poškození „nevinných“ buněk (nejdůležitější z nich je glykoprotein CD 59, zvaný někdy též protektin).
Zánět
Hlavní překážkou pro mikrobiální infekce jsou mechanické bariéry – kůže a sliznice. Jsou-li při poranění porušeny, dojde k řadě obranných a reparačních reakcí, označovaných souhrnně jako zánět (Vesmír 70, 567, 1991/10). Mají zabránit průniku infekce a zahojit ránu. Při poranění se kromě jiného aktivují mechanizmy zastavující krvácení, lokálně zvyšující propustnost cévních stěn, lákající fagocyty a aktivující komplementový systém. Důsledky jsou dobře známé – místní zčervenání, zduření a bolest. Fagocyty, a to hlavně granulocyty, požírají odumřelé části poškozené tkáně, cizorodé částice, mikroorganizmy a tvoří tak hnis. Je-li poranění rozsáhlejší nebo dojde-li k akutní infekci, podílejí se na dalším průběhu zánětu antigenně specifické mechanizmy (protilátky, T-lymfocyty). Chronická nebo příliš intenzivní zánětlivá reakce může vést k závažnému poškození organizmu.Literatura
J. Flegr, Transplantační antigeny – vzestup a pád jedné teorie, Vesmír 69, 274, 1990/5
K. Nouza, M. Holub, Tymus a T-lymfocyty, Vesmír 69, 391, 1990/7
V. Větvička, P. Šíma, Evoluce imunity, Vesmír 70, 625, 1991/11
V. Větvička, P. Šíma, Jak se buňky naučily nabízet antigeny, Vesmír 70, 388, 1991/7
M. Holub, Poznej sebe sama: imunologie, Vesmír 71, 390, 1992/7
M. Lipoldová, Jak se dorozumívají buňky imunitního systému, Vesmír 71, 509, 1992/9
I. Trebichavský, Makrofág, Vesmír 72, 252, 1993/5
T. Eckschlager, Imunoterapie nádorů – zklamání nebo naděje?, Vesmír 72, 430, 1993/8
buňky prezentující antigen (APC, antigen presenting cell) – jsou schopné pohltit antigen, rozštěpit ho na malé fragmenty a ty (navázané na MHC-glykoproteiny) „vystavit“ na svém povrchu, kde je mohou poznat pomocné T-lymfocyty; nejúčinnějšími APC jsou dendritické buňky a makrofágy
CD – mezinárodní označení (spolu s číslem) dobře definovaných povrchových molekul bílých krvinek; dosud je jich známo asi 130 (CD – CD130; některé se rozlišují dále - např. CD1a, CD1b); mají rozmanité struktury i funkce; název odvozen od „cluster of differentiation“
cytokiny – polypeptidové hormony regulující imunitní systém; některé však působí i na buňky mimo tento systém; patří mezi ně interleukiny (IL), interferony (IFN), faktory stimulující růst kolonií (CSF, colony stimulating factors), transformující růstové faktory (TGF, transforming grouwth factors) ad.
dendritické buňky (DC, dendritic cells) – mají charakteristický velmi členitý tvar, nalézají se v různých tkáních, jsou nejúčinnějšímí známými APC
endotelové buňky – buňky tvořící výstelku cév
Fc-receptory – proteiny na povrchu různých typů buněk schopné vázat Fc-část molekul protilátek
folikulární dendritické buňky (FDC, folicular dendritic cells) – velmi členité buňky z folikulů lymfatických uzlin; nepatří mezi bílé krvinky; na svém povrchu vychytávají a dlouhodobě skladují antigeny ve formě imunokomplexů
grammnegativní bakterie – nejsou barvitelné violetí, druhou základní skupinou jsou bakterie grammpozitivní
granulocyty – druh bílých krvinek s množstvím váčků (granulí) v cytoplazmě; velmi účinně požírají cizorodé částice a mikroorganizmy – fagocytují; dělí se (podle barvitelnosti histologickými barvivy) na neutrofily, bazofily a eosinofily
imunologie – věda o obranných mechanizmech organizmu (imunitě); odvozeno z latinského “immunis“, tj. osvobozený od nějaké zátěže (daně, zákona, nemoci)
lektiny – proteiny schopné vázat sacharidy (nepatří však mezi ně protilátky a enzymy, které vážou sacharidy)
lymfocyty – relativně malé bílé krvinky s velkým jádrem; dělí se na B-lymfocyty, které vyrábějí protilátky, T-lymfocyty, které regulují imunitní děje (TH, pomocné T-lymfocyty) a zabíjejí infikované buňky (TC, cytotoxické T-lymfocyty) a na NK-buňky, které se účastní obrany proti nádorům a některým virovým infekcím
makrofágy – druh velkých bílých krvinek schopných pohlcovat cizorodé částice a jiné buňky (funkčně patří mezi fagocyty)
MHC-glykoproteiny – centrální molekuly imunitního systému, které jsou mimořádně polymorfní (vyskytují se ve velkém počtu strukturně poněkud odlišných forem) a vážou malé fragmenty antigenů; tyto komplexy jsou rozeznávány T-lymfocyty; MHC-glykoproteiny, resp. jejich komplexy s peptidy, jsou zodpovědné i za transplantační komplikace („transplantační antigeny“), což je důsledek jejich polymorfizmu
monocyty – druh bílých krvinek, z nichž se mohou vyvinout makrofágy
receptory – molekuly na povrchu buňky, které vážou nějakou látku (hormon, povrchový protein jiné buňky, antigen aj.) a do nitra buňky přenášejí signál o vazbě
vazebné místo – část molekuly receptoru, protilátky, enzymu či lektinu, na kterou se váže ligand; vazebná místa pro antigen jsou u protilátek na koncích variabilních ramen protilátkových molekul
O autorovi
Václav Hořejší
















