Buněčné jádro
Buněčné jádro popsal před více než 150 lety R. Brown. Dnes se o něj zajímají vědecké laboratoře po celém světě. Zájem samozřejmě pramení z toho, že jsou v jádře uloženi nositelé dědičné informace, chromozomy. Zároveň je výzkum jádra zajímavý proto, že je postaven před několik zásadních problémů. Žijeme v éře genomiky, pořadí nukleotidů v jednotlivých lidských chromozomech je již v podstatě stanoveno a na základě této znalosti můžeme určit detailní uspořádání genů. Víme však stále velmi málo o tom, jak jsou chromozomy v jádře organizovány. Význam genomiky je nezastupitelný, současně je však nutné si uvědomit, že jaderné procesy neprobíhají ve zkumavce, ale v rámci jaderné architektury, která se vyvíjela po miliony let.
Jak je možné, že jsou asi 2 m DNA v lidské buňce poskládány do jádra o průměru 10 μm? Navíc DNA musí být nejen uskladněna, ale během buněčného cyklu i zdvojena (replikována) právě jen jednou, a to pod bedlivým dohledem mechanizmů zaručujících její bezchybné uchování. Poskládat DNA do jádra je jako uložit 2000 km dvoumilimetrového „vlasce“ do běžného obývacího pokoje v paneláku. Lidská somatická buňka však obsahuje 23 párů chromozomů s různým množstvím DNA (chromozomy mají různou velikost). V obývacím pokoji je tedy uloženo 46 více či méně rozmotaných obrovských „špulek“ vlákna! Z vlastní zkušenosti vím, že rozplést několik metrů zamotaného rybářského vlasce je svízelné, buněčné jádro to však musí zvládnout velmi rychle. Pokoj (jádro) je vlascem (DNA) doslova přeplněn, neboť je v komplexu s proteiny, jimž ve srovnání s vlascem přísluší asi dvojnásobný objem. Výsledný nukleoproteinový komplex, zvaný též chromatin, sám o sobě zabírá desítky kubických metrů prostoru obývacího pokoje (viz Vesmír 77, 388, 1998/7). Jak je vůbec v tak složitém prostředí organizován přepis určitého genu? A jak je to s navazujícími jadernými procesy genové exprese, zahrnujícími vyzrávání a úpravy molekul RNA (rámeček)?
Genová exprese
Připomeňme si zde základní etapy vyjádření genu (genové exprese) v jádře. Jeho první úrovní je transkripce – syntéza RNA podle předlohy DNA. Výsledkem je tzv. primární transkript. Transkripce se účastní několik desítek bílkovin v tzv. transkriptozomovém komplexu a ovlivňuje ho mimo jiné řada „návěstí“ na samotné molekule DNA, například promotorová sekvence, na kterou nasedá RNA-polymeráza, a různé další regulační oblasti. Tyto úseky zpravidla nejsou součástí přepisované sekvence DNA. Další stupeň genové exprese představuje vyzrávání primárního transkriptu spojené s jeho úpravami. Část informace obsažené v sekvenci vyzrálé mRNA je v cytoplazmě přeložena do sekvence aminokyselin v polypeptidovém řetězci. (Podrobněji se genovou expresí zabývá tabulka.)
Genová exprese samozřejmě zahrnuje i návazné kroky, především transport mRNA do cytoplazmy, úpravy syntetizované bílkoviny a její nasměrování do cílového působiště (ať již uvnitř či vně buňky), které je často doprovázeno její chemickou modifikací, např. glykosylací nebo vyštěpením směrovacích signálů (viz Vesmír 79, 24, 2000/1). Množina přítomných proteinů a druh jejich modifikace určují funkční uspořádání příslušného buněčného kompartmentu (obr. 9).
Členění (kompartmentace) buněčného jádra
Buněčné jádro představovalo ještě před patnácti lety pro řadu biologů útvar, kde „v moři chromatinu plave jadérko“. Zcela odlišný obraz jádra však získáváme dnešními imunocytochemickými nebo hybridizačními přístupy (rámeček) při detekci jaderných bílkovin, genů nebo RNA. Mnoho těchto makromolekul je lokalizováno do zřetelně odlišitelných jaderných oblastí či domén. Jádro je tedy strukturně členěno – kompartmentováno (obr. 8 a obr. 10).
Chromatinové struktury do značné míry zaplňují jádro. Zbývající prostor jádra se nazývá interchromatinový prostor či interchromozomální systém kanálů. RNA je syntetizována na povrchu chromatinových struktur a po ukončení syntézy je uvolňována do interchromatinového prostoru. V něm se také sestavují multienzymové komplexy, zajišťující např. transkripci (transkriptozomy) či sestřih (spliceozomy).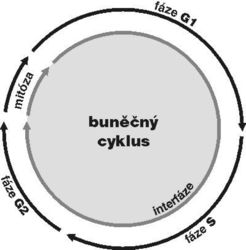
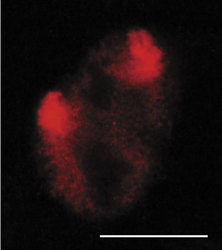
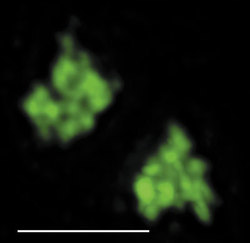
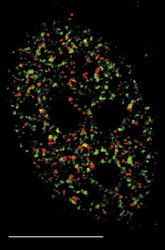
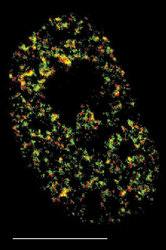
V interchromatinovém prostoru se odehrává metabolizmus RNA a nacházíme v něm řadu jaderných tělísek a domén – především jadérko (obr. 4); dále pak Cajalova tělíska, tělíska PML (promyelocytic leukemia), jaderné skvrny (obr. 4, obr. 5 a obr. 6) a několik dalších. S výjimkou jadérka dosud neznáme přesnou funkci žádného z nich.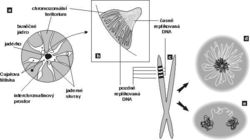
DNA, chromatin a chromozomy
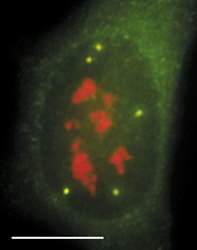
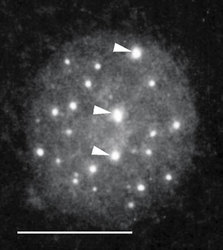
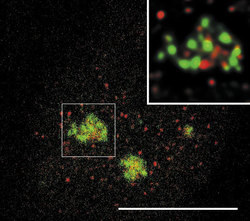
DNA je v buněčném jádře přítomna v komplexu s bazickými proteiny histony a nehistonovými bílkovinami ve formě chromatinu. Vzhledem k své délce je v chromatinu poskládána hierarchickým způsobem (viz Vesmír 77, 388, 1998/7). Nejvíce je kondenzována v mitotickém chromozomu. Interfázní chromatinová struktura je naopak více či méně rozvolněna (buněčný cyklus a pojmy s ním spojené vysvětluje obr. 7). Detailně známe pouze nejnižší stupeň interfázní hierarchie, tzv. nukleozomální uspořádání chromatinu neboli 10nm chromatinové vlákno. V něm jsou zhruba dvě otočky dvojšroubovice DNA svinuty do nukleozomu, obsahujícího histony. Svinutím 10nm vlákna vzniká vlákno 30nm. Jeho existence je obecně akceptována, jeho přesná struktura však není známa. Otázkou zůstává způsob poskládání 30nm vlákna do chromatinových struktur vyšších řádů, chromozomálních smyček anebo chromonemových vláken, ač se v učebnicích pravidelně setkáváme s různými spekulativními schématy. Víme však, že chromatinové struktury jednotlivých chromozomů nejsou navzájem promíchány a vytvářejí uvnitř jádra oddělená chromozomální teritoria (obr. 2 a obr. 3). Existuje rovněž řada poznatků o tom, že vzájemné uspořádání chromozomálních teritorií v jádře není zcela náhodné a že transkripční aktivity jsou lokalizovány na povrch chromozomálních teritorií (resp. na povrch subchromozomálních domén; obr. 2 a obr. 3).
Aby určitý gen mohl být přepsán RNA-polymerázou, musí mít polymeráza k sekvenci DNA přístup, kompaktnost chromatinové struktury musí být narušena. Přesný způsob a rozsah rozvolnění chromatinu však není v běžné (např. lidské) buňce znám. (Výjimku tvoří např. štětkovité chromozomy ve vajíčkách obojživelníků. Hledat však plnou analogii mezi speciálními případy a diploidní somatickou savčí buňkou může být zavádějící.)
V nejbližší době patrně dojde ke zvratu v poznání vyšších řádů organizace chromatinu, resp. chromozomů. Naznačuje to např. nedávný objev rozsáhlé rodiny proteinů SMC (Structural Maintenance of Chromozomes), které se podílejí na utváření jak mitotických chromozomů, tak interfázního chromatinu a také na metabolizmu DNA včetně jejích oprav. Obrovského pokroku bylo dosaženo ve strukturním popisu lokálního uspořádání chromatinu na úrovni 10nm vlákna. Mluví se o remodelaci chromatinu, ať již ve smyslu aktivace nebo represe transkripce, či – řečeno trochu jinak – o aktivním vlivu struktury chromatinu na genovou expresi, přičemž nejdiskutovanějšími ději jsou dnes acetylace a deacetylace histonů, popř. metylace a demetylace DNA. DNA-polymeráza, RNA-polymerázy a celá paleta regulačních proteinů jsou cílově nasměrovány genově specifickými regulátory a vyvolávají lokální změnu v uspořádání chromatinu, která se projevuje dvojí možností funkce, buď transkripcí, nebo replikací (obr. 8 a obr. 10). Chybné nasměrování těchto a jiných enzymů a regulačních faktorů vede k nežádoucím změnám buněčného metabolizmu.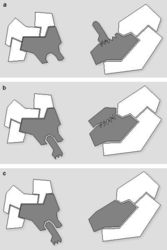
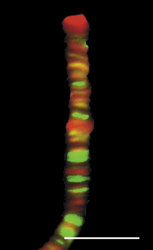
Genom člověka obsahuje řádově 100 000 genů. Jejich délka činí jen několik málo procent celkové délky DNA v genomu. Navíc se v diferencované buňce exprimuje jen část genů. Cytogenetici vypracovali detailní mapy mitotických chromozomů pomocí cytochemických pruhovacích metod (obr. 8; viz rovněž Vesmír 70, 326, 1991/6). Modifikovaným barvením podle Giemsy vznikají na mitotickém chromozomu rovnoběžné G-pruhy, kolmé k delší chromozomální ose. Při jiném barvení vznikají komplementární R-pruhy. Zatímco R-pruhy odpovídají v interfázi spíše rozvolněnějšímu chromatinu (euchromatinu) a jsou v nich umístěny geny, G-pruhy odpovídají v interfázi kondenzovanějšímu, transkripčně neaktivnímu chromatinu – heterochromatinu – a jsou v nich lokalizovány hlavně nekódující sekvence DNA. V mitotickém chromozomu se střídají části, které jsou v interfázi aktivní a neaktivní. V interfázi se v rámci jednoho chromozomálního teritoria aktivní a neaktivní části genomu prostorově oddělují. Aktivní oblasti chromozomálního teritoria se nacházejí spíše „uvnitř“ jádra, neaktivní na jeho periferii. Tento nález má zásadní význam, neboť svědčí o pohybu a reorganizaci interfázního teritoria vzhledem k uspořádání chromozomu mitotického. V tomto ohledu také není struktura teritoria homogenní, je složena ze subchromozomálních domén (obr. 3) a svědčí o částečném rozvolnění chromatinových struktur. Někteří autoři mluví dokonce o doménách s velikostí 400 až 800 nm, z nichž je teritorium vytvářeno. Objem interfázního chromozomu je přitom závislý na počtu jeho aktivních genů, tj. na zvýšení povrchu teritoria čili na rozsahu rozvolnění (euchromatinizace) chromatinu. Čím je počet aktivních genů vyšší, tím větší prostor teritorium zaujímá. Klasickým příkladem je srovnání aktivního a inaktivního X-chromozomu v lidské buňce ženského pohlaví (viz rovněž obr. 18).
Uspořádání chromatinu je důležité z hlediska replikace DNA. Vznikají při ní dvě dvojšroubovice, každá se skládá z jednoho řetězce původního a jednoho nově syntetizovaného (obr. 11). Miliardy nukleotidů lidské DNA jsou během několika málo hodin věrně zdvojeny. Jestliže si představím výše uvedenou analogii s vlascem, je to pro mne něco nemyslitelného. Před zahájením vlastní replikace nejprve vznikají prereplikační komplexy. Vlastní replikační komplex zahrnuje desítky dalších proteinů, od DNA-polymeráz až po enzymy, které přestřihnou a znovu spojí vlákna DNA. Ty také alespoň zčásti řeší, jak by se mohly bezchybně prostorově oddělit dceřiné řetězce DNA. Konečný výsledek se projeví až během mitózy oddělením dceřiných DNA do dvou identických chromatid. 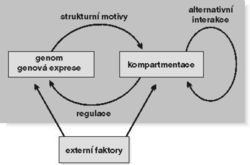
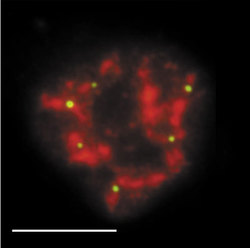
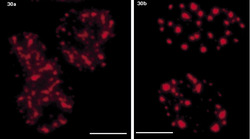
DNA-polymerázy eukaryontní buňky začleňují do nově vznikajícího řetězce DNA řádově jen asi 1000 nukleotidů za minutu. Je proto nutné, aby syntéza DNA probíhala současně na mnoha místech každého chromozomu. Vznikají stovky až tisíce replikačních jednotek, replikonů. Aktivita replikonu je ukončena v okamžiku, kdy replikační vidlička narazí na vedlejší aktivní replikon, popř. na již duplikovaný úsek DNA nebo na úsek DNA, který má být replikován později. Na buněčné úrovni vznikají replikační domény či ohniska (obr. 1, obr. 14, obr. 15, obr. 16), přičemž každé z nich obsahuje jeden nebo několik, zpravidla sousedících replikonů. Replikony jsou dlouhé v průměru 100 000 nukleotidů, ale připouští se existence i replikonů mnohonásobně delších. Někteří autoři spekulují, že replikační ohniska odpovídají výše popsaným subchromozomálním doménám. Za důležitý nález považuji skutečnost, že na počátku fáze S buněčného cyklu se jako první začínají replikovat především sekvence genů aktivních v předcházející fázi G1. To je snad usnadněno rozvolněnou strukturou chromatinu a faktory, které jsou přítomny v transkriptozomu a současně hrají úlohu při replikaci. V pozdní fázi S se replikují sekvence, které tvoří G-pruhy mitotického chromozomu.
Subchromozomální domény nás přivádějí k dalšímu biologickému problému. Regulační sekvence genu totiž nestačí k zajištění jeho exprese, která vyžaduje přítomnost mnohem delších specifických úseků DNA. Ukazuje se, že chromatin je organizován do nezávislých jednotek genové aktivity uspořádaných do menších či větších subchromozomálních domén a vymezených specifickými hraničními elementy. Ty izolují gen od vlivu sousedních sekvencí DNA. Nejpropracovanější modely této vyšší funkční organizace chromatinu jsou jednak locus control region (LCR) u savců, jednak special chromatin structures (scs a scs’) u drozofily (obr. 17).
Na tomto místě je vhodné se zmínit o modelu euchromatinizovaných chromonemových vláken, která obsahují genové úseky lokalizované do R-pruhů. Na dlouhé sekvence obsahující aktivní geny (řádově miliony nukleotidů, čili množství DNA obsažené v jednotlivých pruzích mitotického chromozomu) jsou navázány regulační faktory (včetně např. acetyltransferáz). Vazba těchto faktorů pak vede k rozvolnění lokální chromatinové struktury, k euchromatinizaci. Ta dále indukuje rozvolňovací aktivitu i v sousedním chromatinu obsahujícím neaktivní geny a euchromatinizace se šíří po délce DNA odpovídající v mitóze R-pruhu. Taková interpretace je patrná z obr. 18 a ukazuje rovněž na přímý vliv změn lokální struktury chromatinu (na úrovni 10nm vlákna) na chromatinové struktury řádů vyšších.
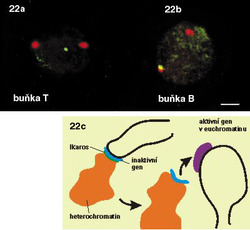
Jak by se mohlo zdát, pro život buňky je důležitá jen ta malá část genomu, která obsahuje geny. Jakou funkci ale hrají zbylé sekvence lidské DNA, skládající se z mnohonásobně se opakujících identických či skoro identických kratších či delších úseků, nefunkčních duplikovaných genů apod.? V posledních letech již bylo prokázáno, že neaktivní heterochromatin sám o sobě hraje důležitou úlohu v genové expresi. Jestliže je aktivní gen, který se původně nachází v euchromatinu, přemístěn do heterochromatinové oblasti, jeho exprese je potlačena. Tento vliv polohy genu v rámci chromozomu (chromatinu) na jeho expresi je nejrozsáhleji propracován u drozofily a v menší míře i u savců. Např. transkripční regulátor Ikaros se uplatňuje během diferenciace lymfoidních buněk. Zatímco sledované aktivní geny jsou součástí euchromatinu, pohyb genů jádrem do heterochromatinové oblasti, v níž je přítomen Ikaros, je doprovázen inaktivací (umlčením) genů (obr. 21). Z uvedeného vyplývá další aktivní úloha chromatinu: nejen umožnit regulovanou genovou expresi prostřednictvím euchromatinu, ale též – prostřednictvím heterochromatinu – zamezit nechtěným interakcím.
Jadérko
Biosyntéza ribozomů se odehrává v jadérku, které se vytváří v místech odpovídajících v mitóze chromozomálním organizátorům jadérka (nucleolar organizer regions – NOR), tedy těm oblastem DNA, kde jsou umístěny geny pro ribozomální DNA (rDNA). V lidské diploidní buňce se v organizátorech 10 chromozomů vyskytuje asi 400 genů a každý organizátor obsahuje mnoho genů uspořádaných za sebou. Ne vždy jsou všechny organizátory v interfázi aktivní a i několik aktivních organizátorů může být součástí jediného jadérka. V lidské buňce nacházíme zpravidla jedno až tři jadérka. Transkripční aktivita zjevně vede k vytvoření stabilně fungujícího jadérka v interfázi. Při mitóze se transkripce utlumuje, jadérko se rozpadá do malých tělísek, která po mitóze ihned splynou v místě organizátoru a vytvoří nové funkční jadérko. Některé složky jadérka, např. RNA-polymeráza I, zůstávají během mitózy asociovány s organizátorem na chromozomu. To vše svědčí o tom, že buňka je dobrým hospodářem. Využije části rozpadlých jadérek a je schopna okamžitě po mitóze začít s výrobou ribozomů. Vysoce ekonomicky se ostatně buňka chová i v případě syntézy RNA mimo jadérko.
Tvorba ribozomu je komplexní proces zahrnující transkripci (obr. 19 a obr. 20) 45S prekurzorické rRNA, její vyzrávání, modifikaci a rovněž asociaci rRNA s ribozomálními proteiny a 5S rRNA, která se syntetizuje mimo jadérko (podrobně viz tabulka). Vyzrávání rRNA se účastní mnoho proteinových faktorů a snRNA v komplexu, jemuž se říká procesozom. Zmíněné snRNA jsou vzhledem k své lokalizaci nazývány malé jadérkové RNA (snoRNA) a obsahují funkčně důležité sekvence.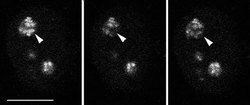
Ač byla funkce jadérka v biosyntéze ribozomů popsána na počátku 60. let, dosud není známo, jakým způsobem jsou ribozomální částice dopravovány z jadérka do cytoplazmy. Mezi další možné funkce jadérka lze zahrnout:
- účast v jaderném importu a exportu, včetně exportu a degradace mRNA;
- účast v biosyntéze SRP (Signal Recognition Particle – viz Vesmír 79, 24, 2000/1) a telomerní RNA (telomery jsou konce chromozomů; v interfázi jsou telomerní sekvence součástí heterochromatinu);
- hromadění důležitých makromolekul (např. faktorů regulujících buněčný cyklus), což jim zabraňuje plnit jejich funkce;
- účast na vyzrávání některých snRNA a tRNA.
Syntéza RNA mimo jadérko a její sestřih
Transkripce probíhá na povrchu chromatinových struktur v perichromatinové oblasti interchromatinového prostoru. Většina primárních transkriptů obsahuje introny, které musí být vystřiženy před transportem RNA do cytoplazmy, přičemž vystřižené introny jsou zpravidla rychle rozloženy. K sestřihu dochází často souběžně s transkripcí, ještě když je syntetizovaná RNA spojena s místem transkripce. Je však známo, že část prekurzorických RNA obsahuje introny i polyadenylovaný konec, jenž ale vzniká až po ukončení syntézy primárního transkriptu. Některé molekuly RNA proto musí být sestříhány až po transkripci. Prekurzorická RNA se v těchto případech uvolňuje z místa transkripce a je sestřižena na jiném místě interchromatinového prostoru.
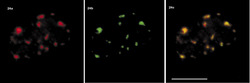
Sledujeme-li obraz FISH (rámeček) specifické RNA, včetně specifického označení intron-exonových a exon-exonových spojení, pozorujeme signál buď ve formě terčíku, v podstatě velmi podobný signálu genu, nebo ve formě protaženého signálu neboli jaderné cestičky (obr. 22). Sledujeme-li distribuci transkripčních a sestřihových faktorů, je možné fluorescenční signál v interchromatinovém prostoru rozdělit do dvou kategorií. První není výrazný a odpovídá spíše difuznímu signálu s místy fokální akumulace. Druhý odpovídá v savčích buňkách nahromadění faktorů v asi 10 až 50 fluorescenčně intenzivních jaderných skvrnách (obr. 5). Řada těchto faktorů, ale ne všechny (obr. 5), jsou obsaženy rovněž v několika Cajalových tělískách (v lidské buňce zpravidla v jednom až pěti). Ta mají průměr menší než mikrometr a bývají někdy asociována s jadernými skvrnami a jadérky.
Jak lze tyto obrazy interpretovat? Signál mRNA ve formě terčíku přísluší zpravidla genu s relativně malou transkripční aktivitou, přičemž množství uvolněné RNA z místa transkripce, ať již sestřižené či ne, je pod detekční schopností FISH. Je možné na něj také nahlížet jako na právě aktivovaný gen (obr. 22b). V případě jaderných cestiček zjevně jde o gen s vyšší aktivitou, přičemž RNA nebyla vůbec sestřižena, nebo byla sestřižena jen zčásti, neboť cestičky obsahují jak exony, tak introny.
Jaderné skvrny
Primární roli jaderných skvrn v transkripci lze vyloučit, neboť transkripční signál je v nich příliš nízký. Jaderné skvrny slouží jako zásobárny faktorů, které jsou rekrutovány aktivními geny nacházejícími se v blízkosti skvrn. Nicméně cestičky vytvořené nesestřiženou mRNA vedou od genu k těmto skvrnám (obr. 22e), které tak v sestřihu mohou hrát aktivní roli. Jak ale potom vysvětlit nízký transkripční signál ve skvrnách? Imunocytochemií a metodou FISH (rámeček) detegujeme nejpomalejší kroky v rámci nějakého procesu. A jedním z takových procesů je právě transkripce. Na rozdíl od základního sestřihu může být regulovaný (či alternativní) sestřih zpomalený, a navíc může být prostorově oddělen od sestřihu probíhajícího během transkripce. Pozorovatelný transkripční signál ve skvrnách proto nemůže být výrazný. Jaderné skvrny se jeví nejen jako zásobárny transkripčních a sestřihových faktorů a jako možná místa regenerace či tvorby transkripčních a sestřihových komplexů, ale také jako místa aktivního sestřihu části prekurzorických mRNA.Cajalova tělíska
O Cajalových tělískách se soudí, že jsou místem tvorby transkripčních i sestřihových komplexů.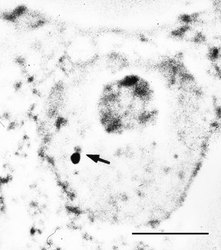 Hrají snad také roli v jejich recyklaci a nitrojaderném transportu. Uplatňují se v místech transkripce specifických genů, např. genů pro některé snRNA a rovněž aktivních histonových genů. Obsahují řadu jadérkových složek (obr. 4) a plní zjevně i jistou úlohu spolu s jadérkem, s nímž se často spájejí.
Hrají snad také roli v jejich recyklaci a nitrojaderném transportu. Uplatňují se v místech transkripce specifických genů, např. genů pro některé snRNA a rovněž aktivních histonových genů. Obsahují řadu jadérkových složek (obr. 4) a plní zjevně i jistou úlohu spolu s jadérkem, s nímž se často spájejí.
Jádro jako dynamická organela
Z uvedeného zatím nevyplývá dynamický charakter jádra. Spíše se může zdát, že v jádře existují stabilní oblasti, i když v rámci nějakého rovnovážného rozmístění makromolekul. Opak je pravdou. Dynamika jádra je úžasná. Pohyb na úrovni kompartmentů či subkompartmentů potvrzují četné experimenty (obr. 18). Rychlost pohybu chromatinu, měřená např. pohybem centromery, je mezi jedním a deseti mikrometry za hodinu. Také inhibitory syntézy RNA vyvolají rozsáhlé změny struktury jádra ve velmi krátké době (obr. 23). Změna polohy genu v jádře je ve specifických případech mikroskopicky registrována již 5 minut po jeho aktivaci.
Velmi rychlá je v jádře i záměna identických makromolekul (obr. 12). Např. histony, které jsou součástí nukleozomu, jsou v chromatinu stabilně zabudovány, ale histon tvořící spojení mezi dvěma nukleozomy setrvává na místě řádově jen několik vteřin, než je nahrazen stejným typem histonu. Jak je to s pohybem makromolekul v interchromatinovém prostoru? Současné poznatky hovoří spíše o difuzi (obr. 24), ale především v souvislosti se zabudováváním makromolekul na určitá místa (tj. do určitého kompartmentu), či naopak s jejich uvolňováním jde zjevně o pochody vyžadující energii.
Buněčné jádro a nemoc
Změny ve struktuře buněčného jádra jsou asociovány s bezpočtem onemocnění, která často souvisejí se změnou chromatinu. Uvedu jen dva příklady související s jadernými kompartmenty v interchromatinovém prostoru, Cajalovými tělísky a tělísky PML.
Existuje korelace mezi spinální svalovou dystrofií (SSD) a strukturou Cajalových tělísek. V některých buněčných typech jsou Cajalova tělíska asociována s dalším typem tělísek, zvaných GEM (Gemini of Cajal bodies; obr. 13). U pacientů je v Cajalových tělískách přítomen protein SMN1, který je příčinou svalové dystrofie. Jeho mutace způsobují chybu v biogenezi snRNP a sestřih prekurzorických mRNA se stane nefunkčním. Je-li s Cajalovým tělískem asociováno tělísko GEM, je SMN1 protein u dystriofie specifickou značkou tohoto tělíska. Stojí jistě za pozornost, že značné procento dědičných onemocnění má podstatu právě v chybném sestřihu.
Tělíska PML jsou ve srovnání s Cajalovými tělísky menší a často jich na jádro lidské buňky připadá více než deset (obr. 6). Někdy se vyskytují ve spojení s Cajalovými tělísky. Jednou z jejich specifických bílkovin je protein PML. U promyelocytární leukemie se v souvislosti s translokací chromozomů tato tělíska rozpadají. Během translokace se v sekvenci DNA spojí gen kódující protein PML a gen pro receptor kyseliny retinové (RAR) – vznikne hybridní protein PML-RAR. Stačí buňkám podat kyselinu retinovou a tělíska PML se opět vytvoří.
Buněčné jádro v novém miléniu
Ještě před 10 lety bylo studium buněčného jádra téměř výlučně popisné. Dnes se přeneslo na molekulární úroveň a existují předpoklady pro to, že se naše vědomosti o struktuře chromatinu vyšších řádů a funkci jaderných kompartmentů v blízké budoucnosti významně prohloubí. Molekulární buněčná biologie už přinesla detailní poznatky o replikaci DNA, syntéze a vyzrávání RNA, a také o transportu makromolekul mezi jádrem a cytoplazmou (skrze neustále vytížené jaderné póry se v jedné buňce přepraví sem a tam milion makromolekul za minutu). Výsledky prací z posledních let svědčí i o pokroku v poznání strukturně-funkční organizace opravných mechanizmů DNA a jaderné degradace RNA i proteinů. Snad také po mnoha letech úsilí zodpovíme otázku, zda existuje či neexistuje jaderná „matrix“ nebo nějaká forma jaderného skeletu, jak jej známe v cytoplazmě.
Jádro je vysoce dynamická organela, pro niž jsou typické její kompartmenty, ať již ve smyslu jednotlivých chromozomálních teritorií či kompartmentů interchromatinového prostoru. Rozdělení na kompartmenty je pro metabolizmus jádra „ekonomicky“ výhodné a umožňuje předběžnou tvorbu makromolekulárních komplexů, které pak provádějí složité procesy replikace, transkripce i vyzrávání RNA. Jádro nelze považovat za „chromozomy a jadérka plovoucí v jaderné šťávě“. Je to naopak organizovaná organela s přísně regulovanou vysokou funkční přizpůsobivostí struktury. Hlubší porozumění funkci buněčného jádra a znalost kompletní sekvence lidského genomu otvírají úplně nové perspektivy pro genovou terapii a přispějí k revoluci v lidské medicíně.
Poznámky
Potíže při studiu jaderných procesů
Většina faktorů, které provádějí a regulují procesy replikace, transkripce a vyzrávání RNA, není dostatečně jedinečná. Např. skladba transkripční mašinerie přepisující geny aktinu a myozinu či jiných genů je často v prvním přiblížení identická. Svým způsobem lze říci, že jedinečnost je dána především pořadím nukleotidů v genu, respektive příslušné RNA.
K pochopení jaderných funkcí se používalo tří různých metodik v podstatě neprovázaných vědních disciplín. Biochemici a molekulární biologové se zabývali mechanizmy biochemických reakcí, které analyzovali v bezbuněčných podmínkách in vitro. Genetici se snažili izolovat mutanty ovlivňující jadernou funkci a analýzou výsledného fenotypu odvozovali funkci daného proteinu či proteinů in vivo. A konečně strukturní biologové včetně morfologů popisovali, ať na molekulární či jaderné úrovni, strukturní změny za různých podmínek a odvozovali funkci jaderných makromolekul či kompartmentů. Částečně již v 80. letech a naplno teprve v letech 90. se všechny tři vědní disciplíny propojily a molekulárně-buněční biologové různé přístupy kombinují. To vše bylo doprovázeno rozsáhlým pokrokem v přístrojovém vybavení a metodách, jako jsou např. konfokální mikroskopie (viz Vesmír 74, 508, 1995/9) a neizotopová hybridizace in situ. A v tomto pozitivním smyslu prošly v 90. letech naše vědomosti o struktuře a funkci jádra „velkým třeskem“.
Jádro v rukou biologů
V současné době ovládla světelnou mikroskopii fluorescenční imunocytochemie, respektive fluorescenční hybridizace in situ (FISH). V imunocytochemii využíváme vysoké vazebné síly protilátky vůči antigenu, zpravidla proteinu. Místo, na něž se tato „primární“ protilátka váže, detegujeme sekundární protilátkou (tj. protilátkou proti protilátce) s kovalentně navázaným fluorochromem (např. fluoresceinem, rhodaminem nebo v současné době hojně využívanými cyaninovými fluorochromy). Ve FISH místo primární protilátky používáme sondu nukleové kyseliny, v níž je sekvence nukleotidů v délce zpravidla několik desítek až stovek nukleotidů komplementární k sekvenci DNA či RNA, kterou chceme v buňce detegovat. V podstatě ve FISH probíhá obdobná reakce jako při vazbě antiparalelních řetězců v dvojšroubovici DNA. Sonda ovšem musí obsahovat specifickou značku, modifikovaný nukleotid, vůči kterému máme k dispozici protilátku s navázaným fluorochromem. Samozřemě lze současně použít imunocytochemii a FISH (viz obrazové přílohy). Ve fluorescenčním mikroskopu osvítíme preparát dlouhovlnným UV-světlem, a tím přimějeme fluorochromy, aby vyzářily světlo ve viditelné oblasti spektra. Protože různé fluorochromy vyzařují ve vymezených vlnových délkách, lze současně detegovat několik různých antigenů či sekvencí nukleových kyselin (např. v červené, žlutozelené či fialové barvě). Imunocytochemické a FISH přístupy zpravidla (naštěstí ne vždy, viz některé dokumentované obrázky replikace a transkripce či použití hybridních proteinů GFP) vypovídají o rovnovážné distribuci makromolekul. Studujeme-li nějaký buněčný proces, detegujeme v rámci tohoto procesu jeho nejpomalejší kroky. Třeba při rychlosti eukaryontní RNA-polymerázy řádově asi 1000 nukleotidů za minutu může přepsání delších genů (např. gen dystrofinu) trvat desítky minut, ba i hodin (viz též článek E. Dráberové, Vesmír 79, 438, 2000/8).
Ke stažení
 Článek ve formátu PDF [1,27 MB]
Článek ve formátu PDF [1,27 MB] DATA A SOUVISLOSTI - Genová exprese [28,37 MB]
DATA A SOUVISLOSTI - Genová exprese [28,37 MB]