Apoptóza
Lex est non poena perire.
Smrt je zákonem, ne trestem.
(Seneca)
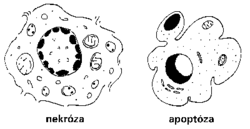
Eukaryotická buňka umírá dvěma možnými způsoby. Známějším projevem smrti je nekróza, která je vyvolána nemocí, fyzikálním poškozením nebo nedostatečným přívodem krve s následným omezením látkové výměny. Nekrotická buňka má porušenou cytoplazmatickou membránu, takže se dá např. detegovat zbarvením v roztoku trypanové modři. Má také zduřelé mitochondrie a její chromatin se shlukuje do neostře ohraničených bloků. Vnitřní membrány takové buňky postupně praskají, až se nakonec poruší soudržnost jednotlivých částí a celá buňka se rozpadne. Její změny vyvolají místní zánětlivou odpověď.
Roku 1965 byla popsána druhá forma buněčné smrti. Byla zjištěna jednak u hmyzích larev, jednak u jater po podvázání vrátnice, ale jen v nepoškozených lalocích tohoto orgánu. Nedostatečný přívod krve do části jater byl vyvážen bujením zbylých buněk, které měly dostatečné krevní zásobení. Tato kompenzace však byla zjevně regulována novou, dosud nepopsanou formou buněčné smrti. J. F. R. Kerr studoval u těchto zvláštně umírajících buněk v nepoškozené části orgánu enzym kyselou fosfatázu a zjistil, že buňky nepřijímaly trypanovou modř, neboť měly normální membrány. Jejich chromatin kondenzoval do ostře ohraničených bloků, často půlměsíčitého tvaru. Jádra při tomto procesu houstla a scvrkávala se o čtvrtinu svého objemu. Buňky vytvářely záhyby, a nakonec se rozpadly do tělísek stále ohraničených membránou. V tomto stavu byly rychle pohlceny okolními buňkami, aniž vyvolaly imunitní reakci a zánět.
Celý proces druhé buněčné smrti popsal J. F. R. Kerr r. 1972 v British Journal of Cancer a nazval jej apoptosis podle starořeckého slova pro podzimní opadávání listů, které je samo skvělým případem fyziologické neboli programované buněčné smrti (apo – dolů a ptosis – pád). V novodobé řečtině označuje však toto slovo plešatění.
Základní charakteristikou apoptózy je:
- apoptóza je aktivní proces,
- buněčné organely jsou při ní téměř nepoškozeny,
- nedochází při ní k zánětlivé reakci.
 Příčinou změn v jádře, které vedou ke smrti apoptózou, je aktivace jaderných enzymů endonukleáz. Ty rozštěpí DNA většinou na řadu fragmentů o velikosti kolem 180 párů bází (byly popsány i případy, kdy byla DNA poškozena, ovšem štěpů bylo méně), což lze prokázat na elektroforéze extrahované nukleové kyseliny v agarózovém gelu jako žebřík fragmentů (který se obarví a znázorní v ultrafialovém světle). Kromě toho lze apoptózu sledovat také průtokovou cytometrií nebo elektronovou mikroskopií. Proces probíhá v normálních tkáních, ale protože je velmi rychlý, dlouho unikal pozornosti biologie a medicíny.
Příčinou změn v jádře, které vedou ke smrti apoptózou, je aktivace jaderných enzymů endonukleáz. Ty rozštěpí DNA většinou na řadu fragmentů o velikosti kolem 180 párů bází (byly popsány i případy, kdy byla DNA poškozena, ovšem štěpů bylo méně), což lze prokázat na elektroforéze extrahované nukleové kyseliny v agarózovém gelu jako žebřík fragmentů (který se obarví a znázorní v ultrafialovém světle). Kromě toho lze apoptózu sledovat také průtokovou cytometrií nebo elektronovou mikroskopií. Proces probíhá v normálních tkáních, ale protože je velmi rychlý, dlouho unikal pozornosti biologie a medicíny.
Apoptóza může být součástí fyziologického procesu, jako je zrání orgánů a ztráta jejich funkčnosti – pak nazveme proces programovanou buněčnou smrtí, nebo je vyvolána vnějším induktorem (jako jsou glukokortikoidy, tepelný šok, ionizující záření, cytokiny, např. faktor nekrotizující nádory, viry, metabolické induktory), nebo genetickým faktorem (to je případ mutace v genu pro antigen Fas následkem inserce retroviru, případ genu p53 pro apoptózu vyvolanou ozářením a dalších genů pro apoptózu vyvolanou vazbou ligandu na receptory).
Programovaná buněčná smrt
Apoptóza ve fyziologických podmínkách je součástí životního programu buňky, tkáně a organizmu. Pro tento proces buněčné smrti se alternativně používá termín programovaná buněčná smrt. Apoptóza byla pozorována v nejrůznějších buněčných populacích:
- Během vývoje organizmu byla apoptóza popsána např. při vytváření prstů, a to tak, že podle genetického programu utvořila čtyři mezery v zakončení původně homogenní ruky plodu, dále se podílela na utváření patra, střevní sliznice, sítnice, na vývoji nervového systému a na ukončení činnosti embryonálních nebo larválních orgánů.
- V normálních dospělých tkáních se vyskytuje jak v pomalu se množících populacích buněk (u jaterních buněk, v kůře nadledvinek), tak v rychle se množících populacích (střevní sliznice, vznik spermií). Protože růstové a apoptotické faktory jsou produkovány cyklicky, buněčné dělení a smrt se střídají. Některé růstové faktory kromě toho, že stimulují dělení, mohou potlačovat buněčnou smrt.
- Při zrání buněk imunitního systému byla zaznamenána apoptóza u thymocytů (buněk thymu, které zrají v této hrudní žláze a osídlují celý organizmus; chrání jej proti virovým, plísňovým a dalším infekcím a proti nádorovým buňkám), které z 90 % zahynou při selekci, jejímž účelem je vyřadit jak buňky reagující agresivně s vlastními bílkovinami organizmu – tedy rozpoznávající své jako cizí – tak i další buňky, které naopak nerozpoznávají své. Kromě toho byla zjištěna apoptóza i u B-lymfocytů, které jsou určeny k tvorbě protilátek (apoptóza probíhá ve slezině a uzlinách na rozhraní tmavé a světlé zóny mikroskopických tělísek zvaných folikuly). Program buněčné smrti vyřazuje opět lymfocyty tvořící protilátky proti složkám organizmu a také málo specifické protilátky, jež se vážou na více různých antigenů, čímž snižují přesnost imunitní odpovědi.
- Byla pozorována i ve spojitosti s hormonálními změnami ukončení života folikulů ve vaječníku, vlasových váčků, zmenšení mléčné žlázy, děložní výstelky po říji, dělohy po porodu, kůry nadledvinek v novorozeneckém období.
- U stárnoucích buněk byla zjištěna u megakaryocytů po vzniku a uvolnění krevních destiček, u fagocytů a u buněk oční čočky. Zdá se tedy, že proces apoptózy zasahuje do většiny, ne-li do všech buněčných populací v těle. Je to hlavní regulátor stavebního plánu, podle kterého je udržována struktura mnohobuněčného organizmu.
Případ jemného červa
Programovaná buněčná smrt je významným dějem při utváření organizmu během jeho vývoje. Modelem pro tento proces se stala maličká hlístice Caenorhabditis elegans. Tělo tohoto červa obsahuje (jako ostatně mnoho jiných malých bezobratlých živočichů) předem naprogramované množství buněk, a to celých 959. Během vývoje musí na přesně určených místech jeho těla 131 buněk v určitém stadiu ontogeneze zaniknout. Apoptózu navozují geny ced-3 a ced-4, zatímco gen ced-9 ji potlačuje. Je to neuvěřitelná obdoba pohádky o živé a mrtvé vodě. V přírodě ovšem není nic takto jednoduché a přímočaře jednoznačné.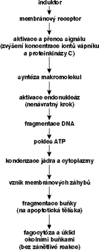 Podobný regulační význam má gen bcl-2. Bylo zjištěno, že u nádorového onemocnění – lymfomu folikulárních B-lymfocytů – dochází k přemístění tohoto genu a tím jsou vyřazeny regulační mechanizmy smrti postižených lymfocytů. Bílé krvinky se stanou nesmrtelnými.
Podobný regulační význam má gen bcl-2. Bylo zjištěno, že u nádorového onemocnění – lymfomu folikulárních B-lymfocytů – dochází k přemístění tohoto genu a tím jsou vyřazeny regulační mechanizmy smrti postižených lymfocytů. Bílé krvinky se stanou nesmrtelnými.
Změny tohoto genu byly zjištěny také u buněk infikovaných virem Epsteina a Barrové. C. D. Gregory prokázal, že výše uvedený virus chrání dokonce lymfocyty B i před indukovanou smrtí apoptózou.
Sebevražda pomocných buněk
Jiné mikroorganizmy naopak apoptózu vyvolávají. To by mohl být případ hromadné smrti pomocných lymfocytů T po infekci virem HIV při aidsu. Skupina Jeana Clauda Ameisena z Pasteurova ústavu ve francouzském městě Lille nedávno zjistila, že pomocné lymfocyty lidí infikovaných virem HIV jsou citlivé na některé aktivační signály a hromadně zanikají apoptózou. Látka PWM (zkratka pro pokeweed mitogen izolovaný z kořenů Phytolacca americana) nebo stafylokokový enterotoxin SEB způsobí u pomocných lymfocytů osob pozitivních na protilátky proti viru HIV (tedy tímto virem v minulosti infikovaných) zánik ve 40 % případů, zatímco u ostatních T-lymfocytů pouze v 5 %. To ukazuje na zajímavou skutečnost, že pro imunitu nepostradatelné pomocné T-lymfocyty jsou při aidsu vyřazeny apoptózou a nikoliv destrukcí virem HIV. Virus tyto bílé krvinky pouze zcitliví na program buněčné smrti a tento program je spuštěn vždy znovu při určité aktivaci buňky. Populace pomocných T-lymfocytů je takto v průběhu aidsu neustále vybíjena a jejich snižující se počet patří k vážným příznakům zhoršení prognózy onemocnění. Ani u pacientů s pokročilým stavem však není možné nalézt virus HIV v lymfocytech krve. Ve své hotové formě se nalézá většinou v lymfatických uzlinách, v makrofázích a dendritických buňkách, které jej při své spolupráci s T-lymfocyty (při předkládání každého antigenu) neustále těmto buňkám předávají. V lymfocytech je však informace viru HIV ukryta v genomu a zde přetrvává po léta. V tom lze spatřovat zákeřnost viru HIV, podobně jako je tomu u jeho příbuzných retrovirů, které způsobují hlavně nádorová onemocnění.Apoptóza jako regulace živých struktur
Apoptóza probíhá rychle zejména při spřažení s cytotoxickou reakcí zabíjení cílových buněk profesionálními zabíječi imunitního systému. V takovém případě může dojít ke smrti během jediné hodiny. Jindy, jako při hormonální indukci, se protáhne na celých 24 hodin.Apoptóza je regulována genetickými, růstovými i některými dalšími činiteli, jejichž výčet každým rokem narůstá (namátkou uvedeme vápníkové ionty a jejich přenašeče, cytokiny, mimobuněčnou ATP, prostaglandin PGE, ionizující záření a kortikosteroidy). U mnoha buněk působí jako antagonista apoptózy látka, která posune buňku do jiného diferenciačního a funkčního stavu (cytokiny, ligandy receptorů, antigen, proteinkináza C, inhibitory proteáz).
Imunitní systém je na jevu apoptózy zcela závislý, a proto porušení tohoto procesu, jako při aidsu, má fatální následky. Třetina všech lymfocytů zanikne každý den při dozrávání. Tato selekce je fyziologická a nesmí vyvolat zánětlivou reakci. Kdyby měl totiž imunitní systém reagovat proti svým plánovaným ztrátám stejně jako proti patologicky poškozeným buňkám, byl by okamžitě zaplaven silně jedovatými produkty metabolického vzplanutí fagocytů a nebylo by v jeho silách tento totální boj proti svým složkám zastavit. Je dobře známo, že občanská válka je nejničivější ze všech způsobů boje, a proto je hlavní strategií organizmu ukončení života nefunkčních částí nenásilným odklízením, tedy jakousi formou vnitřní policie. Proto apoptóza unikala donedávna pozornosti badatelů cytologických věd. Toto nenápadné odklízení buněk v mnohobuněčném organizmu je součástí homeostázy, neboli snahy o udržení vnitřního prostředí, podobně jako smrt organizmů je součástí homeostázy celé biosféry.
Bcl-2
...Ovšem ne všechny dlouhožijící tkáně vykazují protein Bcl-2. Tento protein nebyl imunohistochemicky detegován v kosterní svalovině a v několika dalších buňkách mezenchymového původu. Protein Bcl-2 interaguje s dalším integrálním membránovým proteinem bax za tvorby homodimerů. Buňky s nadprodukcí bax jsou citlivější k apoptóze, ačkoli sama produkce tohoto proteinu apoptózu nevyvolá. Při převaze proteinu Bcl-2 je zase vyvázán bax a přebytečné molekuly Bcl-2 buňku ochrání před apoptózou. Ochranná funkce Bcl-2 tedy závisí na jeho interakci s proteinem Bax. Protein Bcl-2 ochraňuje buňky nejen před apoptotickou smrtí, ale také před neprogramovanou nekrotickou smrtí. To slibuje terapeutické využití Bcl-2 u mozkového traumatu, mrtvice i neurodegenerativních onemocnění.















