Polymerní cytostatika
 V roce 1906 formuloval německý lékař Paul Ehrlich (obrázek) myšlenku „kouzelné střely“. K dispozici měl již slušný výběr účinných léků, které mohl podávat těžce nemocným lidem. Problém byl ale v tom, že použité léky neútočily jenom na nemocné buňky, nýbrž zabíjely i buňky zdravé. Tato jejich vlastnost znemožňovala agresivnější léčbu – vyšší dávka léčiva znamenala pro pacienta neúměrně vysoké riziko. Jak to vyřešit? Jedinou možností bylo použít léčivo ve formě „kouzelné střely“ – nasměrovat ho k nemocné tkáni tak, aby působilo pouze na ni. Myšlenka na pohled jednoduchá, ale trvalo přes půl století, než úroveň vědomostí v medicíně, biologii, imunologii a chemii umožnila první pokusy, kterými bylo možné ověřit, zda vůbec je „kouzelná střela“ realizovatelná.
V roce 1906 formuloval německý lékař Paul Ehrlich (obrázek) myšlenku „kouzelné střely“. K dispozici měl již slušný výběr účinných léků, které mohl podávat těžce nemocným lidem. Problém byl ale v tom, že použité léky neútočily jenom na nemocné buňky, nýbrž zabíjely i buňky zdravé. Tato jejich vlastnost znemožňovala agresivnější léčbu – vyšší dávka léčiva znamenala pro pacienta neúměrně vysoké riziko. Jak to vyřešit? Jedinou možností bylo použít léčivo ve formě „kouzelné střely“ – nasměrovat ho k nemocné tkáni tak, aby působilo pouze na ni. Myšlenka na pohled jednoduchá, ale trvalo přes půl století, než úroveň vědomostí v medicíně, biologii, imunologii a chemii umožnila první pokusy, kterými bylo možné ověřit, zda vůbec je „kouzelná střela“ realizovatelná.
Jak dopravit léčivo k postižené buňce?
Hlavním problémem bylo hledání „poštovního doručovatele“, který by léčivo uložil na správnou „adresu“. Tou „adresou“ je míněn znak, jímž se cílová buňka liší od buněk zdravých. A právě v tom je největší potíž. Najít takový stálý znak není snadné, protože buňky svůj povrch často mění v závislosti na prostředí – a o nádorových buňkách to platí dvojnásob! Snaží se uniknout pozornosti svého nedobrovolného hostitele, a proto se mění mnohem víc než buňky zdravé. Je tedy neobyčejně obtížné (neli nemožné) najít způsob jak „kouzelnou střelou“ zasáhnout všechny nemocné buňky najednou.
Prvními „poštovními doručovateli“ byly protilátky. To jsou molekuly bílkovin, které vznikají jako velmi specifická obrana organizmů proti cizím, potenciálně nebezpečným látkám – antigenům. Jestliže má nemocná buňka takový jedinečný antigen na svém povrchu, mělo by být vyhráno. První pokusy o „kouzelnou střelu“ proto představovaly konjugáty 1) vybraného léčiva a polyklonálních protilátek (vázajících se na různé antigeny na povrchu jedné cílové buňky).
Mezníkem pro směrovaná léčiva byl rok 1975, kdy G. Köhler a C. Milstein uveřejnili v časopise Nature postup přípravy monoklonálních protilátek vyznačujících se vysokou specifitou (za tento objev jim byla r. 1984 udělena Nobelova cena). Tím začala éra imunotoxinů – konjugátů monoklonálních protilátek 2) a vysoce účinných jedů, jako jsou ricin nebo cholerový toxin. Smrtelně jedovaté látky, jejichž jediná molekula dokáže zabít cílovou buňku, byly vybrány záměrně. Bez směrování je k léčbě použít nelze, ale kdyby se podařilo „vystřelovat je přímo na cíl“, došla by Ehrlichova myšlenka naplnění. A tak se imunotoxiny dostaly až do klinického testování.
V téže době (r. 1975) formuloval německý polymerní chemik Helmuth Ringsdorf představu o tom, jak by se k směrování daly využít vodorozpustné polymery. Nemohl tušit, že řeší jeden z problémů, s nimiž se později bude potýkat vývoj imunotoxinů. Toxin je totiž na molekulu protilátky navazován poměrně nahodile, protože jak on, tak protilátka mají řadu funkčních skupin, které mohou do reakce vstupovat. Výsledný produkt nebývá proto pokaždé stejný, a v důsledku toho je pokaždé trochu jiné i jeho působení na cílovou tkáň. Lépe se „odhaduje“ směrované polymerní léčivo. Jeho základem je polymerní nosič s určitým počtem známých reaktivních chemických skupin, na které lze vybranou chemickou reakcí navázat jak léčivo, tak směrující molekulu. Dnes víme, že směrující molekulou nemusí být jen protilátky, posloužit mohou také cukry, lektiny (bílkoviny vázající cukry) či růstové hormony, prostě molekuly, pro které má cílová buňka specifický znak – receptor.
Směrovaná a nesměrovaná polymerní léčiva
Klasická chemoterapie ničí všechny intenzivně rostoucí buňky a buněčné systémy, nemocné i zdravé. Je sice pravda, že velmi rychle rostoucí zhoubné buňky jsou vůči chemoterapii citlivější, přesto však bývají zároveň poškozovány buňky kostní dřeně, a někdy (podle použitého léčiva) i buňky dalších orgánů. Klasická chemoterapie také poškozuje imunitní systém pacienta, a přitom právě dobře fungující obranný systém je důležitý pro konečnou likvidaci nádorového onemocnění.
 Zabíjení zdravých buněk spolu s nemocnými je velkým problémem zejména u vysokodávkové terapie, která je svým způsobem nebezpečná. Proto je nutné hledat další účinné způsoby léčby. Pokusy s vodorozpustnými polymerními léčivy 3) sice ukázaly, že jsou tyto látky nejúčinnější, jestliže jsou směrovány, ale zvýšenou účinnost oproti klasickým nízkomolekulárním léčivům mají i polymerní konjugáty nesměrované. Proč? Hlavní rozdíl mezi nízkomolekulární a vysokomolekulární (polymerní) formou léčiva je v jejich distribuci, aktivaci a mechanizmu pronikání do buňky.
Zabíjení zdravých buněk spolu s nemocnými je velkým problémem zejména u vysokodávkové terapie, která je svým způsobem nebezpečná. Proto je nutné hledat další účinné způsoby léčby. Pokusy s vodorozpustnými polymerními léčivy 3) sice ukázaly, že jsou tyto látky nejúčinnější, jestliže jsou směrovány, ale zvýšenou účinnost oproti klasickým nízkomolekulárním léčivům mají i polymerní konjugáty nesměrované. Proč? Hlavní rozdíl mezi nízkomolekulární a vysokomolekulární (polymerní) formou léčiva je v jejich distribuci, aktivaci a mechanizmu pronikání do buňky.
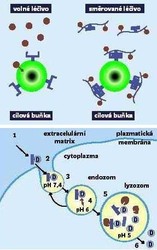
Aktivní směrování
je to, kterému Paul Ehrlich ve svých představách říkal „kouzelná střela“. Součástí polymerního konjugátu léčiva je „poštovní doručovatel“, jímž je směrující molekula. Ta hledá cílovou buňku s odpovídajícím receptorem, na nějž se potom naváže. Je to jistě nejlepší, nejúčinnější, ale zároveň technicky nejnáročnější způsob směrování léčiv. Potýká se s tím, že jen málo nemocných buněk vystavuje specifi cké receptory, a téměř nikdy je nevystavují všechny nemocné buňky. Dnes ovšem víme, že aktivní směrování není jediný způsob, jímž lze léčivo ve vyšší koncentraci k cílové tkáni dopravit.Pasivní směrování
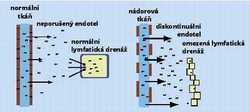
objevil japonský lékař H. Maeda se spolupracovníky. Všiml si obecně platného jevu, který způsobuje, že se makromolekulární látky v pevných (solidních) nádorech hromadí. Na rozdíl od normálních cév propouštějí cévy zásobující nádor z krevního řečiště i veliké molekuly. Ty se v pevných nádorech – s omezeným lymfatickým odvodem – hromadí (obrázek). S trochou nadsázky lze říci, že se nádor k makromolekulám chová jako vysavač (proto se pasivnímu směrování říká též pasivní akumulace). Tím se zároveň vysvětluje, proč i nesměrovaná makromolekulární polymerní léčiva mívají výrazně lepší farmakologický účinek než klasická nízkomolekulární cytostatika.K výhodám polymerních chemoterapeutických látek patří aktivní směrovatelnost a pasivní akumulovatelnost, zvýšená účinnost, vyšší maximalní tolerovaná dávka, nižší zabíjení zdravých buněk, neaktivnost látky během transportu, resp. uvolňování účinné složky až v cílové buňce, dlouhodobé přetrvávání v organizmu, a v důsledku toho i dlouhodobá terapeutická využitelnost a ochrana imunitního systému.
Vlastnosti chemoterapeutik využívajících vodorozpustný polymerní nosič HPMA
Makromolekulární chemoterapeutika, v nichž jsou léčiva vázána kovalentní vazbou na vodorozpustný polymerní nosič HPMA, 4) jsou chráněna československo-anglickým patentem. Je jich dalšímu výzkumu se věnují laboratoře v řadě zemí včetně Spojených států a Velké Británie, intenzivní výzkum probíhá i v České republice. 5) Na polymerní řetězec nosiče je léčivo navázáno spojkou tvořenou několika aminokyselinami (obrázek). Výběr vhodné spojky je pro farmakologickou aktivitu polymerního konjugátu velmi důležitý. Kovalentní vazba mezi spojkou a léčivem totiž musí být tak stabilní, aby zaručovala neúčinnost toxické látky během transportu. Přitom však musí být štěpitelná uvnitř cílové buňky, a to buď hydrolyticky, nebo enzymaticky, tj. lyzozomálními enzymy. Tím se uvolněné léčivo aktivuje – a z nefunkčního proléčiva se stává aktivní léčivo (obrázek).
Biologická snášenlivost.
Syntetický nosič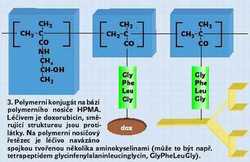 se v pacientově organizmu nehromadí, protože je snadno vylučován močí. Experimentální studie na zvířecích modelech prokázaly, že ani dlouhodobé denní podávání vysokých dávek neblokuje fagocytózu, buněčnou nebo protilátkovou imunitní odpověď, neovlivňuje krevní obraz, nepoškozuje orgány, jako jsou játra, slezina, ledviny a plíce.
se v pacientově organizmu nehromadí, protože je snadno vylučován močí. Experimentální studie na zvířecích modelech prokázaly, že ani dlouhodobé denní podávání vysokých dávek neblokuje fagocytózu, buněčnou nebo protilátkovou imunitní odpověď, neovlivňuje krevní obraz, nepoškozuje orgány, jako jsou játra, slezina, ledviny a plíce.Biologická aktivita.
Léčiva využívající nosič HPMA jsou účinná jak in vitro, tak in vivo. V experimentu dokáže konjugát směrovaný monoklonálními protilátkami nejen zpomalit růst nádoru, ale dokonce zlikviduje agresivně rostoucí nádor tak důkladně, že se onemocnění nevrátí ani po řadě měsíců. Vyšší aktivitu než klasická cytostatika mají i nesměrované polymerní konjugáty. Je to způsobeno tím, že se – jako makromolekuly – mohou v nádorech pasivně akumulovat. Mimořádně důležité je i zjištění, že tento typ nových chemoterapeutik může částečně překonat i obávanou mnohočetnou lékovou rezistenci.Minimální zabíjení zdravých buněk.
Jak experimentální, tak předběžné klinické zkoušky u lidí prokázaly, že makromolekulární chemoterapeutika mají jen minimální vedlejší účinky.Pozitivní vliv na imunitu.
Od každé další generace protinádorových léčiv se očekává zlepšená schopnost zabránit nádorovému růstu. Tomuto požadavku konjugáty HPMA nepochybně vyhovují. Příjemným překvapením však je, že navíc pozitivně ovlivňují imunitu.Proč cytostatika s tímto polymerním nosičem podporují imunitu?
Působení těchto cytostatik na imunitu se intenzivně zkoumá. Na pozitivním výsledku se podílí několik mechanizmů, z nichž známe jen některé. Zmiňme možnosti, o nichž již víme:
Možnost chránit buňky imunitního systému před „protiútokem“ nádoru.
K mechanizmům, jimiž nádory unikají imunitní obraně, patří „Fas-protiútok“. Fas-receptor a Fas-ligand 6) jsou regulační transmembránové proteiny, jejichž spojení vyvolává kaskádu dějů končících „sebevraždou“ (apoptózou) buňky, která Fas-receptor vystavuje. Tento receptor a jeho ligand používají za normálních okolností buňky imunitního systému, jako jsou T-lymfocyty, „přirození zabíječi“ (NK-buňky) a epitelové buňky imunologicky „privilegovaných orgánů“ (očí, varlat, mozku). Navázání ligandu na receptor nepotřebnou aktivaci T-buněk vystavujících Fas-receptor „sebevražedně“ nebo „bratrovražedně“ ukončí v momentě, kdy imunitní reakce namířená proti konkretnímu nebezpečí, například infekci, již není zapotřebí a má být zastavena. Také epitelové buňky „privilegovaných orgánů“ vystavují na povrchu Fas-ligand a získávají tím schopnost zabíjet buňky s povrchovým Fas-receptorem, které do „privilegovaných orgánů“ čas od času přicestují a mohly by vyvolat zánět, a tím ohrozit jejich funkci.
Nádory se chovají jako paraziti, využívají všechny možnosti k tomu, aby unikly zničení. Některé například vystavují Fas-ligandy a (podobně jako epitelové buňky očí, varlat či mozku) zabíjejí buňky imunitního systému s protinádorovou aktivitou. Léčba některými klasickými chemoterapeutiky vystavení Fas-ligandů zvyšuje, a tím vlastně imunitní systém oslabuje. Polymerní cytostatika (směrovaná i nesměrovaná) vystavení Fas-ligandů nezvyšují, a tedy podporují likvidaci nádoru přirozenými imunologickými mechanizmy.
Možnost vyvolat odolnost vůči původnímu nádoru.
 Na třech různých experimentálních nádorových modelech bylo již prokázáno, že myši vyléčené z experimentálního nádoru cytostatikem doxorubicinem navázaným na nosič HPMA a směrovaným monoklonální protilátkou získávají vůči nádoru odolnost. Jsou-li totiž vyléčené myši po mnoha měsících znovu vystaveny dávce nádorových buněk, která všechny kontroly zabije, významné procento vůbec neonemocní. Vysvětlit to lze pouze tím, že léčba zároveň navodila protinádorovou odolnost. Při analýze odpovědných mechanizmů byla zjištěna aktivace některých buněčných systémů, jako jsou „přirozené zabíječské buňky“, účast dalších možných mechanizmů se studuje. Některá z polymerních cytostatik se předběžně testují klinicky (viz rámeček) i v České republice.
Na třech různých experimentálních nádorových modelech bylo již prokázáno, že myši vyléčené z experimentálního nádoru cytostatikem doxorubicinem navázaným na nosič HPMA a směrovaným monoklonální protilátkou získávají vůči nádoru odolnost. Jsou-li totiž vyléčené myši po mnoha měsících znovu vystaveny dávce nádorových buněk, která všechny kontroly zabije, významné procento vůbec neonemocní. Vysvětlit to lze pouze tím, že léčba zároveň navodila protinádorovou odolnost. Při analýze odpovědných mechanizmů byla zjištěna aktivace některých buněčných systémů, jako jsou „přirozené zabíječské buňky“, účast dalších možných mechanizmů se studuje. Některá z polymerních cytostatik se předběžně testují klinicky (viz rámeček) i v České republice.
Literatura
P. Ehrlich, Studies in Immunity, Plenum Press, New York 1906G. Mathé, T. B. Loc, J. Bernard, Compte-rendus de l’Académie des Sciences 3, 1626, 1958
G. Köhler, C. Milstein, Nature 256, 495, 1975
H. Ringsdorf, J. Polym. Sci. Polym. Symp. 51, 135, 1975
H. Maeda a Y. Matsumura, CRC Crit. Rev. Ther. Drug Carrier Syst. 6, 193, 1987
R. Duncan, Anticancer Drugs 3, 175, 1992
K. Ulbrich, M. Pechar, J. Strohalm, V. Šubr, B. Říhová, Ann. NY Acad. Sci. 831, 47–56, 1997
J. Kopeček, P. Kopečková, T. Minko, Z. R. Lu, Eur. J. Pharm. Biopharm. 50, 61–81, 2000
B. Říhová, Adv. Drug Del. Rev. 54, 653–674, 2002
B. Říhová, J. Strohalm, K. Kubáčková, M. Jelínková, O. Hovorka, M. Kovář, D. Plocová, M. Šírová, M. Šťastný, L. Rozprimová, K. Ulbrich, J. Control. Rel. 78, 97–114, 2002
Poznámky
KLINICKÉ TESTOVÁNÍ POLYMERNÍCH CYTOSTATIK
Ve světě se nyní testuje osm polymerních konjugátů cytostatik, z nichž pět je na bázi HPMA. V Československu byl farmorubicin (cytostatikum) a směrující imunoglobulin navázaný na nosič HPMA použit již r. 1992 v IKEM, a to k léčbě pacientky, která podstoupila transplantaci srdce pro diagnózu angiosarkomu (zhoubného nádoru srdečního svalu). Na základě licenčních dohod s Cancer Research Campaign ve Velké Británii však bylo předběžné klinické testování v České republice obnoveno až na podzim roku 2000, a to ve spolupráci s Radioterapeuticko-onkologickým oddělením Fakultní nemocnice v Motole v Praze a za podpory Léčiv, a.s. První publikace obsahující klinické výsledky s cytostatikem navázaným na HPMA vyšla v Anglii r. 1999, první klinické výsledky se složitějším konjugátem, který již obsahoval směrující molekulu, byly uveřejněny českými autory r. 2002. Konjugát doxorubicinu navázaného na nosič HPMA a směrovaný lidským imunoglobulinem je jako podpůrná terapie zkoušen u pacientek s pokročilým karcinomem prsu. Podání cytostatika na polymerním nosiči, který obsahuje současně lidský protein jako směrující složku, je světovou premiérou. Dosud zkoušená polymerní léčiva byla buď nesměrovaná, nebo směrovaná galaktosaminem.
Ke stažení
 článek v PDF [262,09 kB]
článek v PDF [262,09 kB]






