Mohou tkáňové kultury sloužit jako model ke studiu bolesti?
Bolest definovaná jako nepříjemný senzorický zážitek, spojený se skutečným nebo potenciálním poškozením organizmu , nepředstavuje každodenní zkušenost. Na rozdíl od ostatních smyslů, jako jsou zrak, sluch, čich nebo dotyk, které jedinci umožňují smysluplnou interakci se zevním prostředím, je bolest varovným signálem. Má však i další dimenzi. Při delším trvání je spojena s utrpením, které představuje nejen lékařský, ale i sociálně-ekonomický a etický problém.
I když bylo předloženo velké množství nervových modelů bolesti, všechny mají společné základní rysy (obrázek). Nejčastější příčinu bolesti představuje podráždění volných nervových zakončení, která jsou uložena v kůži, kloubním vazivu, svalech, výstelkách vnitřních dutin, vazivových pouzdrech orgánů a dalších. Volná nervová vlákna jsou vzhledem ke svým malým rozměrům nedostupná pro studium moderními elektrofyziologickými technikami, jimiž by bylo možné objasnit mechanizmy vzniku jejich podráždění. Existují však souhlasné experimentální údaje o tom, že dostředivá nervová vlákna, která vedou informaci o bolestivém dráždění (nociceptory), patří do skupiny slabě myelinizovaných1) Aδ a nemyelinizovaných C-vláken, která vykazují malou rychlost vedení. Značná část Aδ a C-vláken však neslouží pouze bolesti, nýbrž i jiným modalitám čití, jako je např. teplo. Nelze proto podle rychlosti vedení nervových vláken jednoznačně rozhodnout, která z nich slouží bolesti. 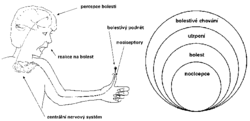 Lze však vyloučit, že by to mohla být silná, rychle vedoucí aferentní (dostředivá) vlákna skupiny Aα nebo Aβ, která vycházejí ze svalových vřetének a šlachových tělísek, jež slouží přenosu senzorické informace o pohybu a poloze končetin, nebo z kožních receptorů pro dotyk a tlak.
Lze však vyloučit, že by to mohla být silná, rychle vedoucí aferentní (dostředivá) vlákna skupiny Aα nebo Aβ, která vycházejí ze svalových vřetének a šlachových tělísek, jež slouží přenosu senzorické informace o pohybu a poloze končetin, nebo z kožních receptorů pro dotyk a tlak.
Psychofyziologické studie na člověku a studie jednotkové aktivity registrované z izolovaných nervových vláken zásobujících kůži nebo klouby naznačují, že mezi nociceptory existují značné rozdíly, pokud jde o způsoby, jimiž v nich lze vyvolat impulzní aktivitu. Tato diverzita může být i jednou z příčin, které vedou k rozdílům v charakteru a intenzitě bolesti již na tomto primárním článku složité kaskády integračních pochodů, jež v nervovém systému probíhají (viz Vesmír 70, 252, 1991/5).
Analogií výsledků studia izolovaných neuronů centrální nervové soustavy (CNS) lze předpokládat, že nervová zakončení nociceptorů mají ve své plazmatické membráně zabudovány proteinové komplexy tvořící iontové kanály, jež mohou být buď v uzavřeném, nebo v otevřeném stavu, kdy jimi mohou procházet ionty. Kanály jsou zpravidla vysoce selektivní pro určité ionty a jejich aktivita je řízena elektricky nebo chemicky. Některé z nich jsou však zřejmě citlivé i na mechanické a tepelné podněty. Tyto proteiny se vytvářejí složitým procesem genové exprese v buňce, odkud jsou transportovány a včleňovány do plazmatické membrány, často v přesně vymezené oblasti. Otevření nebo uzavření kanálů mění tok iontů mezi intracelulárním a extracelulárním prostorem a tak mění i pravděpodobnost vzniku vzruchové aktivity, která předává informaci o bolestivém dráždění do CNS. Tyto poznatky vedly dr. Baccagliniho a dr. Hogana z Neurobiologického ústavu Harvardovy lékařské fakulty již r. 1983 k myšlence, že tkáňové kultury neuronů ganglií zadních kořenů míšních (GZKM), které představují buněčná těla dostředivých nervových vláken, mohou být vhodným modelem pro studium biofyzikálních mechanizmů nocicepce. I když vývoj technik izolace a kultivace neuronů GZKM od té doby doznal výrazného pokroku, nejčastější námitkou proti tomuto experimentálnímu přístupu bývá, že nelze bezpečně určit, které neurony v tkáňové kultuře nociceptory představují, a že není jisté, do jaké míry jejich kultivace může pozměnit expresi bílkovinných struktur plazmatické membrány.
V tomto přehledu jsme se pokusili shrnout dosavadní poznatky o biofyzikálních vlastnostech senzorických neuronů a ukázat, že další výzkum jejich chemosenzitivity především vůči algogenům, tj. chemickým látkám, které u člověka vyvolávají bolest, může v brzké době pomoci k vypracování kritérií pro rozpoznávání nociceptorů v krátkodobé kultuře.
Senzorické neurony v tkáňové kultuře
Ganglia zadních kořenů míšních laboratorních potkanů nebo žab lze poměrně snadno uvolnit a pomocí enzymů kolagenázy a trypsinu z nich izolovat jednotlivé neurony. Tyto neurony lze pak pěstovat v kultivačních miskách, jejichž dno je potaženo kolagenem nebo polylyzinem (obrázek). Při izolaci ztrácejí neurony své výběžky, které začnou znovu vyrůstat po dvou dnech kultivace. Podle velikosti je lze rozdělit do tří skupin. Velké neurony (A), které mají průměr větší než 50 μm, střední neurony (B), které mají průměr mezi 30 a 50 μm, a neurony malé (C) o průměru menším než 30 μm.Biofyzikální vlastnosti izolovaných neuronů lze dnes dobře vyšetřovat pomocí moderní elektrofyziologické techniky terčíkového zámku (technika patch-clamp), za jejíž vývoj a průkaz existence iontových kanálů byla Neherovi a Sakmannovi udělena r. 1991 Nobelova cena. Hladký povrch neuronů pěstovaných v tkáňové kultuře vytváří ideální podmínky pro přisátí elektrod k membráně. Její následné protržení umožňuje měření membránových proudů, které vznikají otevřením iontových kanálů za různých experimentálních podmínek, jako je změna membránového potenciálu nebo působení různých chemických látek na povrchu neuronu (obrázek).
Napěťově závislé iontové kanály
Z napěťově závislých iontových kanálů, které jsou zodpovědné za vznik a šíření vzruchové aktivity, jsou poměrně dobře prostudovány kanály sodíkové a vápníkové. Experimentální práce dokazují přítomnost dvou typů sodíkových kanálů: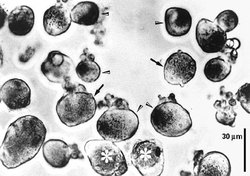
- sodíkové kanály, které se blokují
- sodíkové kanály, které nejsou citlivé na tetrodotoxin (≤1μM) a jsou přítomny především na malých neuronech typu C a v menší míře též na neuronech střední velikosti, typu B.
tetrodotoxinem, jsou přítomny hlavně na velkých neuronech GZKM typu A,
Vápníkové kanály se vyskytují převážně u malých a středních neuronů typu C a B.
Funkční význam sodíkových kanálů, které nejsou citlivé na tetrodotoxin, není zatím objasněn. Ve studiích, které tento typ sodíkových kanálů prokazují, nejsou sice pochyby o tom, že měřený proud byl skutečně nesen sodnými jonty, ale experimentální podmínky, při nichž byla výrazně snížena koncentrace Ca2+ v extracelulární tekutině, nevylučují možnost, že Na+ procházel funkčně pozměněnými vápníkovými kanály. Pro tuto možnost svědčí i vlastní práce na kultivovaných neuronech GZKM žáby, která ukázala, že veškerý dovnitř směřující membránový proud vyvolaný depolarizačními skoky lze zcela potlačit tetrodotoxinem, jestliže jsou vápníkové kanály blokovány Cd2+. Vyřešení tohoto problému může mít zásadní význam pro rozpoznávání nociceptorů v tkáňové kultuře. Není totiž vyloučeno, že vápníkové kanály, které jsou fylogeneticky starší, se mohou vyskytovat u nociceptorů, kdežto sodíkové kanály se mohou podílet na vzniku vzruchové aktivity u aferentních systémů, jež slouží hmatovému čití, nebo aferentní signalizaci vycházející ze svalových vřetének a šlachových tělísek. V souladu s touto představou jsou i fylogenetické studie vývoje spinotalamických drah, které dokazují, že dráhy pro bolest se vyvíjejí podstatně dříve než dráhy pro hmatové čití.

Chemicky závislé iontové kanály
Na tělech senzorických neuronů, které jsou u všech obratlovců uloženy mimo míchu, se nevytvářejí žádné synapse. Proto bylo značným překvapením, když se zjistilo, že se na nich vyskytují receptory spojené s iontovými kanály, které lze aktivovat chemickými látkami, z nichž některé představují chemické přenašeče typické pro centrální synapse, jako je např. kyselina glutamová, kyselina gama-aminomáselná (GABA), serotonin nebo ATP. Existují však i jiné chemické látky nemediátorové povahy, jejichž aplikace v těsné blízkosti neuronů vyvolává membránové proudy, které mohou vést ke vzniku impulzní aktivity. Při výzkumu periferních mechanizmů bolesti mají význam především ty látky, o nichž je známo, že u člověka vyvolávají bolest, a nazývají se proto algogeny (ř. algos = bolest). Některé se uvolňují při zánětlivých procesech - např. bradykinin, prostaglandin E a histamin. Jiné jsou cizorodé, např. capsaicin, dobře známý jako pálivá substance obsažená v některých odrůdách papriky. Velmi účinným algogenem jsou i slabé kyseliny.
Existují však i jiné chemické látky nemediátorové povahy, jejichž aplikace v těsné blízkosti neuronů vyvolává membránové proudy, které mohou vést ke vzniku impulzní aktivity. Při výzkumu periferních mechanizmů bolesti mají význam především ty látky, o nichž je známo, že u člověka vyvolávají bolest, a nazývají se proto algogeny (ř. algos = bolest). Některé se uvolňují při zánětlivých procesech - např. bradykinin, prostaglandin E a histamin. Jiné jsou cizorodé, např. capsaicin, dobře známý jako pálivá substance obsažená v některých odrůdách papriky. Velmi účinným algogenem jsou i slabé kyseliny.
Algogeny
1. Slabé kyseliny (pH 6.1) aplikované na obnažené korium vyvolávají bolest u člověka a nocicepční reakce u všech obratlovců. V minulosti byly proto považovány za univerzální algogen. Na neuronech GZKM vyvolávají dva typy dovnitř směřujících membránových proudů:- Dovnitř směřující, rychle inaktivující membránový proud, který je nesen ionty Na+, jež procházejí protonizovanými vápníkovými kanály. Tento proud nesplňuje kritéria typu proudu, který je zodpovědný za vznik bolesti, neboť inaktivuje během dvou vteřin, kdežto bolest trvá po celou dobu působení kyselého roztoku. Vyskytuje se nespecificky asi u 30 % neuronů - nejen GZKM (malých a velkých), ale i u všech typů neuronů izolovaných z různých oblastí CNS, které byly až dosud zkoumány.
- Dovnitř směřující neinaktivující proud, nesený monovalentními kationty bez výraznějších rozdílů. Byl zjištěn asi u 45 % neuronů GZKM. Je výrazně větší u malých neuronů. Tento membránový proud splňuje kritéria možného zdroje impulzní aktivity, která vyvolává bolest. Proud nelze blokovat tetrodotoxinem, ale dosud není nic známo o struktuře tohoto typu kanálů.
Protonizace při okyselení zevního prostředí rovněž pozměňuje funkci řady napěťově závislých a receptorově řízených iontových kanálů. Snížení pH v extracelulárním roztoku působí u značného počtu neuronů GZKM žáby zvýšení vstupního odporu, jehož podstata nebyla dosud plně objasněna. I když se prokázalo, že snížení pH výrazně blokuje vysokoprahové vápníkové kanály, neexistují zatím údaje o tom, jak působí na draslíkové kanály. Jejich blokáda by se mohla podílet na zvýšení excitability nociceptorů a představovat tak další mechanizmus vzniku bolesti.
2. O serotoninu je dlouho známo, že vyvolává u člověka bolest, jestliže je aplikován na obnaženou spodinu puchýře, který lze vyvolat některými dráždivými látkami. I když byla analyzována molekulární struktura řady subtypů serotoninových receptorů, největší zájem z hlediska nocicepce se soustřeďuje na receptory typu 5-HT3 a 5-HT2. Na neuronech GZKM serotonin vyvolává dovnitř směřující, rychle inaktivující membránový proud, který je nesen nespecificky monovalentními kationty. Tento proud vzniká aktivací 5-HT3 receptorů a lze jej zjistit asi u 60 % malých neuronů. Vzhledem k rychlé desenzitizaci se nezdá být pravděpodobné, že by tento proud mohl být zdrojem trvající impulzní aktivity, která by vyvolávala bolest. Větší význam mohou mít receptory 5-HT2, jejichž aktivace u malých senzorických neuronů vede ke zvýšení vnitřního odporu a depolarizaci. Mechanizmy, které se v tomto procesu uplatňují, zřejmě zahrnují aktivaci druhých poslů.
3. Bradykinin představuje v psychofyziologických studiích nejvíce zkoumaný algogen, poněvadž je o něm známo, že se uvolňuje do extracelulárního prostoru při zánětlivých procesech. Vyvolává bolest, nebo ji potencuje, pokud je způsobena fyzikálními podněty. I když bradykinin je v popředí klinického zájmu, o biofyzikálních mechanizmech jeho působení je toho známo málo. Aplikace bradykininu vyvolává na některých neuronech GZKM dovnitř směřující proud, který mizí po jeho opakovaném podání. Byly získány důkazy o tom, že se na jeho vzniku podílí i některý ze systémů druhých poslů. Je možné, že bradykinin spouští kaskádu intracelulárních procesů prostřednictvím G-proteinů. Při testování této myšlenky bude zapotřebí užít elektrod, které umožňují perforaci plazmatické membrány tak, aby propouštěla pouze ionty, ale nedocházelo by k vyplavení makromolekulárních částic, např. enzymů z nitra buňky, jež jsou nezbytné k tomu, aby mohla proběhnout chemická reakce, na jejímž konci je změna aktivity iontových kanálů. Takovéto elektrody lze připravit tím způsobem, že se naplní roztokem nystatinu nebo amfotericinu B, který plazmatickou membránu perforuje otvory tak malými, že splňují tyto předpoklady.
4. Capsaicin je 8-methyl-N-vanilyl-6-nonamid, vyskytující se v červené paprice a jiných kořeních. Je znám pro své palčivé účinky. Jakmile se jej podařilo uměle syntetizovat, stal se předmětem intenzivního výzkumu ve vztahu k mechanizmům nocicepce. U mladých krys jeho dlouhodobá aplikace vede k degeneraci malých neuronů GZKM. U některých, převážně malých neuronů GZKM, vyvolává membránové proudy (obrázek), jež jsou neseny monovalentními kationty a iontovými kanály Ca2+, které vykazují vodivost kolem 40 pS (pikosiemens). Při opakovaném podání capsaicinu vykazují tyto membránové proudy velkou tachyfylaxi (postupné snižování odpovědi), jejíž mechanizmy nejsou dosud známy. Capsaicinové receptory existují u savců, ale ne u obojživelníků a ptáků. Capsaicin představuje cizorodou látku a pro jeho receptory dosud nebyl nalezen endogenní mediátor. 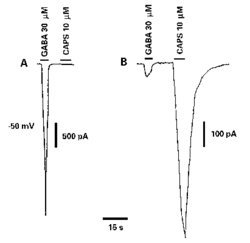
I když capsaicin nepochybně stimuluje nociceptory, toto zjištění nevylučuje možnost, že může působit i na jiné senzorické neurony, které slouží jiné modalitě čití, než je bolest. Tuto myšlenku podporuje zjištění, že se capsaicinové receptory vyskytují i u některých velkých neuronů, o nichž dosud nevíme, jakou hrají fyziologickou úlohu. Proto nemůže být citlivost na capsaicin považována za jednoznačný průkaz, že neuron izolovaný z GZKM skutečně představuje nociceptor.
5. Algogeny z jiných přírodních zdrojů, např. včelí a vosí jed, nejsou prozkoumány a představují objekt zájmu vyhledávacího výzkumu. V této souvislosti přitahují zájem i histamin, prostaglandin E a další látky.
Jiné chemické látky
6. ATP zřejmě představuje rychlý mediátor na celé řadě synapsí v CNS. Vyvolává dovnitř směřující membránové proudy asi u 40 % neuronů GZKM. Jejich výskyt dosud nebyl korelován s velikostí neuronů. Myšlenka, že by ATP mohla aktivovat nociceptory, je však lákavá, poněvadž lze předpokládat, že u poranění může docházet ke značnému uvolnění ATP z poškozených buněk. Dosud však chybějí psychofyziologické studie, které by oprávněnost této myšlenky podpořily, nebo ji vyvrátily. Klinická zkušenost, že injekční aplikace ATP není výrazně bolestivá, nasvědčuje však spíše tomu, že se receptory ATP podílejí na vzniku impulzní aktivity v jiném aferentním systému, než jsou nociceptory.7. Glutamát. Glutamátové receptory téměř všech typů byly imunocytochemicky prokázány u mnoha neuronů GZKM. Jejich funkční expresi se však podařilo prokázat pouze pro receptory kainatového typu. Kainatem vyvolané dovnitř směřující proudy jsou neseny monovalentními kationty, desenzitizují, a lze je zjistit asi u 65 % malých neuronů. Rovněž u této látky dosud nebyly studovány algogenní účinky na člověka. Dosavadní výsledky však opodstatňují další studium, poněvadž glutamát je, podobně jako ATP, obsažen ve velkých koncentracích uvnitř buňky, odkud může být při poranění uvolněn.
8. GABA (kyselina gama-aminomáselná) představuje klasický inhibiční mediátor, jehož receptory typu GABAA jsou in vivo přítomny na centrálních zakončeních primárních aferentních vláken v míše, kde hrají klíčovou úlohu v mechanizmech presynaptického útlumu. Na izolovaných neuronech GZKM žáby se vyskytují u všech neuronů. U neuronů GZKM potkana, v krátodobé kultuře, lze však GABAA - receptory konstantně zjistit pouze u velkých neuronů. U malých neuronů, které jsou citlivé na capsaicin, se nevyskytují buď vůbec, nebo jen v nepatrné hustotě (obrázek.). I když GABA nepředstavuje algogen, citlivost na ni je vhodným kritériem ke klasifikaci neuronů GZKM.
Fyzikální podněty
V psychofyziologických studiích představují tlak a teplo nejčastěji užívané experimentální podněty pro vyvolání bolesti. Zdá se, že tlak nad jistou hodnotu vyvolá aktivaci iontových kanálů, které jsou citlivé na natažení plazmatické membrány (stretch induced ionic channels). Dosud zjištěné vlastnosti a výskyt těchto iontových kanálů jsou však značně rozporné. Příčinou rozpornosti jsou především potíže metodického charakteru. Vypracování spolehlivé kvantitativní techniky mechanického dráždění neuronů v tkáňové kultuře bude mít nepochybně velký význam i pro studium biofyzikálních vlastností nociceptorů.Tepelné podněty nad 43 oC vyvolávají bolest u člověka a nocicepční reakci u experimentálních zvířat. Dosavadní metodické nedostatky však brání tomu, aby bylo možné studovat biofyzikální podstatu tepelného dráždění přímo na buněčné úrovni, tj. na neuronech v kultuře. Proto bude zapotřebí vyvinout miniaturní zdroj tepla, který by umožnil teplo lokálně uvolňovat v těsné blízkosti neuronů GZKM při jejich vyšetřování v roztoku.
Závěr
Nové experimentální přístupy, v nichž jsou využívány senzorické neurony v krátkodobé kultuře, mohou přinést nový model in vitro ke studiu periferních mechanizmů bolesti. Nepochybně to budou malé a středně velké neurony. Současný výzkum musí však definovat kritéria, která by v kultuře umožnila nociceptory spolehlivě odlišit od senzorických neuronů sloužícich jiným modalitám čití.Bylo by však nesprávné domnívat se, že model nocicepce in vitro umožní vyřešit všechny problémy, které představuje chronická bolest. Bolest jako taková zůstane subjektivním zážitkem, o němž může podat zprávu pouze člověk, a proto pouze on bude konečným hodnotilem léčených výsledků. Důležitým mezičlánkem v procesu poznávání mechanizmů bolesti i nadále budou pokusná zvířata, u nichž lze na bolest usuzovat podle nocicepční reakce. V celém organizmu nelze též předpokládat, že nociceptory hrají úlohu pouze při podráždění, po němž vzniká bolest. Klinické zkušenosti a nedávné experimentální studie dokazují, že i spící nociceptory uvolňují neurotrofické látky, které hrají důležitou úlohu ve vývoji a udržování homeostatických pochodů v orgánech, jež inervují. Kultivované nociceptory budou tak představovat vhodný model pro studium molekulárních mechanizmů, které se uplatňují při jejich podráždění, tedy iniciaci procesů, jež vedou k bolesti. Lze předvídat, že nejde o jediný mechanizmus, nýbrž že existuje více mechanizmů, které jsou alespoň zčásti specifické pro různé typy nociceptorů, jejichž aktivita podmiňuje vznik bolestí různého charakteru.
Nový model pro studium nocicepce in vitro umožní též analýzu molekulárního působení periferních analgetik a testování nových farmak s potenciálně analgetickými účinky.















