Když selhává příroda
„Omne vivum ex ovo – vše živé pochází z vejce,“ konstatoval už před pěti sty lety anglický lékař William Harvey (1578–1657). Co ale dělat, když je samičích zárodečných buněk proklatě málo a přirozené cesty početí selhávají? A co všechno se musí stát, aby bylo vejce schopné přeměny v embryo? Na tyto otázky se snažíme v našem oddělení odpovědět.
Samice savců se rodí s definovaným počtem oocytů. Během života už další nevznikají, a jejich počet tak s postupem času klesá. Stále častěji čelíme tomu, že oocyty nejsou v dobré kondici nebo jich není dostatek, takže nelze spoléhat na přirozenou reprodukci. Týká se to nejenom lidské populace, v níž pozorujeme snižování plodnosti u žen i mužů, ale také populací kriticky ohrožených zvířat, u nichž klesl počet jedinců natolik, že přirozené množení už není možné.
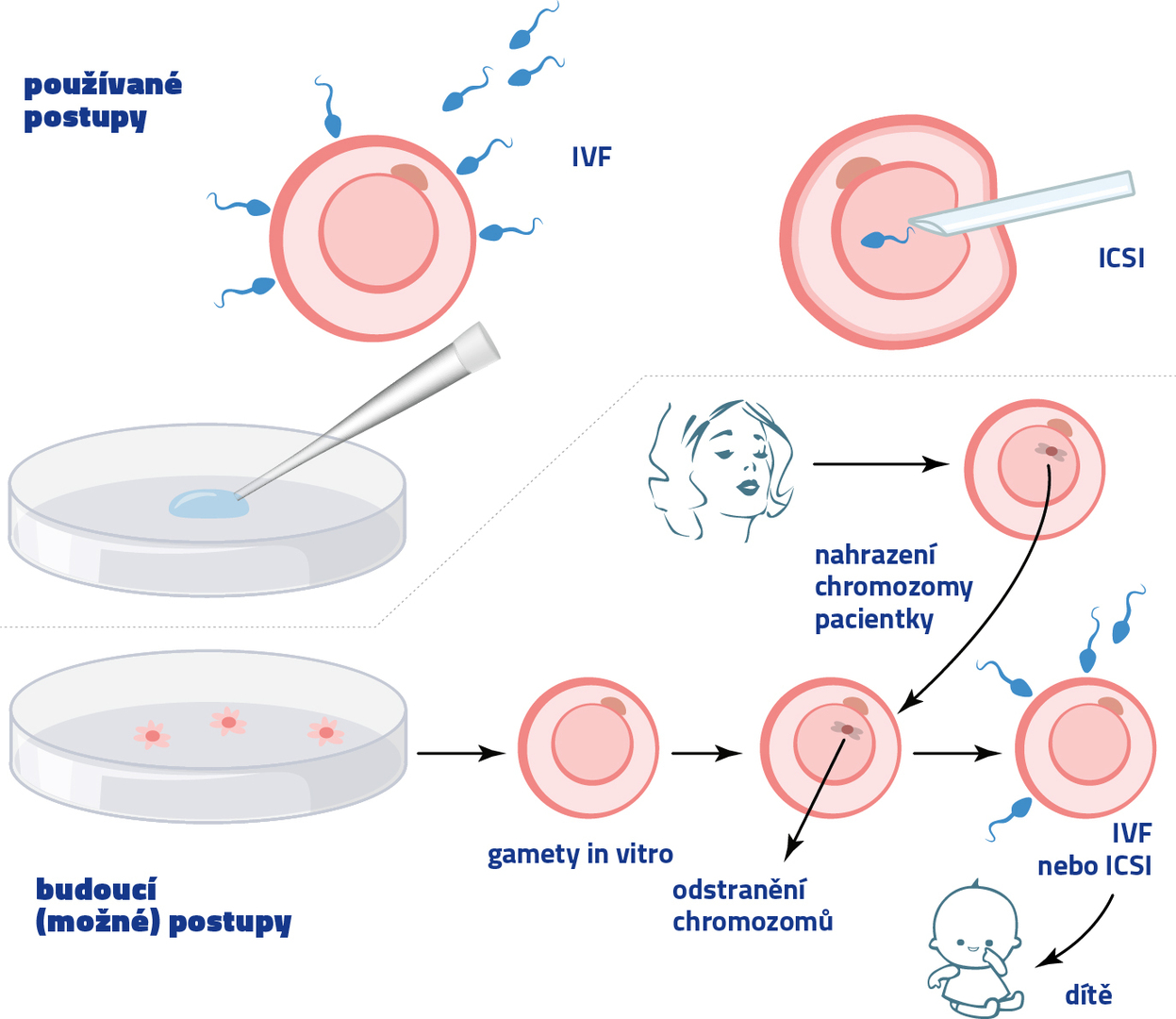
Někdy pomůže „obyčejné“ oplození in vitro (IVF, in vitro fertilization), tedy pouhé smíchání samičích a samčích pohlavních buněk v laboratorních podmínkách. Vzniklá embrya se následně vpraví do dělohy ženy či samice daného druhu. V případě kriticky ohrožených zvířat je možné jako náhradní matku použít i samici příbuzného druhu. První savec (králík) se pomocí IVF narodil již v roce 1959, prvním takto počatým dítětem byla Louise Brownová o devatenáct let později (1978).
Někdy však ani tato cesta nepomáhá a je nutné použít sofistikovanější postupy. V případě omezeného počtu samičích pohlavních buněk či nepohyblivosti spermií můžeme použít i přímou injekci spermie do vejce a doufat, že další vývoj bude probíhat bez komplikací. Tato technika se hojně využívá v lidské asistované reprodukci pod zkratkou ICSI (z angl. intracytoplasmic sperm injection). První použití ICSI je datováno již do r. 1976, kdy Ryuzo Yanagimachi injikoval spermie do křeččích vajec. První dítě se po úspěšné ICSI narodilo v r. 1992.
Jak je u obou metod vidět, je zapotřebí zhruba dvacet let pro testování efektivity a bezpečnosti na zvířecích modelech, než je daný postup aplikován v lidské medicíně.
V některých případech však ani IVF, ani ICSI nepomohou. Pro ženy tak zbývá jediná možnost: využití oocytů dárkyně. Narozené dítě však nebude s matkou geneticky příbuzné, což není pro spoustu žen přijatelné. U ohrožených druhů je situace ještě komplikovanější, protože vejce prostě nejsou k dispozici. V roce 2012 se však začalo blýskat na lepší časy. Japonským vědcům se u myší podařilo derivovat umělé oocyty zcela in vitro. Od té doby se sice objevila různá vylepšení, avšak efektivita celého procesu je zatím žalostně nízká. A o bezpečnosti gamet derivovaných in vitro zatím nemůže být ani řeč.
Lze očekávat, že v případě umělých gamet bude prvním krokem kombinace cytoplastů, tj. vajec s odstraněnou genetickou informací, s DNA z oocytu dárkyně. Toho lze docílit jejím přenosem a injekcí do cytoplastu podobným postupem jako při ICSI. Právě na tyto techniky se specializujeme v našem oddělení. V případě, že od prvního úspěšného použití u zvířat k jeho aplikaci v lidské medicíně uplyne stejná doba jako u předchozích metod, mohli bychom se umělých gamet u lidí dočkat za dalších deset let. Do té doby se budeme držet konvenčnějších přístupů, na umělé gamety však budeme připraveni.
Oddělení plasticity buněčného jádra se zabývá výzkumem časné embryogeneze savců a změnou plasticity buněčného jádra, která provází proces diferenciace a dediferenciace. Tyto procesy jsou doprovázeny výraznou změnou morfologie jader i epigenetickou remodelací chromatinu. Cílem oddělení je charakterizovat vliv jednotlivých jaderných komponent a definovat roli subjaderných organel v tomto procesu.
Vedoucí oddělení: Mgr. Helena Fulková, Ph.D.
Ke stažení
 článek ve formátu pdf [467,99 kB]
článek ve formátu pdf [467,99 kB]