Vedlejší účinky a vývoj moderních léčiv
| 7. 3. 2013Myšlenku napsat tento text vznikla při čtení lednového čísla Vesmíru, kde se prof. Anděl v úvodníku „Nové použití pro staré léky“ zamýšlel nad touto problematikou a ilustroval ji mimo jiné i známým případem thalidomidu (Contergan).
Na s. 43 téhož čísla je pak diskutována snaha zavést disulfiram (Antabus), tedy látku v současnosti používanou k léčbě závislosti na alkoholu, do terapie nádorových onemocnění. V úvodníku pak byl popsán trend anglicky označovaný jako Drug Repurposing nebo Drug Repositioning, česky snad nalezení nové role pro léčiva.1) Po přečtení mne napadlo, že by nebylo na škodu dát tyto snahy o využití vedlejších účinků při vývoji nových léčiv do celkového kontextu.
 Je známo, že u mnoha léčiv jsou popsány kromě hlavního léčebného účinku také potenciálně použitelné vedlejší účinky, které jsou často objeveny až po zavedení léku do praxe systémem farmakovigilance.2) V některých případech jsou pak taková léčiva používána i k léčbě onemocnění, pro které nebyla příslušnou regulační autoritou schválena. Pak hovoříme o takzvaném „off label“ použití.3) Velmi rozšířené je například předepisování H1 antihistaminik pro léčbu nespavosti. U nás jde hlavně o originální československé antihistaminikum bisulepin (Dithiaden). V některých případech bylo „off label“ použití posléze legalizováno a některá léčiva tohoto typu byla již jako hypnotika cíleně vyvinuta. Příkladem legalizace „off label“ léčiva je použití klasického H1 antihistaminika promethazinu (např. Prothazine) k léčbě nespavosti. Z modernějších léčiv je to doxepin, který se používá topicky proti alergiím pod názvem Zonolon a jako hypnotikum pod názvem Silenor.
Je známo, že u mnoha léčiv jsou popsány kromě hlavního léčebného účinku také potenciálně použitelné vedlejší účinky, které jsou často objeveny až po zavedení léku do praxe systémem farmakovigilance.2) V některých případech jsou pak taková léčiva používána i k léčbě onemocnění, pro které nebyla příslušnou regulační autoritou schválena. Pak hovoříme o takzvaném „off label“ použití.3) Velmi rozšířené je například předepisování H1 antihistaminik pro léčbu nespavosti. U nás jde hlavně o originální československé antihistaminikum bisulepin (Dithiaden). V některých případech bylo „off label“ použití posléze legalizováno a některá léčiva tohoto typu byla již jako hypnotika cíleně vyvinuta. Příkladem legalizace „off label“ léčiva je použití klasického H1 antihistaminika promethazinu (např. Prothazine) k léčbě nespavosti. Z modernějších léčiv je to doxepin, který se používá topicky proti alergiím pod názvem Zonolon a jako hypnotikum pod názvem Silenor.
 Jedinou možností legalizace takového použití je rozšíření registrace založené na příslušných klinických důkazech, pokud firmy vyhodnotí registraci jako ekonomicky výhodnou. Jindy firmy dospějí k závěru, že je pro ně ekonomicky výhodnější spolehnout se na to, že se „off label“ použití rozšíří pomocí vědeckých publikací. Z tohoto pohledu je zajímavým případem inhibitor zpětného vychytávání dopaminu a noradrenalinu (DNRI) bupropion. Tato látka byla zavedena pod názvem Wellbutrin firmou GlaxoWellcome (nyní GlaxoSmithKline, GSK) jako antidepresivum a později pod názvem Zyban k odvykání kouření. Za „off label“ použití se pokládá i použití Wellbutrinu při odvykání kouření, i když obě tablety jsou v podstatě totožné a mají stejný obsah účinné látky. V některých zemích (obvykle se zmiňuje Kanada) je takovéto použití celkem běžné, protože Wellbutrin je jako antidepresivum na rozdíl od Zybanu hrazen ze zdravotního pojištění. Dalším možným atraktivním užitím bupropionu je léčba obezity, kde je zkoumán jak samotný, tak v různých kombinacích, a jako „off label“ léčivo je zřejmě poměrně široce využíván. V některých takových případech firmy neodolají pokušení a toto používání v zájmu zvýšení prodejů aktivně podporují. Nejnověji se k takovému neetickému chování přiznala firma GSK při použití Wellbutrinu (a dalších dvou léčiv) a v roce 2012 zaplatila pokutu ve výši 3 miliard USD.
Jedinou možností legalizace takového použití je rozšíření registrace založené na příslušných klinických důkazech, pokud firmy vyhodnotí registraci jako ekonomicky výhodnou. Jindy firmy dospějí k závěru, že je pro ně ekonomicky výhodnější spolehnout se na to, že se „off label“ použití rozšíří pomocí vědeckých publikací. Z tohoto pohledu je zajímavým případem inhibitor zpětného vychytávání dopaminu a noradrenalinu (DNRI) bupropion. Tato látka byla zavedena pod názvem Wellbutrin firmou GlaxoWellcome (nyní GlaxoSmithKline, GSK) jako antidepresivum a později pod názvem Zyban k odvykání kouření. Za „off label“ použití se pokládá i použití Wellbutrinu při odvykání kouření, i když obě tablety jsou v podstatě totožné a mají stejný obsah účinné látky. V některých zemích (obvykle se zmiňuje Kanada) je takovéto použití celkem běžné, protože Wellbutrin je jako antidepresivum na rozdíl od Zybanu hrazen ze zdravotního pojištění. Dalším možným atraktivním užitím bupropionu je léčba obezity, kde je zkoumán jak samotný, tak v různých kombinacích, a jako „off label“ léčivo je zřejmě poměrně široce využíván. V některých takových případech firmy neodolají pokušení a toto používání v zájmu zvýšení prodejů aktivně podporují. Nejnověji se k takovému neetickému chování přiznala firma GSK při použití Wellbutrinu (a dalších dvou léčiv) a v roce 2012 zaplatila pokutu ve výši 3 miliard USD.
 Další oblastí, zmíněnou již v předchozím odstavci, je oblast Drug Repurposing/Repositioning (DR). Ta se týká zavádění již známých nebo vyvíjených léčiv v jiné terapeutické oblasti, než byla původně schválena nebo testována. Tato léčiva musí ovšem projít klinickým hodnocením a musí být pro nové použití řádně schválena. Výhodou tohoto přístupu je fakt, že dodatečný vývoj je mnohem levnější, protože již jsou známa toxikologická a farmakokinetická data, je vyvinuta syntéza, formulace a další aspekty, které by u nové molekuly vyžadovaly nákladný a časově náročný vývoj.
Další oblastí, zmíněnou již v předchozím odstavci, je oblast Drug Repurposing/Repositioning (DR). Ta se týká zavádění již známých nebo vyvíjených léčiv v jiné terapeutické oblasti, než byla původně schválena nebo testována. Tato léčiva musí ovšem projít klinickým hodnocením a musí být pro nové použití řádně schválena. Výhodou tohoto přístupu je fakt, že dodatečný vývoj je mnohem levnější, protože již jsou známa toxikologická a farmakokinetická data, je vyvinuta syntéza, formulace a další aspekty, které by u nové molekuly vyžadovaly nákladný a časově náročný vývoj.
Asi nejznámějším příkladem DR je selektivní inhibitor fosfodiesterasy typu 5 (PDE5) sildenafil, u kterého vlastně došlo k takovému DR dvakrát. Tato látka byla pod označením UK 92 480 původně vyvíjena pro léčbu anginy pectoris. Klinické hodnocení bylo nakonec zastaveno, protože nebylo dosaženo očekávaných výsledků. Po analýze vedlejších účinků léku a po pohovorech s pacienty, kteří jej nevrátili, bylo zjištěno, že měl „výrazný pozitivní účinek na sexuální život mužských pacientů“. Nu a výsledkem bylo zavedení sildenafilu pro léčbu erektilní dysfunkce pod názvem Viagra (Pfizer; 25, 50, 100 mg). Dalším studiem bylo zjištěno, že sildenafil má pozitivní vliv i při léčbě plicní arteriální hypertense (PAH), a tak bylo pro tuto indikaci léčivo zavedeno pod názvem Revatio (Pfizer; 20 mg). I když je z identické lékové formy a z dávky 20 mg zřejmé, že Revatio by bylo možné použít i v případě erektilní dysfunkce, chce výrobce jasným rozlišením tvaru a barvy odradit od „off label“ používání.
 Dosud jsme v rámci části věnované oblasti Drug Repurposing/Repositioning diskutovali hlavně situaci, kdy firma vyvinula nové léčivo a během jeho vývoje nebo po jeho zavedení rozšířila jeho terapeutické použití. Nebyla tedy limitována patentovým ani jiným omezením, naopak si mohla toto nové použití patentově chránit. Nutno podotknout, že tuto činnost v současné době velice intenzivně provádějí všechny významné inovativní farmaceutické společnosti. Další možností je vývoj dlouho známé účinné látky, která je již patentově volná, pro nové použití. To je příklad zmíněného disulfiramu. V případech léčiv, na něž se vztahuje patentová ochrana, jde však o složitý problém, který je třeba řešit oboustrannou dohodou. Proto ve snaze o využití terapeutického potenciálu experimentálních léčiv, jejichž vývoj byl zastaven v pokročilé fázi klinického hodnocení, inicioval americký NIH program zaměřený tímto směrem.4) Taková léčiva jsou poskytnuta akademické sféře k hlubšímu studiu s cílem oživit je v jiné indikaci („drug rescue“). K třem firmám (Pfizer, AstraZeneca, Eli Lilly), které stály na začátku programu, se přidali další významní originální výrobci (Abbott, Bristol-Myers Squibb, GSK, Janssen, Sanofi), kteří v současné době nabízejí do tohoto pilotního programu 58 sloučenin, jež úspěšně prošly preklinickým testováním a ranými fázemi klinických studií. Zároveň NIH podpoří tuto činnost granty pro akademické instituce. Hlavním argumentem zastánců tohoto přístupu je možnost urychlit a zlevnit zavádění nových léčiv. Přehlížet však nelze ani kritické hlasy tvrdící například, že firma si u poskytnuté sloučeniny již neúspěšně otestovala její aktivitu na signifikantní známé cílové struktury (enzymy, receptory), i to, že dané experimentální léčivo bylo optimalizováno na jiné použití a není příliš pravděpodobné, že by tato sloučenina byla optimální i pro použití nové. A v případě, že by daná sloučenina byla sice funkční i ve zcela jiné oblasti, ale dostatečně aktivní nebo selektivní by byl až nějaký derivát této původně testované látky, bylo by nutné provádět řadu preklinických testů i klinické hodnocení znovu. A to se již dostáváme k další oblasti využití výsledků studií vedlejších účinků ve vývoji nových léčiv, kterým je takzvaný přístup SOSA (Selective Optimization of Side Activities).5)
Dosud jsme v rámci části věnované oblasti Drug Repurposing/Repositioning diskutovali hlavně situaci, kdy firma vyvinula nové léčivo a během jeho vývoje nebo po jeho zavedení rozšířila jeho terapeutické použití. Nebyla tedy limitována patentovým ani jiným omezením, naopak si mohla toto nové použití patentově chránit. Nutno podotknout, že tuto činnost v současné době velice intenzivně provádějí všechny významné inovativní farmaceutické společnosti. Další možností je vývoj dlouho známé účinné látky, která je již patentově volná, pro nové použití. To je příklad zmíněného disulfiramu. V případech léčiv, na něž se vztahuje patentová ochrana, jde však o složitý problém, který je třeba řešit oboustrannou dohodou. Proto ve snaze o využití terapeutického potenciálu experimentálních léčiv, jejichž vývoj byl zastaven v pokročilé fázi klinického hodnocení, inicioval americký NIH program zaměřený tímto směrem.4) Taková léčiva jsou poskytnuta akademické sféře k hlubšímu studiu s cílem oživit je v jiné indikaci („drug rescue“). K třem firmám (Pfizer, AstraZeneca, Eli Lilly), které stály na začátku programu, se přidali další významní originální výrobci (Abbott, Bristol-Myers Squibb, GSK, Janssen, Sanofi), kteří v současné době nabízejí do tohoto pilotního programu 58 sloučenin, jež úspěšně prošly preklinickým testováním a ranými fázemi klinických studií. Zároveň NIH podpoří tuto činnost granty pro akademické instituce. Hlavním argumentem zastánců tohoto přístupu je možnost urychlit a zlevnit zavádění nových léčiv. Přehlížet však nelze ani kritické hlasy tvrdící například, že firma si u poskytnuté sloučeniny již neúspěšně otestovala její aktivitu na signifikantní známé cílové struktury (enzymy, receptory), i to, že dané experimentální léčivo bylo optimalizováno na jiné použití a není příliš pravděpodobné, že by tato sloučenina byla optimální i pro použití nové. A v případě, že by daná sloučenina byla sice funkční i ve zcela jiné oblasti, ale dostatečně aktivní nebo selektivní by byl až nějaký derivát této původně testované látky, bylo by nutné provádět řadu preklinických testů i klinické hodnocení znovu. A to se již dostáváme k další oblasti využití výsledků studií vedlejších účinků ve vývoji nových léčiv, kterým je takzvaný přístup SOSA (Selective Optimization of Side Activities).5)
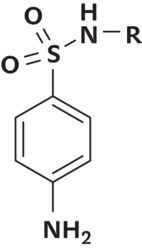 Jak již bylo řečeno, v průběhu vývoje a hlavně užívání každého léčiva se objevují vedlejší účinky, které jsou většinou nežádoucí, a u dalších generací léčiv existuje snaha je omezit. Z historie je ale známa řada příkladů, kdy se naopak podařilo tyto původně nežádoucí účinky využít terapeuticky v jiné oblasti. Zmíněny byly případy, kdy lze využít k léčbě v další indikaci léčivo jako takové. Někdy se však podařilo modifikací struktury dosáhnout toho, že původní hlavní účinek byl zcela potlačen a vedlejší účinek podstatně zvýšen. Patrně nejznámějším příkladem jsou léčiva odvozená od antibakteriálních sulfonamidů. Účinek sulfonamidů spočívá v jejich strukturní podobnosti s p-aminobenzoovou kyselinou (PABA), kterou mikroorganismy využívají k tvorbě listové kyseliny potřebné pro syntézu DNA. Příslušný sulfonamid pak soutěží s PABA o enzym dihydropteroátsynthetasu a vytváří nefunkční analoga listové kyseliny. Důsledkem je bakteriostatický účinek sulfonamidů. Ze studia SAR bylo zjištěno, že pro zachování antibakteriální aktivity musí být zachována struktura 4-aminobenzensulfonylaminová a jedinou přijatelnou je substituce na sulfonamidovém atomu N1 sulfanilamidu.
Jak již bylo řečeno, v průběhu vývoje a hlavně užívání každého léčiva se objevují vedlejší účinky, které jsou většinou nežádoucí, a u dalších generací léčiv existuje snaha je omezit. Z historie je ale známa řada příkladů, kdy se naopak podařilo tyto původně nežádoucí účinky využít terapeuticky v jiné oblasti. Zmíněny byly případy, kdy lze využít k léčbě v další indikaci léčivo jako takové. Někdy se však podařilo modifikací struktury dosáhnout toho, že původní hlavní účinek byl zcela potlačen a vedlejší účinek podstatně zvýšen. Patrně nejznámějším příkladem jsou léčiva odvozená od antibakteriálních sulfonamidů. Účinek sulfonamidů spočívá v jejich strukturní podobnosti s p-aminobenzoovou kyselinou (PABA), kterou mikroorganismy využívají k tvorbě listové kyseliny potřebné pro syntézu DNA. Příslušný sulfonamid pak soutěží s PABA o enzym dihydropteroátsynthetasu a vytváří nefunkční analoga listové kyseliny. Důsledkem je bakteriostatický účinek sulfonamidů. Ze studia SAR bylo zjištěno, že pro zachování antibakteriální aktivity musí být zachována struktura 4-aminobenzensulfonylaminová a jedinou přijatelnou je substituce na sulfonamidovém atomu N1 sulfanilamidu.
 Již ve čtyřicátých letech 20. století docházelo u některých pacientů nemocných tyfem a léčených sulfonamidem označovaným jako VK 57 nebo IPTD (zkratka odvozená od přítomného heterocyklu isopropylthiadiazolu) k náhlému zhoršení zdravotního stavu vedoucímu někdy i k úmrtí. Bližším zkoumáním bylo zjištěno, že příčinou byla náhlá hypoglykemie.6) Přesto trvalo celé další desetiletí, než byl tento poznatek využit v terapii diabetu a do klinické praxe byla zavedena první perorální antidiabetika na bázi sulfonylmočoviny. První z nich, např. karbutamid, ještě obsahovaly v p-poloze aminoskupinu a byly i antibakteriálně aktivní. Jednoduchou záměnou za jiný substituent např. methylskkupinu již nebyly získané látky, např. tolbutamid, antibakteriálně účinné. Moderní sulfonylmočovinová antidiabetika, např. glimepirid, už mají v této poloze poměrně složité substituenty.
Již ve čtyřicátých letech 20. století docházelo u některých pacientů nemocných tyfem a léčených sulfonamidem označovaným jako VK 57 nebo IPTD (zkratka odvozená od přítomného heterocyklu isopropylthiadiazolu) k náhlému zhoršení zdravotního stavu vedoucímu někdy i k úmrtí. Bližším zkoumáním bylo zjištěno, že příčinou byla náhlá hypoglykemie.6) Přesto trvalo celé další desetiletí, než byl tento poznatek využit v terapii diabetu a do klinické praxe byla zavedena první perorální antidiabetika na bázi sulfonylmočoviny. První z nich, např. karbutamid, ještě obsahovaly v p-poloze aminoskupinu a byly i antibakteriálně aktivní. Jednoduchou záměnou za jiný substituent např. methylskkupinu již nebyly získané látky, např. tolbutamid, antibakteriálně účinné. Moderní sulfonylmočovinová antidiabetika, např. glimepirid, už mají v této poloze poměrně složité substituenty.
Dalším zajímavým příkladem je zavedení obstipacií fungujících přes opiátové receptory. Známým vedlejším účinkem opiátů je zácpa a zadržování moče způsobené interakcí opiátů s opioidními receptory µ v GIT. V lidovém léčitelství se této vlastnosti využívalo k zastavení úporných průjmů pomocí vývarů z makovic. Ve snaze vyvinout účinná obstipancia byla modifikována struktura jednodušších syntetických opiátů, například pethidinu, s cílem vyvinout léčiva, která by způsobovala obstipaci a nepronikala přes hematoencefalickou bariéru. To vedlo k syntéze silně lipofilních analog, která by tuto bariéru nepřekračovala. Tak byl vyvinut difenoxylat a loperamid, které jsou široce používány při mírnění průjmů. Ve skutečnosti se ukázalo, že jak difenoxylat, tak loperamid procházejí částečně do CNS. Loperamid je ale okamžitě transportován zpět mimo CNS účinkem P-glykoproteinu.
Uvedené případy ukazují, že dosti často se podařilo obměnou struktury nějakého léčiva získat látku použitelnou ve zcela jiné indikaci. V současné době se tento SOSA přístup považuje za důležitou metodu vývoje léčiv a v literatuře je dokumentována řada úspěšných případů aplikace tohoto principu.7) Postupuje se tak, že pro vybraný cíl je testována knihovna strukturně nepodobných léčiv. Protože se jedná o používaná léčiva, případný „hit“ má vlastnosti léčiva (je tzv. „druglike“). Vybrané „hity“ jsou následně běžnými metodami medicinální chemie optimalizovány tak, aby byla zvýšena afinita k vybranému receptoru nebo enzymu a zároveň aby se potlačila původní farmakologická aktivita. Známým příkladem úspěšné aplikace SOSA přístupu je objevení selektivních antagonistů endothelinových ETA receptorů u firmy Bristol-Myers Squibb.
V současné době jsou komerčně dostupné rozsáhlé knihovny léčiv pro SOSA, zahrnující hlavní strukturní rysy používaných léčiv. Například kolekce firmy Prestwick Chemical obsahuje 1200 FDA schválených léčiv.8) Další knihovny schválených léčiv jsou dostupné např. od firmy SelleckBio9) nebo Sigma.10)
Na závěr tedy nezbývá než vyjádřit přesvědčení, že tento článek splnil svůj účel a osvětlil pojmy „off label“ použití, Drug Repurposing/ Repositioning i SOSA přístup, se kterými se můžeme setkat i v ne zcela specializovaných textech.
Vzhledem k zaměření časopisu nejsou uvedeny strukturní vzorce řady v textu zmíněných léčiv. Ty lze nalézt s dalšími podrobnostmi například v knize Farmakochemie.11)
Poznámky
1) Detaily této problematiky lze nalézt např. v knize M. J. Barratta a D. E. Fraila: Drug Repositioning – Bringing New Life to Shelved Assets and Existing Drugs, John Wiley & Sons 2012.
2) Systémem farmakovigilance se rozumí systém pro sledování bezpečnosti léčivých přípravků při běžném používání, který se zaměřuje na sběr, monitorování a vyhodnocování relevantních informací, především nežádoucích účinků, a na prosazení přiměřených zásahů.
3) Za „off label“ použití se obecně považuje každé použití léčiva, které není schválené příslušnou regulační autoritou. Týká se to tedy i hojně diskutované léčby onkologicky nemocných dětí léčivy schválenými pouze pro dospělé a také použití léčiva schváleného pro humánní použití ve veterinární praxi.
4) www.ncats.nih.gov/research/reengineering/rescuerepurpose/therapeutic-uses/therapeutic-uses.html.
5) K. H. Bleicher, H.-J. Böhm, K. Müller, A. I. Alanine, Nat. Rev. Drug Discov. 2, 369–378, 2003.
6) A. Loubatières, Ann, New York Acad. Sci. 67, 187–206, 1956.
7) C. G. Wermuth, Drug Discov. Today 11, 160–164, 2006.
10) www.sigmaaldrich.com (Lopac Library of pharmacologically active compounds).
11) F. Hampl, S. Rádl, J. Paleček: Farmakochemie, nakladatelství VŠCHT v Praze, 2007.
Ke stažení
 článek ve formátu pdf [505,48 kB]
článek ve formátu pdf [505,48 kB]
O autorovi
Stanislav Rádl


























