Membránové transportéry, buněčné brány
| 6. 9. 2012Chceme-li pochopit chování celé buňky, je nezbytné porozumět transportním procesům v membránách buněk a jejich souvislostem s membránovým potenciálem. Kvasinky představují vhodný modelový systém, protože na nich lze studovat obecné vlastnosti všech eukaryotních buněk. Využíváme k tomu fluorescenčních sond – fluorescenčních barviv, která na změny v jejich okolním prostředí reagují např. posunem vlnové délky emitovaného světla nebo změnou intenzity záření.
Když nám před více než dvaceti lety profesor Antonio Peña z National Autonomous University of Mexico, jenž se také zabývá studiem membránových transportních procesů v kvasinkách, věnoval fluorescenční sondu diS-C3(3), která, řečeno jeho vlastními slovy, „se moc nepovedla“, netušili jsme, jak výrazně tato „nepovedená“ látka pomůže rozšířit znalosti o činnosti membránových transportérů kvasinek.
Modelová kvasinka
Kvasinka Saccharomyces cerevisiae se řadí mezi sedm nejdůležitějších modelových organismů, které jsou snadno dostupné, rychle se rozmnožují a umožňují kvalitní kultivaci v laboratorních podmínkách. Oblibě se těší mimo jiné díky tomu, že je známa celá sekvence nukleotidů v její DNA a lze snadno připravovat mutantní kmeny. Mimořádně důležité je také to, že přes značné morfologické rozdíly je řada životních pochodů probíhajících v této malé buňce podobná tomu, co se odehrává v buňkách savčích, resp. lidských.
V plazmatické membráně kvasinek, představující bariéru mezi vnitřkem buňky a jejím vnějším prostředím, existuje řada transportních proteinů, které plní rozličné funkce, jako je transport živin do buňky a toxických odpadních látek ven nebo transport malých anorganických iontů udržující konstantní iontové složení uvnitř buněk (tzv. homeostazi).
Membránový potenciál
 Membránové proteiny, které dokážou přenášet přes plazmatickou membránu malé anorganické ionty, vytvářejí transmembránové gradienty koncentrací těchto iontů. A protože ionty nesou náboj, vzniká tak zároveň mezi vnitřní a vnější stranou membrány elektrické napětí, tzv. membránový potenciál. U rostlinných buněk, bakterií a hub (mezi něž patří i kvasinky) je membránový potenciál spojen zejména s činností plazmatické H+-ATPázy. Jedná se o protein, který transportuje protony z buněk na úkor chemické energie uložené v ATP, což je nízkomolekulární látka sloužící v buňkách jako zdroj rychle dostupné energie.
Membránové proteiny, které dokážou přenášet přes plazmatickou membránu malé anorganické ionty, vytvářejí transmembránové gradienty koncentrací těchto iontů. A protože ionty nesou náboj, vzniká tak zároveň mezi vnitřní a vnější stranou membrány elektrické napětí, tzv. membránový potenciál. U rostlinných buněk, bakterií a hub (mezi něž patří i kvasinky) je membránový potenciál spojen zejména s činností plazmatické H+-ATPázy. Jedná se o protein, který transportuje protony z buněk na úkor chemické energie uložené v ATP, což je nízkomolekulární látka sloužící v buňkách jako zdroj rychle dostupné energie.
Membránový potenciál je pro život buňky nezbytný. Možnost měřit jeho hodnotu nebo alespoň velikost jeho změn je velmi důležitá, neboť řada procesů probíhajících na buněčné membráně je jím v různé míře ovlivněna (transport živin do buněk) nebo dokonce přímo řízena (otevírání nebo zavírání iontových kanálů). Monitorování změn membránového potenciálu při interakci buněk s látkami přítomnými ve vnějším prostředí nebo při vystavení buněk stresovým podmínkám, jako jsou například hladovění, vysoká nebo nízká teplota, pH nebo přítomnost elektrických polí, nám umožňuje zprostředkovaně sledovat jak míru ovlivnění buněk těmito stresovými faktory (stresory), tak vliv jiných látek a faktorů, které mohou škodlivé účinky stresorů eliminovat (například antioxidanty). Působení stresorů poškozujících buňku na úrovni plazmatické membrány má často za následek snížení velikosti membránového potenciálu, tzv. depolarizaci, případně až následnou permeabilizaci (zvýšení propustnosti) membrány vedoucí ke smrti buňky.
Mnohočetná léková rezistence
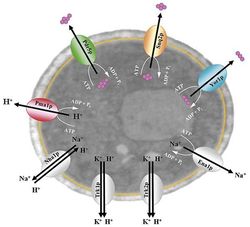 Další velmi důležitou roli hrají v buněčných membránách kvasinek i živočišných buněk membránové transportéry zodpovědné za fenomén mnohočetné lékové rezistence (neboli MDR pumpy). Tyto transportéry aktivně odstraňují z buněk cizorodé látky, k čemuž využívají energii uloženou v ATP nebo v transmembránovém elektrochemickém gradientu protonů, popř. sodných iontů. Brání tak tomu, aby vnitrobuněčná koncentrace cizorodých látek přesáhla toxickou úroveň.
Další velmi důležitou roli hrají v buněčných membránách kvasinek i živočišných buněk membránové transportéry zodpovědné za fenomén mnohočetné lékové rezistence (neboli MDR pumpy). Tyto transportéry aktivně odstraňují z buněk cizorodé látky, k čemuž využívají energii uloženou v ATP nebo v transmembránovém elektrochemickém gradientu protonů, popř. sodných iontů. Brání tak tomu, aby vnitrobuněčná koncentrace cizorodých látek přesáhla toxickou úroveň.
Ale co je dobré pro kvasinku, nemusí být dobré pro lidský organismus, který se s ní potká. MDR pumpy mohou například komplikovat boj s kvasinkovými kontaminacemi nebo léčení infekcí. Jsou také zodpovědné za rezistenci patogenních mikroorganismů vůči antibiotikům, za rezistenci prvoků či parazitů vůči dezinfekčním činidlům a herbicidům nebo i za rezistenci rakovinných buněk vůči cytostatikům.
Metoda barvicích křivek
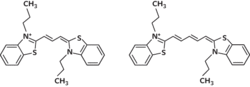
 Malá kladně nabitá molekula diS-C3(3) snadno proniká do buněk, kam proudí tak dlouho, dokud nedojde k vyrovnání elektrochemických potenciálů této fluorescenční sondy vně a uvnitř buněk. Jelikož membránový potenciál je uvnitř buněk záporný, vede ustavení elektrochemické rovnováhy k intracelulární akumulaci diS-C3(3). Uvnitř buněk pak dochází k vazbě určitého množství sondy na makromolekuly cytosolu (koloidního roztoku představujícího tekutý obsah buněk), což vede k výše zmíněnému posuvu emisního maxima k větším vlnovým délkám, doprovázenému navíc zvýšením kvantového výtěžku fluorescence a tím i její intenzity.
Malá kladně nabitá molekula diS-C3(3) snadno proniká do buněk, kam proudí tak dlouho, dokud nedojde k vyrovnání elektrochemických potenciálů této fluorescenční sondy vně a uvnitř buněk. Jelikož membránový potenciál je uvnitř buněk záporný, vede ustavení elektrochemické rovnováhy k intracelulární akumulaci diS-C3(3). Uvnitř buněk pak dochází k vazbě určitého množství sondy na makromolekuly cytosolu (koloidního roztoku představujícího tekutý obsah buněk), což vede k výše zmíněnému posuvu emisního maxima k větším vlnovým délkám, doprovázenému navíc zvýšením kvantového výtěžku fluorescence a tím i její intenzity.
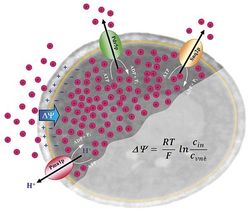
Samotné sledování průběhu a míry intracelulární akumulace diS-C3(3) se opírá o změny spekter způsobené vazbou sondy na makromolekuly cytosolu. Jelikož polohy maxim emisních spekter fluorescence volné a vázané sondy se liší o 13 nm, vede zvyšování relativního množství sondy akumulované v buňkách k postupnému posuvu od hodnoty charakteristické pro čistý vodný roztok k hodnotě blízké fluorescenci sondy vázané. V praxi pak zpravidla měříme závislost polohy maxima fluorescenčního signálu na čase od přidání sondy do buněčné suspenze, tzv. „barvicí křivku“. Pomocí ní můžeme snadno sledovat v reálném čase změnu membránového potenciálu vyvolanou chemickým stresorem, např. depolarizaci, je-li látka přidána k již obarvené suspenzi buněk.
Celková míra akumulace diS-C3(3) v buňkách kvasinek závisí nejenom na velikosti membránového potenciálu, ale také na její sekundární akumulaci v mitochondriích, vlivu buněčné stěny na ustavení rovnovážných koncentrací a aktivním odstraňování sondy z buněk MDR pumpami, které vede ke snižování její intracelulární koncentrace. První dva faktory představují výraznou komplikaci při interpretaci experimentů, které je proto nutné provádět takovým způsobem, aby bylo možné předpokládat, že stav mitochondrií ani stav buněčné stěny se v rámci daného experimentu nemění.
Naproti tomu činnost membránových pump je ve skutečnosti výhodou, díky které lze diS-C3(3) kromě monitorování změn membránového potenciálu používat také ke sledování aktivity těchto pump. Oba tyto efekty se samozřejmě navzájem překrývají a nelze je od sebe jednoduše oddělit. Díky existenci bezpumpových mutantů kvasinek však lze pomocí fluorescence diS-C3(3) získat řadu relevantních údajů o faktorech ovlivňujících jak membránový potenciál kvasinek, tak aktivitu jejich membránových pump.
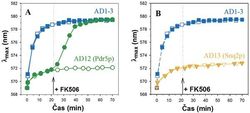 Významným mezníkem, který vedl k explozivnímu rozvoji aplikací naší metody, bylo zjištění, že sonda pasivně vstupující do buněk podle membránového potenciálu je z buněk aktivně odstraňována dvěma hlavními MDR pumpami kvasinek S. cerevisiae (Pdr5p a Snq2p). Za použití setu izogenních mutantních kmenů (jejich genomy se navzájem liší pouze tím, zda gen pumpy je, či není přítomen) je možné studovat vliv těchto pump na rychlost akumulace sondy v buňkách, vyhledávat účinné inhibitory jejich činnosti včetně stanovení minimálních inhibičních koncentrací a přitom současně sledovat jejich vliv na membránový potenciál.
Významným mezníkem, který vedl k explozivnímu rozvoji aplikací naší metody, bylo zjištění, že sonda pasivně vstupující do buněk podle membránového potenciálu je z buněk aktivně odstraňována dvěma hlavními MDR pumpami kvasinek S. cerevisiae (Pdr5p a Snq2p). Za použití setu izogenních mutantních kmenů (jejich genomy se navzájem liší pouze tím, zda gen pumpy je, či není přítomen) je možné studovat vliv těchto pump na rychlost akumulace sondy v buňkách, vyhledávat účinné inhibitory jejich činnosti včetně stanovení minimálních inhibičních koncentrací a přitom současně sledovat jejich vliv na membránový potenciál.
Kvantitativní měření
Kromě kvalitativního sledování změn membránového potenciálu na základě rozdílů v barvicích křivkách začínáme v poslední době využívat také alternativní způsob vyhodnocování spekter diS-C3(3) fluorescence, založený na jejich rozkladu na složky odpovídající fluorescenci volné sondy v médiu a vázané sondy akumulované v buňkách, což při splnění určitých dobře definovaných předpokladů umožňuje měřit změny membránového potenciálu v milivoltech.
Na rozdíl od prostého kvalitativního zjišťování, zda membránový potenciál roste nebo klesá hodně či málo, založeného na jednoduchém měření intenzity fluorescence nebo polohy emisního maxima potenciometrické sondy, jsme schopni tímto způsobem hodnotit velikost změn membránového potenciálu v absolutní škále (mV), což vylepší možnost interpretace jeho role v různých procesech probíhajících v kvasinkách.
Ke stažení
 článek ve formátu pdf [595,79 kB]
článek ve formátu pdf [595,79 kB]

























