Jak funguje (a někdy nefunguje) imunitní systém
| 12. 2. 2009Imunitní systém chrání organismus před patogeny a odstraňuje abnormální buňky. Aby mohl fungovat, potřebuje rozlišit struktury patogenů a poškozených buněk od vlastních normálních struktur. Tomu slouží povrchové receptory na různých typech bílých krvinek (leukocytů) a „rozpustné rozpoznávací molekuly“, především protilátky. Když nežádoucí složky pozná, musí je likvidovat, ale nesmí imunitními „zbraněmi“ poškozovat vlastní organismus.
Neadaptivní (přirozený) imunitní systém
Imunitní systém obratlovců má neadaptivní a adaptivní (antigenně specifickou) část.Evolučně starší neadaptivní systém tvoří několik typů fagocytů (buněk pohlcujících mikroorganismy), složitá soustava sérových proteinů souhrnně zvaných komplement a různé rozpustné rozpoznávací a výkonné molekuly. Rozpustné rozpoznávací molekuly i receptory vázané na buněčnou membránu rozeznávají molekulární struktury charakteristické pro celé skupiny mikroorganismů. To jsou nejčastěji sacharidové struktury, ale také biopolymery (teichoové kyseliny, lipopolysacharidy, lipoproteiny, nukleové kyseliny). Například povrchové polysacharidy některých mikroorganismů, složené z manózových jednotek, rozeznává sérový lektin, který váže manózu (MBL). Když se lektin naváže na mikrobiální polysacharid, aktivují se proteolytické podjednotky jeho molekuly a spustí komplementovou kaskádu – soustavu po sobě jdoucích proteolytických reakcí sérových proteinů C2 až C9. Mikroorganismus je posléze obalen proteinem C3b a jeho membrána je proděravěna. Tvoří se také chemotaktické molekuly C3a a C5a, které do místa infekce přivábí fagocyty. Ty poznají pomocí svých povrchových komplementových receptorů mikrobiální částice obalené (opsonizované) lektinem MBL a proteinem C3b a pohltí je.
 Fagocyty mohou mikroorganismy rozeznávat také přímo, pomocí svých povrchových receptorů. Mezi nejdůležitější patří „Toll-like receptors“ (TLR), které rozeznávají řadu typických mikrobiálních produktů obecně zvaných „pathogen-associated molecular patterns“ (PAMP), jako např. lipopolysacharidy, lipoproteiny, dvouvláknovou RNA, bakteriální DNA, protein flagelin atd. U člověka známe 10 různých TLR,, ježovka Strongylocentrotus purpuratus jich má 222. Jejich název je odvozen od receptoru Toll, který byl poprvé popsán u octomilky. Vazba cílové molekuly (např. bakteriálního lipopolysacharidu) na tento receptor vyvolá signalizační procesy, které aktivují fagocyty, vyvolají sekreci cytokinů („hormonů imunitního systému“) a jiných látek způsobujících zánětlivé reakce. Ještě důležitější je role TLR při aktivaci dendritických buněk, jež pak zahajují antigenně specifickou imunitní odpověď (viz dále).
Fagocyty mohou mikroorganismy rozeznávat také přímo, pomocí svých povrchových receptorů. Mezi nejdůležitější patří „Toll-like receptors“ (TLR), které rozeznávají řadu typických mikrobiálních produktů obecně zvaných „pathogen-associated molecular patterns“ (PAMP), jako např. lipopolysacharidy, lipoproteiny, dvouvláknovou RNA, bakteriální DNA, protein flagelin atd. U člověka známe 10 různých TLR,, ježovka Strongylocentrotus purpuratus jich má 222. Jejich název je odvozen od receptoru Toll, který byl poprvé popsán u octomilky. Vazba cílové molekuly (např. bakteriálního lipopolysacharidu) na tento receptor vyvolá signalizační procesy, které aktivují fagocyty, vyvolají sekreci cytokinů („hormonů imunitního systému“) a jiných látek způsobujících zánětlivé reakce. Ještě důležitější je role TLR při aktivaci dendritických buněk, jež pak zahajují antigenně specifickou imunitní odpověď (viz dále).
Na povrchu fagocytů (ale také dendritických buněk) je řada lektinů (nejznámější je DC-SIGN), což jsou receptory rozeznávající mikrobiální sacharidové struktury.
Zvláštním typem buněk neadaptivního systému jsou NK-buňky (název pochází od „natural killer“ – „přirozený zabíječ“). Rozpoznávají a likvidují buňky, které mají abnormálně nízké množství MHC-proteinů I. třídy (MHC-I; lidské HLA-A, -B, -C), což je typické pro mnohé nádorové a některé virově infikované buňky. Mají dva typy receptorů – aktivační a inhibiční. Inhibiční receptory vážou proteiny MHC-I, a pokud jich je málo, je inhibiční signál příliš slabý a aktivační receptory spustí likvidaci abnormální buňky.
Na pomezí mezi přirozeným a antigenně specifickým imunitním systémem stojí přehlížené, ale mimořádně důležité přirozené protilátky. Vznikají průběžně v poměrně značném množství, bez jakékoli stimulace nějakým konkrétním antigenem. Vážou nejrůznější chemické struktury včetně těch, které jsou typické pro povrch bakterií a jiných mikroorganismů. Patří mezi ně také známé protilátky proti antigenům krevních skupin, které kromě bakteriálních sacharidových struktur rozeznávají sacharidy na povrchu některých cizorodých červených krvinek (a působí tak komplikace při transfuzích krve).
Adaptivní (antigenně specifický) imunitní systém
 Tato část imunitního systému funguje na zcela jiném principu. Jejím základem jsou lymfocyty B a T. Každý z obrovského počtu jejich klonů je vybaven unikátními specifickými receptory B (povrchovými imunoglobuliny, BCR) respektive T (TCR), které se od ostatních liší strukturními detaily vazebného místa. Kritické úseky genů kódujících vazebná místa těchto receptorů se během vývoje lymfocytů náhodně přeskupují, takže vzniká obrovský repertoár desítek milionů různých klonálních variant, které jsou připraveny na setkání s jakoukoli cizorodou chemickou strukturou (antigenem). Tento systém je ve srovnání s neadaptivním systémem neobyčejně „marnotratný“ – většina z obrovského množství receptorových specifit se nikdy neuplatní a je připravena jen „pro každý případ“. Antigenně specifické receptory rozeznávají především jemné detaily antigenní struktury, zatímco receptory neadaptivní části se soustřeďují na hlavní hrubé rysy nejcharakterističtějších mikrobiálních molekul.
Tato část imunitního systému funguje na zcela jiném principu. Jejím základem jsou lymfocyty B a T. Každý z obrovského počtu jejich klonů je vybaven unikátními specifickými receptory B (povrchovými imunoglobuliny, BCR) respektive T (TCR), které se od ostatních liší strukturními detaily vazebného místa. Kritické úseky genů kódujících vazebná místa těchto receptorů se během vývoje lymfocytů náhodně přeskupují, takže vzniká obrovský repertoár desítek milionů různých klonálních variant, které jsou připraveny na setkání s jakoukoli cizorodou chemickou strukturou (antigenem). Tento systém je ve srovnání s neadaptivním systémem neobyčejně „marnotratný“ – většina z obrovského množství receptorových specifit se nikdy neuplatní a je připravena jen „pro každý případ“. Antigenně specifické receptory rozeznávají především jemné detaily antigenní struktury, zatímco receptory neadaptivní části se soustřeďují na hlavní hrubé rysy nejcharakterističtějších mikrobiálních molekul.
Rozpustnou formou antigenně specifických receptorů B-lymfocytů jsou obecně známé a mimořádně důležité protilátky.
Antigenně specifická část imunitního systému funguje tedy na principu „konfekčního obchodu“: Když se do organismu dostane nějaký cizorodý antigen, poměrně rychle se setká s B-lymfocytem, který má na povrchu takový receptor, jenž ho dostatečně silně naváže (podobně jako jakýkoli zákazník najde po chvíli hledání v konfekčním obchodě oblek, který mu celkem dobře padne). Takový B-lymfocyt je pak stimulován, začne se dělit, a posléze se většina z tisíců dceřiných buněk přemění na plazmatické buňky, které vylučují velká množství protilátek stejné struktury a specifity, jakou měl povrchový receptor na původní buňce B.
 Důležité je, že protilátkový „konfekční obchod“ zaměstnává také jakéhosi zakázkového krejčího, který vybraný oblek „došívá přesně na míru“. Tímto „krejčím“ je unikátní mechanismus afinitní maturace, založený na somatických mutacích v imunoglobulinových genech B-lymfocytů. Rychle se dělící stimulované B-lymfocyty aktivují intenzivní náhodné mutační procesy a vzniká velký počet mutantních receptorů. Většina z nich váže antigen hůře než původní receptor, ale některé varianty vážou antigen silněji. Klony B-lymfocytů nesoucí tyto „kvalitnější“ receptory pak dostávají silnější signály pro růst, zatímco ostatní klony hynou. Ukázkový darwinistický proces mutační „afinitní maturace“ může proběhnout v několika kolech a výsledkem mohou být protilátky s více než milionkrát vyšší afinitou k antigenu. Během procesu se také mění typ produkované protilátky – namísto původních IgM se začnou produkovat protilátky třídy IgG, IgA nebo IgE. Změna typu je velmi důležitá, protože různé třídy imunoglobulinů se odlišně vážou na Fc-receptory na jiných buňkách a velice rozdílně spolupracují s jinými imunitními mechanismy (např. s komplementovou soustavou). K tomu, aby mohly začít děje afinitní maturace a změny typu produkované protilátky (izotypový přesmyk), je nezbytné, aby B-lymfocyt dostal kromě primárního signálu po rozeznání specifického antigenu ještě „pomocné“ signály od pomocných T-lymfocytů.
Důležité je, že protilátkový „konfekční obchod“ zaměstnává také jakéhosi zakázkového krejčího, který vybraný oblek „došívá přesně na míru“. Tímto „krejčím“ je unikátní mechanismus afinitní maturace, založený na somatických mutacích v imunoglobulinových genech B-lymfocytů. Rychle se dělící stimulované B-lymfocyty aktivují intenzivní náhodné mutační procesy a vzniká velký počet mutantních receptorů. Většina z nich váže antigen hůře než původní receptor, ale některé varianty vážou antigen silněji. Klony B-lymfocytů nesoucí tyto „kvalitnější“ receptory pak dostávají silnější signály pro růst, zatímco ostatní klony hynou. Ukázkový darwinistický proces mutační „afinitní maturace“ může proběhnout v několika kolech a výsledkem mohou být protilátky s více než milionkrát vyšší afinitou k antigenu. Během procesu se také mění typ produkované protilátky – namísto původních IgM se začnou produkovat protilátky třídy IgG, IgA nebo IgE. Změna typu je velmi důležitá, protože různé třídy imunoglobulinů se odlišně vážou na Fc-receptory na jiných buňkách a velice rozdílně spolupracují s jinými imunitními mechanismy (např. s komplementovou soustavou). K tomu, aby mohly začít děje afinitní maturace a změny typu produkované protilátky (izotypový přesmyk), je nezbytné, aby B-lymfocyt dostal kromě primárního signálu po rozeznání specifického antigenu ještě „pomocné“ signály od pomocných T-lymfocytů.
Proběhnou-li úspěšně všechny fáze protilátkové odpovědi, vytvoří se z příslušných antigenně specifických B-lymfocytů plazmatické buňky. Ty produkují velké množství specifických protilátek, které se navážou na cizorodé antigenní struktury a pomohou je zneškodnit. V organismu zůstávají zvýšené koncentrace těchto protilátek po dlouhou dobu (měsíce až roky) a stávají se součástí rychlého obranného systému – okamžitě se navazují na příslušný mikroorganismus, který by opět pronikl do těla, a zabraňují tak většinou velmi účinně infekci v raných fázích.
Některé B-lymfocyty se vyvinou v paměťové B-lymfocyty, které protilátky neprodukují (nebo jen málo), ale při setkání se stejným nebo podobným antigenem se mnohem rychleji pomnoží, diferencují na plazmatické buňky a vytvářejí kvalitní protilátky. Některé paměťové buňky se mění v plazmatické buňky produkující velká množství specifických protilátek i bez opětného kontaktu se specifickým antigenem – stačí jim k tomu některé „nespecifické“ stimuly (typické bakteriální produkty jako lipopolysacharidy).
U T-lymfocytů je to velmi podobné, avšak většina těchto antigenně specifických buněk nerozeznává antigen jako takový, ale jeho fragmenty navázané na proteiny MHC na povrchu buněk infikovaných intracelulárními parazity (např. viry); u T-lymfocytů také nefunguje systém afinitní maturace („došívání na míru“). Smyslem tohoto zdánlivě bizarně složitého mechanismu je, aby imunitní systém získal přístup i k antigenům pocházejícím z nitrobuněčných parazitů a aby mohl odhalit buňky jimi infikované.
Antigenně specifický imunitní systém je značně komplikovaný a zásadní roli v něm hrají růné mezibuněčné interakce. Existuje několik spojovacích článků mezi neadaptivní a antigenně specifickou částí imunitního systému. Pouze některé typy antigenů (např. bakteriální polysacharidy) jsou schopny vyvolat tvorbu protilátek jednoduchým způsobem, tj. přímou stimulací vhodných klonů B-lymfocytů. Ve velké většině případů je celý děj mnohem složitější a probíhá takto:
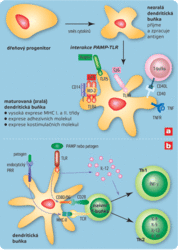
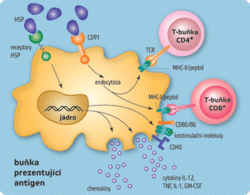
Antigenní částice (mikroorganismy nebo jejich fragmenty) jsou nejprve pohlceny tkáňovými dendritickými buňkami (tj. buňkami podobnými fagocytům, jež jsou roztroušeny ve všech tkáních, zejména pod kůží a ve sliznicích). Dendritické buňky jsou poté stimulovány k putování do nejbližší lymfatické uzliny a k přeměně v zralé dendritické buňky, jež fungují jako profesionální buňky prezentující antigen (APC). Zralé dendritické buňky mají na svém povrchu několik druhů kostimulačních molekul (čili molekul posilujících stimulaci, např. CD80, CD86, CD40) a velké množství proteinů MHC, které „vystavují“ fragmenty mikrobiálních antigenů. Produkují také řadu membránových a rozpustných cytokinů, jakýchsi imunitních proteinových hormonů. Fragmenty antigenů navázané na proteiny MHC rozeznávají T-lymfocyty, které mají na svém povrchu „správné“ T-receptory. Signály, jež dostane T-lymfocyt od buňky prezentující antigen, vyvolají pomnožení příslušného klonu T-lymfocytů a diferenciaci na zralé, výkonné buňky. Interakce mezi buňkou prezentující antigen a T-lymfocytem však není zcela jednostranná a buňka, která antigen předkládá, není jen pasivní předkladatel a stimulátor. Aktivovaný T-lymfocyt totiž také stimuluje zralou dendritickou buňku a dále zlepšuje její schopnosti prezentovat antigeny a stimulovat jiné T-lymfocyty.
Další dosud ne zcela dořešenou komplikací je to, že zřejmě existuje několik typů (snad jen diferenciačních stadií) dendritických buněk, které mají velmi rozdílné stimulační vlastnosti – některé přednostně stimulují diferenciaci různých typů T-lymfocytů, jiné naopak diferenciaci potlačují. Pokud totiž dendritická buňka nemá na povrchu dostatek molekul posilujících stimulaci, vede stimulace přes TCR k apoptotické smrti T- lymfocytu nebo k jeho útlumu. Důležitou regulační úlohu hrají „negativní kostimulační receptory“ na povrchu T-lymfocytů (např. CTLA-4), které potlačují příliš silnou stimulaci T-lymfocytů.
Nevýhodou antigenně specifického systému je, že plné rozvinutí obranných mechanismů proti antigenům, s nimiž se setkáváme poprvé, trvá poměrně dlouho (několik dní). Jako nezbytná „první linie obrany“ tedy musí sloužit evolučně starší neadaptivní systém (fagocyty, lektiny, komplement, ale také výše zmíněné přirozené protilátky) a pomalejší ale přesnější antigenně specifické mechanismy zajistí až definitivní dokončení obranné reakce. Antigenně specifické mechanismy jsou však velmi rychlé a účinné v případech opakovaného setkání se stejným antigenem (díky přítomnosti ochranných protilátek z předchozího setkání a paměťových lymfocytů T a B).
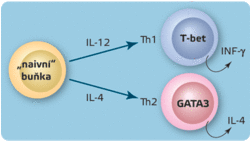
Vzájemná regulace protilátkových a zánětlivých imunitních reakcí Základní dogma dnešní imunologie říká, že typ adaptivní, antigenně specifické odpovědi závisí na typu parazita: protilátkové odpovědi, založené na spolupráci lymfocytů B a pomocných lymfocytů T (Th; hlavně Th2), jsou účinné pro potlačení extracelulárních parazitů, zatímco zánětlivé odpovědi, založené na spolupráci jiného typu pomocných lymfocytů T (Th1), makrofágů a tzv. cytotoxických lymfocytů T (Tc), se rozvíjejí hlavně při boji proti vnitrobuněčným parazitům. Ve většině reálných infekcí se uplatňují do určité míry obě reakce, avšak jedna z nich zpravidla výrazně převládá.
Pokud imunitní systém zvolí základní typ odpovědi nesprávně, může to mít fatální důsledky. Např. u těžké formy lepry se tvoří velké množství protilátek, které jsou ale proti intracelulárním mykobakteriím prakticky neúčinné.
Pro regulaci imunitní odpovědi je zásadní, že se buňky Th1 a Th2 vzájemně potlačují. Je-li tedy zahájen jeden typ antigenně specifické odpovědi (buď zánětlivá, nebo protilátková), automaticky sám sebe posiluje a silně potlačuje typ druhý. To je způsobeno tím, že hlavní cytokinový produkt buněk Th1 (IFN-γ) brání diferenciaci buněk Th2, zatímco hlavní produkt buněk Th2 (IL- 4) zamezí vývoji buněk Th1. Antagonismus Th1 a Th2, neboli IFN-γ a IL-4, je považován za základní imunoregulační mechanismus.
Co ale rozhodne o tom, zda se diferenciace prekurzorových T-lymfocytů rozběhne směrem k Th1, nebo k Th2? Určujícím faktorem je cytokinové prostředí, tedy které cytokiny produkují buňky prezentující antigen. Převaha interleukinu-12 (produkovaného obvykle zralými dendritickými buňkami) podporuje vznik Th1, kdežto převaha interleukinu 4 (produkovaného např. tkáňovými žírnými buňkami) vede k vzniku Th2.
Dendritické buňky jsou důležitým spojovacím článkem mezi adaptivní a antigenně specifickou částí imunitního systému. Tkáňové nezralé dendritické buňky musí být nejprve stimulovány, aby se přeměnily v buňky prezentující antigen (APC), což je klíčové pro fungování antigenně specifických mechanismů. Zde se zřejmě rozhoduje o tom, proti kterým cizorodým strukturám bude imunitní odpověď vůbec zahájena. K iniciaci intenzivních imunitních reakcí totiž obvykle nestačí, aby daná struktura byla cizorodá, ale musí být navíc ještě rozpoznána jako „nebezpečná“. Imunitní systém musí současně s rozeznáním něčeho „cizího“ dostat nějaký „signál nebezpečí“. Signály nebezpečí mohou být dvojího druhu – vnější a vnitřní. Jako silné vnější signály nebezpečí působí typické struktury patogenních mikroorganismů, tedy stejné struktury, které aktivují neadaptivní imunitní mechanismy (PAMPS – lipopolysacharidy, prokaryotická DNA, dvojvláknová RNA). Jako vnitřní signál nebezpečí působí některé vnitrobuněčné molekuly, zvláště stresové proteiny (HSP – heat shock proteins), které se uvolní z buňky umírající nefyziologickým způsobem (nekroticky). Molekuly sloužící jako indikátory nebezpečí se vážou na receptory dendritických buněk (receptory TLR, lektinové receptory, receptory stresových proteinů) a vyvolávají signály vedoucí k diferenciaci v zralé dendritické buňky. Teprve ony jsou pak schopny účinně stimulovat diferenciaci antigenně specifických T-lymfocytů.
Zásadně důležitý je ještě další typ regulace založený na regulačních (tlumivých) T-lymfocytech (Treg). Ty potlačují nežádoucí imunitní reakce (napadání buněk a tkání organismu vlastních, příliš intenzivní reakce proti patogenům, jejichž vedlejší účinky by mohly organismus poškodit, chronické zánětlivé reakce atd.).
Výkonné imunitní mechanismy
Když jsou cizorodé a potenciálně nebezpečné struktury rozeznány, je samozřejmě potřeba je buď odstranit, nebo zneškodnit. K tomu účelu má imunitní systém k dispozici řadu zbraní. Mezi evolučně nejstarší patří baktericidní peptidy i další „chemické zbraně“ (peroxid vodíku, chlornany, oxid dusnatý) a dále fagocytóza neboli pohlcování mikroorganismů různými typy granulocytů, makrofágů a dendritických buněk.Velmi důležitým procesem je zánět – komplexní fyziologická reakce, která v místě infekce vytváří podmínky pro koordinované působení mnoha imunitních mechanismů, především pro přísun fagocytů, protilátek a dalších výkonných molekul.
Dalším mechanismem je zabíjení infikovaných nebo jinak abnormálních buněk cytotoxickými T-lymfocyty (Tc) a NK-buňkami. Tyto buňky používají perforiny, proteiny, jimiž učiní membránu napadené buňky propustnou pro granzymy. To jsou enzymy vyloučené buňkami Tc a NK, které v napadené buňce vyvolají apoptotickou smrt. Jiný způsob zabíjení je založen na tom, že buňky Tc a NK mají na svém povrchu protein zvaný Fas-ligand, který po navázání na receptor Fas na napadené buňce opět nastartuje „apoptotickou sebevraždu“.
Důležitými výkonnými molekulami jsou také protilátky (imunoglobuliny), které:
- blokují povrchové molekuly patogenů ne zbytné k ukotvení či průniku do infikované buňky;
- aktivují komplementovou kaskádu (což ve de k další opsonizaci mikroorganismu, při lá kání fagocytů a v některých případech k perforaci povrchové membrány parazita);
- výrazně zlepšují fagocytózu částic.
Velmi zajímavé je nedávné zjištění, že téměř všechny protilátky mohou dosud nejasným způsobem katalyzovat produkci vysoce baktericidního ozonu a peroxidu vodíku (z vody a kyslíku).
Literatura
Hořejší V., Bartůňková J.: Základy imunologie, 3. vydání, Triton, Praha 2005Jako zdroj podrobnějších informací lze doporučit také velký počet specializovaných přehledných článků v časopise Nature Reviews Immunology (www.nature.com/nri/).
Ke stažení
 článek ve formátu pdf [1000,53 kB]
článek ve formátu pdf [1000,53 kB] příloha ve formátu pdf [1,73 MB]
příloha ve formátu pdf [1,73 MB]
O autorovi
Václav Hořejší


























