Jak se z hodné bílkoviny stane onkoprotein
Každá živá buňka obsahuje soustavu signálních drah, které přenášejí informace mezi buněčnými systémy. Jejich souhra dává buňce důležitou schopnost integrovat všechny signály a reagovat jako celek v závislosti na podmínkách, buněčném typu a také na historii, kterou buňka prošla. I historie se významně odráží ve strukturním a funkčním nastavení signálních drah, které se neustále mění – v každou chvíli je unikátní.
Molekula jako procesor
Jeden z důležitých proteinů, který se v buňce často vyskytuje na klíčových místech signálních drah regulujících její dělení, se jmenuje c-Src. Kódován je genem c-src, 1) který patří do rodiny devíti podobných genů a vyskytuje se pouze u mnohobuněčných živočichů. Protein c-Src patří mezi enzymy proteintyrozinkinázy, to znamená, že přenáší zbytek kyseliny fosforečné získaný štěpením adenozintrifosfátu (ATP) na hydroxylovou skupinu aminokyseliny tyrozinu v různých proteinech. Navázání fosfátového zbytku čili fosforylace je jedním z běžných způsobů, jimiž buňka reguluje aktivitu proteinů. Fosforylace určitého enzymu může ovlivnit například rychlost jeho práce nebo změnit jeho schopnost vázat jiné látky.Protein c-Src svou práci, tedy navazování fosfátového zbytku na jiné proteiny, nevykonává stále. Naprostou většinu času tráví ve „vypnutém“ stavu. Teprve když dostane signál od proteinu, který na signální dráze leží před ním, zapne se na krátkou dobu, aby signál předal dál. Je to kaskádovitá reakce, která vypadá, jako by si proteiny předávaly štafetový kolík. Tímto způsobem je rozkaz přes několik dalších stupňů předán systému, který jej provede, například začne překládat určitý gen.
Protein c-Src však nemá jen stavy „vypnuto“ a „zapnuto“, jeho aktivita může být utlumena několika způsoby. Hlavní roli hraje vazba jeho domén SH2 a SH3 na kinázovou doménu, která katalyzuje vlastní přenos fosfátu (obr. 1).2) Vazba domén SH způsobí přestavbu a „uzamčení“ místa, které fosforylaci vykonává. Některé jiné proteiny mají také místa, na něž se domény SH2 a SH3 můžou vázat, často i mnohem silněji. Takový protein může domény SH přimět, aby se raději vázaly na něj, čímž ovšem zruší vazby, které předtím udržovaly c-Src vypnutý. K jeho zapnutí je nutná také fosforylace aminokyseliny tyrozinu, ležícího na 416. místě proteinového řetězce (Tyr416). Fosforylace tyrozinu s číslem 527 je naopak naprosto nezbytná k vypnutí c-Src (číslování platí pro slepičí c-Src, u lidského jde o Tyr419 a 530).
Skutečný obraz buněčné signalizace tedy vypadá tak, že c-Src je součástí dynamického komplexu mnoha proteinů, které s ním neustále interagují. Některé z nich mu dávají signály k zapnutí, jiné zas k vypnutí. Výsledná aktivita c-Src závisí na tom, kterých signálů bude víc. Každý další signál k aktivaci může být tou poslední kapkou, která rozhodne o tom, jestli c-Src fosforyluje substrát nebo ne.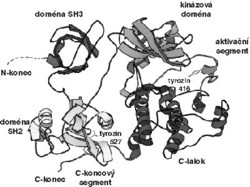
Vidíme tedy, že molekula c-Src není mechanický vykonavatel příkazů, ale složitý systém, jehož výstup je integrací mnoha vstupních informací. Variabilní není ale jen velikost aktivity c-Src. Pohledem na mapu buněčných signálních drah bychom zjistili, že c-Src leží na důležitých místech několika desítek různých drah. Přesto pozná, že když s ním vytvořil komplex protein náležející k dráze A, musí za daných podmínek fosforylovat protein B a ne jiný. To je opět zajištěno tím, že veškeré děje probíhají v komplexu mnoha molekul, které jsou provázány sítí vazeb, a správný substrát je c-Src „naservírován“ přímo na kinázovou doménu. Často dokonce obsahuje vhodné motivy pro vazebné domény samotného c-Src, takže oba proteiny jsou spolu po čas interakce svázány, a tím mají zajištěno, že budou vůči sobě orientovány ideálním způsobem.
Jak se aktivuje onkogen
Mezi nejlépe prostudované proteintyrozinkinázy patří c-Src nejen proto, že je z nich nejdéle znám (od roku 1970), ale také proto, že jeho role v buňce velmi úzce souvisí se vznikem zhoubných nádorů. Src totiž mimo jiné přenáší signály od receptorů pro tkáňové hormony stimulující buněčný růst. Není divu, že v buňkách izolovaných z mnoha lidských nádorů (osteosarkom, kolorektální karcinom) nacházíme mutovaný c-Src, jemuž chybějí aminokyseliny nezbytné pro přechod do vypnutého stavu. Jestliže je c-Src stále aktivní, buňka obrazně řečeno nabývá dojmu, že je neustále stimulována k růstu, a proto má snahu se dělit. Deregulovaný c-Src navíc fosforyluje proteiny nezbytné k tvorbě buněčných kontaktů. Vinou toho buňka nepozná, že je obklopena dalšími buňkami, což by pro ni v normálním stavu byl signál, aby se přestala dělit. Gen c-src, který tyto mutace nese, je proto označován jako onkogen (mutovaný protein c-Src je onkoprotein). Pochopitelně zde působí mechanizmy, které zajišťují, aby buňka nebyla vydána napospas první mutované kináze, se kterou se potká. Většinou se vzniku nekontrolovaného dělení ubrání, ale i tak porušení regulace cSrc vnese do buňky nestabilitu. Stačí pak malá mutace nebo jen aktivace vhodné signální dráhy, aby došlo k malignímu zvratu.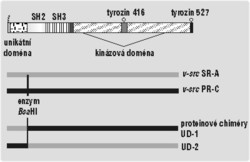
To, že před název src či Src stále píšeme písmeno c, které zdůrazňuje, že jde o buněčný sarkom, má svůj důvod. Jistý retrovirus, později nazvaný Rousův virus kuřecího sarkomu (RSV), totiž byl kdysi napaden kuřecí vazivovou buňkou a při tom pomocí rekombinace náhodou vyštěpil gen c-src a včlenil jej do svého genomu. Tak vznikl virový onkogen src čili v-src. Čím se liší od c-src? Především v-src během přenosu do viru ztratil část, která kóduje 19 posledních aminokyselin proteinu c-Src. Mezi nimi byl i zmiňovaný tyrozin 527. Ten leží v části kinázové domény příhodně nazývané „ocásek“ a slouží jako vazebné místo pro doménu SH2. Pokud ho v-Src ztratí, doména SH2 se nemůže vázat na kinázovou doménu a udržovat ji neaktivní. Src je potom stále zapnutý, podobně jako když je mutován v lidských nádorech. Z infikované buňky se působením v-Src stala buňka nádorová a začala se množit i s genomem viru včleněným do své DNA. Rousův virus tak přinutil hostitele, aby vyprodukoval neobyčejné množství kopií virového genomu. Zároveň si ale podřízl větev sám pod sebou. Začleněním v-src se zhoršila schopnost viru množit se v buňkách, a tak už se nedokázal přenést na nového hostitele. V přírodě se s ním proto dnes nesetkáme. Jeho kmeny se dochovaly jenom proto, že je Peyton Rous roku 1910 z nemocného kuřete izoloval.
Jeho objevu zpočátku téměř nikdo nevěřil, neboť o onkogenech a retrovirech pochopitelně začátkem 20. století nebylo nic známo. Onkogen v-src byl v Rousově viru nalezen teprve roku 1970. Od té doby byla objevena řada dalších virových onkogenů, ale onkoprotein v-Src se dosud intenzivně studuje, neboť je považován za model jednoho ze základních principů onkogeneze a předpokládá se, že nám jeho pochopení poskytne důležitý vhled do vzniku lidských nádorů.
Proteinové chiméry a studium mutací
Výzkumem regulace nebo spíše deregulace v-Src jsem se zabýval i ve své práci. Využil jsem toho, že různé kmeny Rousova viru kuřecího sarkomu nesou formy v-Src, které se navzájem liší několika mutacemi vzniklými během pěstování viru v laboratořích. Jejich kinázová aktivita (množství přenesených fosfátů za jednotku času) se může v některých systémech lišit až třicetinásobně. Nejnovější poznatky podporují hypotézu, že všechny kmeny v-Src jsou aktivovány ztrátou tyrozinu 527, ale některé z nich mají více či méně zachované jiné mechanizmy regulace. Problém je, že dnes o žádném mechanizmu není známo, že by po ztrátě tyrozinu 527 fungoval.Určitou cestou jak zachovaný mechanizmus najít by bylo testování efektu jednotlivých aminokyselinových záměn, kterými se od sebe více a méně aktivní varianty v-Src liší. Varianty v-Src vzniklé během kultivace viru navíc prošly téměř přirozeným výběrem mezi různými mutanty. Jejich mutace proto nebudou náhodně rozmístěné, ale budou zasahovat hlavně „zajímavé“ aminokyseliny. Geny variant v-src jsem proto rozdělil na několik úseků, ty pak zase spojil, ovšem tak, že jedna část – zvaná unikátní doména – byla přidána z jiné varianty. Takový konstrukt se poeticky jmenuje proteinová chiméra. Unikátní doménu jsem si vybral hlavně proto, že není známa její funkce a předpokládá se, že může vázat kinázovou doménu a možná i několik membránových proteinů. S chimérami jsem zatím provedl testy kinázové aktivity. Ty ukázaly, že rozdíly mezi unikátními doménami mají pouze mírný vliv na aktivitu v-Src, a tedy rozdíly mezi PR-C a SR-A nevysvětlují. V budoucnu lze očekávat zajímavější výsledky od konstrukce dalších chimér a testů jejich vazebné aktivity a buněčné lokalizace.
Poznámky
Citát
Kevin Davies: Rozluštěný genom
Paseka, Praha 2003, s. 47–48
Když Stephen Hawking napsal první verzi své slavné Stručné historie času, upozornil ho jeho redaktor, že rukopis je příliš technicky zaměřený a že každá rovnice zmenší prodejnost knihy o 50 %. Hawking proto neochotně vyřadil veškerou matematiku – kromě jediné rovnice: E = mc2. Stejná úvaha by mohla platit pro zveřejnění celé sekvence DNA, i když tu byly výjimky.
Jurský park, nejprodávanější kniha Michaela Crichtona o znovuzrození dinosaurů, popisovala kousek předpokládané dinosauří sekvence extrahované z jantaru. Mark Boguski, expert na bioinformatiku na Národním ústavu zdraví, Crichtonovu sekvenci prověřil a byl zklamán, když zjistil, že zdrojem zmíněné DNA nebyl dinosauří bratranec v evoluci, nějaký pták nebo plaz, nýbrž bakterie. „Můj respekt k vědeckým schopnostem dr. Wu (vědce v Jurském parku) se zcela vytratil,“ žertoval Boguski, „vždyť nebyl schopen identifikovat pomocí tří Crayových počítačů to, co mně trvalo dvě minuty na Macintoshi“. K Boguského překvapení ho Crichton vyzval, aby poskytl segment DNA pro další díl, Ztracený svět. Boguski ochotně poskytl sekvenci složenou ze slepice a žáby, ale aniž autorovi o tom řekl, připojil tam i skrytou zprávu, která po přeložení genetického kódu zněla: Mark was here čili Marek tady byl.
Ke stažení
 Článek ve formátu PDF [130,08 kB]
Článek ve formátu PDF [130,08 kB]

























