Chemické „mimikry“ v živých systémech
Chemická mimetika (hovorově mimikry) jsou látky, které napodobují strukturu složitých biologicky aktivních látek, ačkoliv samy mohou mít konstrukci velmi jednoduchou. To se hodí například pro výrobu léčiv. Díky novým technologiím dnes již můžeme připravovat, vybírat a zdokonalovat i mimetika lékařsky významných proteinů.
Proč to děláme? Některá léčiva jsou tak drahá, že jsou pro chudé země nedostupná a v bohatých zemích zatěžují občany i zdravotnické organizace. Výrobci to odůvodňují vysokými náklady vynaloženými na vývoj léčiva či na produkci některých složek. Poukazují na komplikovanou strukturu léčebných preparátů, zejména těch, které obsahují biologické makromolekuly, nebo dokonce bílkoviny, k nimž musí být připojeny složité sacharidy, například glykoproteiny. Produkce takových preparátů přirozeným způsobem (v buňkách) je drahá, a navíc se preparáty musí kontrolovat složitými analytickými metodami. Díky tomu, že toho dnes víc víme o struktuře cílových receptorů pro látky obsažené v léčivech, rozbíhají se pokusy nahradit složité léky stejně účinnými mimetiky s jednodušší strukturou.
První práce o těchto látkách se objevily již v polovině sedmdesátých let 20. století, ale šlo jen o několik organických sloučenin aktivujících ß-adrenergní receptory nervových buněk (používaly se zejména v porodnictví k tlumení děložních stahů). S rozvojem znalostí o struktuře dalších receptorových proteinů počet prací na toto téma vzrůstal a dnes přibudou asi dvě denně. S mimetiky se počítá při léčbě neurodegenerativních onemocnění, roztroušené sklerózy, infekčních chorob, nádorových onemocnění, poruch krevní srážlivosti a také v ochraně před neurotoxiny či jinými toxickými látkami nebo k posílení celkové obranyschopnosti buněk imunitního systému. Jednou z nejsložitějších skupin léčiv jsou mimetika, jejichž struktura je založena na komplexních oligosacharidech nebo glykoproteinech.
Příprava složitých oligosacharidů, které jsou různým způsobem rozvětvené, a navíc obsahují nabité funkční skupiny, patří v chemii k jednomu z nejtvrdších oříšků. Přesto se sacharidová léčiva vyvíjejí, protože jejich prostřednictvím lze ovlivňovat kontakty mezi buňkami imunitního systému, jejich pohyb v organizmu a vzájemné rozpoznávání. Pro funkci těchto buněk je kontakt důležitý, aby se při nebezpečí stačily dorozumět a zahájily obrannou reakci.
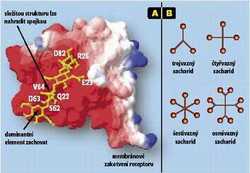
Na obranné reakce se specializují (mimo jiné) zabíječské buňky imunitního systému (viz tabulku Imunitní systém, Vesmír 78, 570, 1999/10 ve formátu PDF). Jestliže receptory těchto buněk rozpoznají na povrchu nádorově zvrhlých buněk přítomnost neobvyklé, např. sacharidové struktury, shluknou se, a tím vyvolají zabíječskou reakci. Vznik aktivujícího signálu zabíječských buněk je možno vyvolat propojením látek chemicky různorodých. Čím více molekul receptorů se vzájemně propojí do regulační sítě, tím intenzivnější bude aktivace zabíječské buňky. Struktury přirozených sacharidů aktivujících zabíječské buňky většinou nejsou známy, objeveny byly pouze struktury schopné plnit podobnou funkci. Tyto struktury jsou složité, obtížně dostupné, drahé a chemicky nestabilní, tedy jako látky aktivující imunitní reakci nevhodné. Mohou být ovšem nahrazeny mimetiky, v nichž pro silnou interakci postačí dominantní sacharid, zbytek lze nahradit (obr. obrázek).
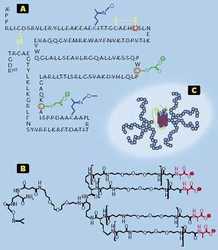
Také příprava glykoproteinových léčiv je obtížná, protože tyto látky musí být produkovány živými buňkami, což se pokaždé nepodaří. Příkladem léčiva tohoto typu je hormon erytropoetin, který podporuje vznik červených krvinek, a proto se podává anemickým pacientům nebo při těžkých pooperačních stavech (také ho zneužívají sportovci k zvýšení výkonnosti). Nedávno se podařilo tuto látku kompletně přetvořit na syntetický erytropoetický protein. Složitý oligosacharid (obr. obrázek A), jehož příprava bývá problematická, byl nahrazen syntetickým polymerem o přesně navržené struktuře (obr. obrázek B). Celá složitá bílkovinná molekula byla po částech připravena chemickou syntézou, a potom sestavena z jednotlivých bloků. Jak ukázala hydrodynamická měření, objem tohoto proteinového mimetika v roztoku mnohonásobně přesahuje objem srovnatelně velké bílkoviny. Hmotová spektrometrie naproti tomu prokázala, že molekula o velikosti asi 50 000 atomových jednotek je naprosto homogenní. Z léčebného hlediska je důležité, že se takové proteinové mimetikum udrží v krevním oběhu nesrovnatelně déle než molekula přirozená (řetězce, které ji chrání, jsou na obr. obrázek C zobrazeny modře). Pacientům lze tedy aplikovat menší počet dávek, a léčivo se chová defi novaným způsobem, což představuje z lékařského hlediska velkou výhodu.
Ke stažení
 Článek ve formátu PDF [308,66 kB]
Článek ve formátu PDF [308,66 kB]